
时间:2026-01-21浏览次数:257
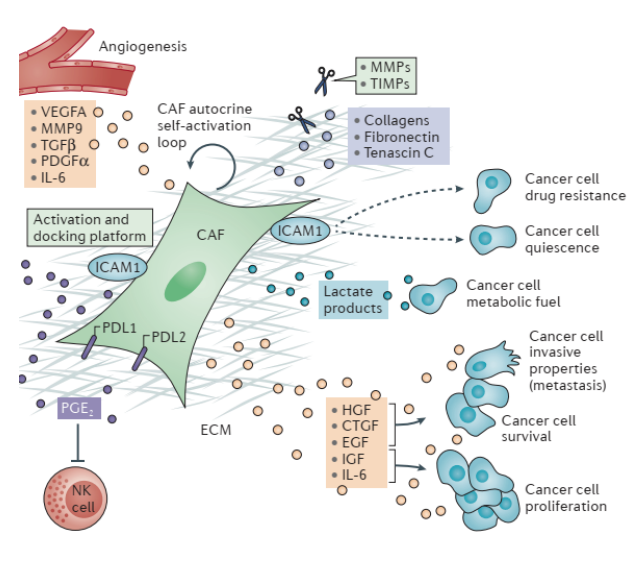
肿瘤相关成纤维细胞(cancer-associated fibroblast, CAF)是肿瘤微环境中最主要的成分之一,通过分泌TGF-β、HGF、IL-6等因子蛋白促进肿瘤细胞的增殖、耐药及侵袭转移,从而影响肿瘤的预后。CAF同时还参与血管淋巴管的生成、细胞外基质重塑、免疫抑制以及肿瘤细胞上皮间质转化等有利于肿瘤发生发展的外源性途径。靶向CAF已成为抗肿瘤药物研发的热点。
一、动态互作的核心机制
代谢互作:谷氨酰胺(Gln)的双向供应
CAFs通过增强谷氨酰胺合成酶(GS)表达,利用癌细胞产生的乳酸或谷氨酸再生谷氨酰胺,并分泌至肿瘤微环境(TME)中,为癌细胞提供能量和合成底物。例如,在三阴性乳腺癌中,CAFs通过G蛋白偶联雌激素受体(GPER)上调GS,满足癌细胞代谢需求。
癌细胞则通过分泌转化生长因子β(TGF-β)、外泌体等因子,诱导CAFs自噬和代谢重编程,增强谷氨酰胺合成能力。这种双向代谢共生形成依赖环境的代谢平衡,驱动肿瘤生长和转移。
旁分泌信号调控
CAFs分泌多种细胞因子(如IL-6、IL-8、CXCL12)和生长因子(如TGF-β、VEGF),通过旁分泌作用调控肿瘤细胞行为:
促进增殖与迁移:IL-6通过激活STAT3信号通路,增强肿瘤细胞增殖能力;CXCL12与肿瘤细胞表面CXCR4受体结合,促进迁移和侵袭。
诱导上皮-间质转化(EMT):TGF-β通过Smad信号通路诱导EMT,使肿瘤细胞获得迁移能力。
免疫抑制:TGF-β抑制树突状细胞(DC)成熟,促进调节性T细胞(Treg)分化,抑制细胞毒性T细胞活性。
细胞外基质(ECM)重塑
CAFs分泌胶原蛋白、纤维连接蛋白和基质金属蛋白酶(MMPs),重塑ECM的物理特性:
促进肿瘤细胞运动:ECM硬度增加和纤维排列改变为肿瘤细胞提供迁移轨道。
影响血管生成:通过分泌VEGF等因子,促进新生血管形成,为肿瘤提供营养。
形成药物渗透屏障:ECM固化抑制抗肿瘤药物和免疫细胞浸润,降低治疗效果。
二、对肿瘤功能的影响
促进肿瘤生长与存活
CAFs通过分泌生长因子(如EGF、HGF)和代谢物(如谷氨酰胺),直接促进肿瘤细胞增殖和能量供应。例如,在前列腺癌中,CAFs通过沉默RASAL3基因增强巨胞饮作用依赖的谷氨酰胺分泌,维持去势抵抗性前列腺癌生长。
增强肿瘤侵袭与转移
CAFs通过EMT和基质相互作用,为肿瘤细胞提供迁移能力。在乳腺癌中,肿瘤前沿的CAFs分泌MMPs,降解基底膜,促进肿瘤细胞浸润。此外,CAFs与肿瘤细胞的机械耦合允许肿瘤细胞局部侵袭和远端转移。
诱导治疗抵抗
CAFs通过代谢重编程和免疫抑制,使肿瘤细胞对化疗和免疫治疗产生抵抗。例如,在雄激素剥夺治疗中,表观遗传重编程的CAFs通过增强谷氨酰胺分泌,导致去势抵抗性前列腺癌。
三、活细胞分析的研究方法
共培养模型
将肿瘤细胞与CAFs共培养,模拟TME中的直接互作。通过活细胞成像技术(如荧光显微镜、共聚焦显微镜),实时观察细胞形态变化、迁移行为和代谢活动。例如,利用GFP-LC3标记自噬体,分析CAFs自噬对肿瘤细胞代谢的影响。
单细胞RNA测序(scRNA-seq)
揭示CAFs亚群的异质性及其与肿瘤细胞的互作网络。例如,通过scRNA-seq鉴定出炎性CAFs(iCAFs)、肌成纤维细胞CAFs(myCAFs)等亚型,并分析其分泌因子对肿瘤细胞干性的影响。
代谢组学与蛋白质组学
结合质谱分析,定量检测共培养体系中代谢物和蛋白质的动态变化。例如,通过代谢组学发现CAFs与肿瘤细胞之间的谷氨酰胺代谢串扰,为靶向治疗提供依据。
类器官与3D培养模型
利用患者来源的肿瘤类器官与CAFs共培养,模拟体内TME的复杂性。通过活细胞成像和功能实验,评估CAFs对肿瘤类器官生长、侵袭和治疗反应的影响。
四、构建肿瘤类器官-CAF共培养模型
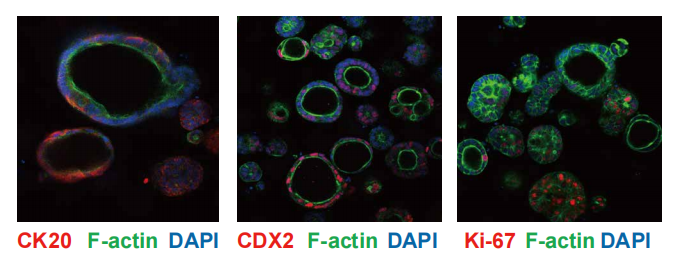
结直肠癌类器官特异性标志物荧光染色
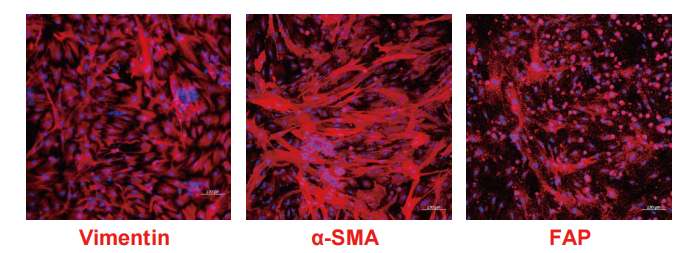
CAF特异性标志物荧光染色
五、肿瘤类器官-CAF共培养模型优势
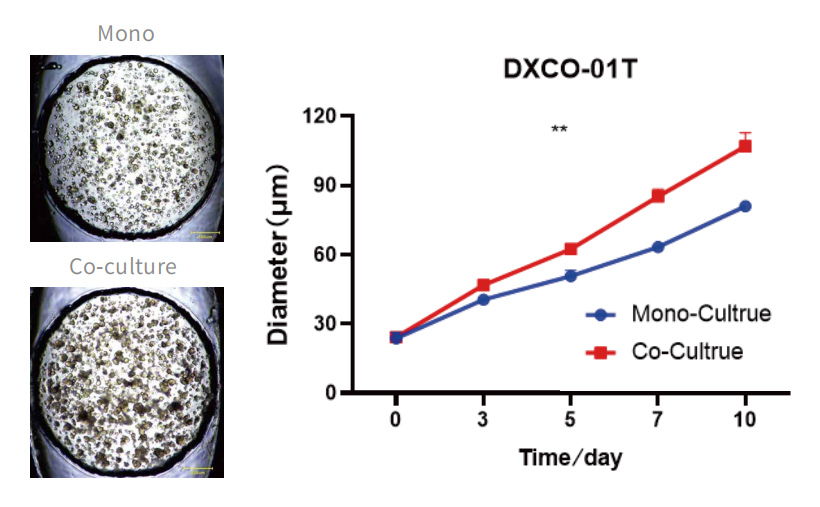
共培养体系中类器官生长速度更快
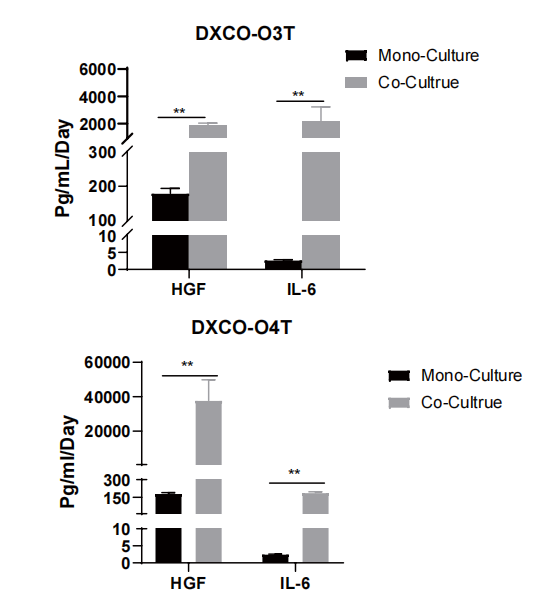
共培养体系中CAF分泌因子累积量更高
下一篇:类器官-免疫细胞共培养模型
