
时间:2026-01-21浏览次数:146
类器官是源自干细胞的三维细胞培养物,为个性化癌症治疗和精准医学带来了新机遇。然而,缺乏包括免疫细胞和基质细胞在内的肿瘤微环境(TME)是类器官技术的一个重大局限。
因此,目前正在开发肿瘤类器官与免疫细胞共培养的新策略,这为研究特定的癌症疗法开辟了新途径。此外,共培养有助于研究肿瘤微环境中的细胞间相互作用、揭示新的治疗靶点,还有助于发现用于疫苗开发的生物标志物和新抗原。
肿瘤免疫类器官构建方法
研究人员主要通过两种方式构建肿瘤免疫类器官模型:重建基质和免疫类器官模型以及原生免疫类器官模型。通俗来讲就是,一种方法是直接往类器官的培养体系中加入免疫细胞,另一种方法是先从患者体内获取肿瘤组织构建类器官,然后类器官分化扩增免疫细胞。后者构建方法不仅可以保留原始肿瘤的基质和免疫微环境,还可以保留肿瘤细胞和TME作用中重要的天然空间。
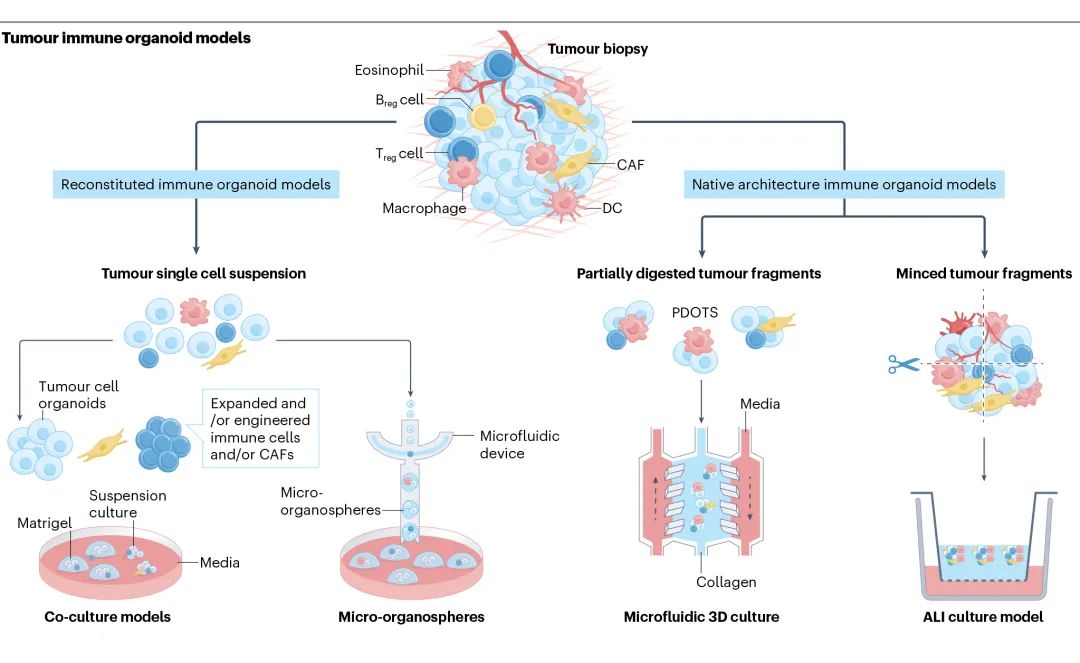
肿瘤免疫类器官构建方法(源自文献:doi: 10.1038/s41568-024-00706-6)
目前并不存在一种能同时适用于免疫细胞和类器官培养的通用培养基。因此,在共培养之前有必要开展精确的实验,以确定能让类器官增殖且不损害免疫细胞的最佳条件。
免疫细胞和类器官的培养都需要特定的细胞因子和生长因子。例如,白介素-2(IL-2)、白介素-7(IL-7)、白介素-15(IL-15)和白介素-21(IL-21)对免疫细胞培养至关重要,而Wnt3a、EGF、Noggin和R-spondin-1构成了类器官培养中最经典的细胞因子组合。
肿瘤免疫类器官应用
患者来源的类器官(PDOs)准确重建3D肿瘤结构,在临床反应预测中具有潜在应用价值。但是仅由肿瘤细胞构成的类器官无法模拟复杂肿瘤微环境,如免疫治疗、靶向治疗等引起的抗原呈递和抗肿瘤免疫反应,以及肿瘤微环境对药物反应的调控机制。
研究人员正积极致力于肿瘤类器官-免疫共培养模型的研究,力求在癌症治疗方面取得新突破。例如,将外周血淋巴细胞与非小细胞肺癌类器官共培养,有助于获得患者特异性T细胞。树突状细胞先与CD8+ T细胞共培养,再与患者来源的胃癌类器官共培养,可预测精准医疗的疗效,为胃癌患者带来更好的预后。此外,将CAR衍生细胞(如CAR-T、CAR-NK和CAR-M)与肿瘤类器官共培养,能够充分捕捉免疫治疗的分子和细胞过程。这有助于识别和选择合适的靶抗原,在预测疗效和毒性评估方面展现出巨大潜力。
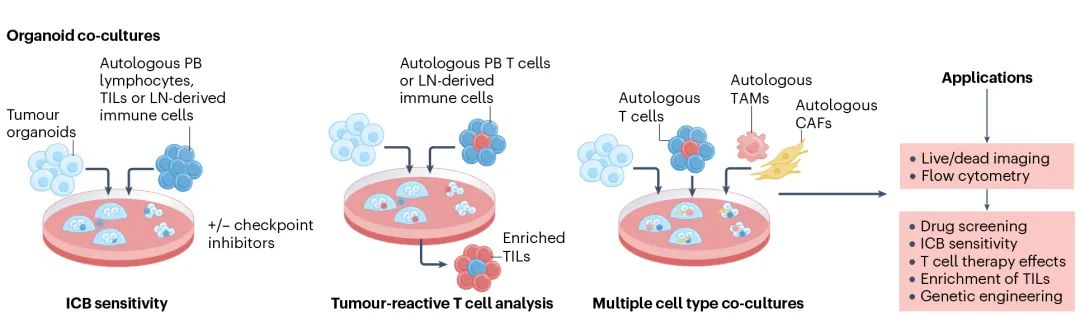
类器官-免疫共培养应用(源自文献:doi: 10.1038/s41568-024-00706-6)
肿瘤类器官与免疫细胞的共培养使三维类器官模型更接近其在体内的状态,为精准癌症治疗提供有价值的模型。肿瘤免疫类器官作为新兴研究工具,可以重现肿瘤微环境,为研究肿瘤发生发展机制提供帮助。还可通过多光谱成像、多重组织成像、流式细胞术等方法,分析免疫治疗后类器官中细胞表型、组织结构、蛋白质表达等变化,以评估免疫治疗效果。借助肿瘤免疫类器官模型,探索肿瘤免疫逃逸机制,为开发新的免疫治疗策略提供靶点和思路。
参考文献:
1. Polak, R., Zhang, E.T. & Kuo, C.J. Cancer organoids 2.0: modelling the complexity of the tumour immune microenvironment. Nat Rev Cancer 24, 523–539 (2024). https://doi.org/10.1038/s41568-024-00706-6
