
时间:2026-01-21浏览次数:239
肿瘤类器官-免疫共培养模型由三大核心组分构成:肿瘤细胞、免疫细胞及细胞外基质(ECM)(图1)。肿瘤细胞可来源于患者或已建立的癌细胞系,其中患者来源类器官(PDOs)具有更高的患者特异性关联。免疫细胞组分可包含外周血单个核细胞(PBMCs)、肿瘤浸润淋巴细胞(TILs)或经工程化改造的免疫细胞(如CAR-T细胞),用于探索特定免疫应答。ECM通常由Matrigel或胶原蛋白等水凝胶构成,既能提供三维结构支撑,又可调控细胞行为特征。为更好模拟体内复杂环境,共培养模型可整合癌症相关成纤维细胞(CAFs)、髓源性抑制细胞(MDSCs)或内皮细胞等肿瘤微环境组分。这些组分的精准筛选与组合对准确模拟肿瘤-免疫互作机制、探索癌症免疫治疗策略具有决定性作用。
1、类器官准备
1)提前一周,复苏培养类器官至状态良好;
2)取合适数量类器官,使用预冷PBS清洗数次,去除大部分基质胶;
3)使用培养基重悬类器官。
2、PBMC分离和类器官共培养
(1)外周血在无菌环境下,使用添加EDTA-K2的真空采血管采集,运输保存;
(2)将新鲜静脉血与PBS缓冲液1:1 稀释,轻轻混匀待用。
(3)添加4ml细胞分离液(Absin abs930),缓慢加入静脉血混合物8ml,静置待用。
(4)2000rpm 离心20min,在此过程中升降速度降至1,避免产生细胞融合。
(5)此时观察到15ml离心管为4层,轻轻吸取第2层白色悬浮物于15ml 离心管,混匀待用。
(6)1500rpm 离心10分钟,在此过程中升降速度降至1,避免产生细胞融合,弃上清。
(7)添加适量T细胞无血清基础培养基静置培养观察。T细胞无血清完全培养基的配置:向T细胞无血清基础培养基里添加IL-2(Absin abs05543)200-500单位/ml (刺激T细胞生长与增殖), CD3/CD28磁珠(Absin:abs160019)3ug/ml(激活T细胞)。
5)使用T细胞无血清完全培养基,悬浮调整至合适浓度,96孔板,每孔约加入5*105 活T细胞,100uL体积;
6)重悬类器官混合液,分别加入等量的样至96孔板中,至总体积200uL。
3、培养观察
1)D0观察记录类器官和T细胞状态;
2)37℃,5% CO2条件下培养,每日连续观察;
3)D3吸出100uL培养上清,加入100uL新培养基,同时加入(处理抗体或药物)使至终浓度100nM(如果D3已出现显著差别,则记录大视野明场形态,终止实验);
4)观察至实验组间差异显著,拍照记录大视野细胞明场形态;
5)细胞上清保存用于后续检测
4. 腹膜癌类器官与TIL细胞共培养
TIL细胞可被腹膜癌类器官激活,并对类器官具有杀伤作用。14h后,类器官的荧光信号明显下调。
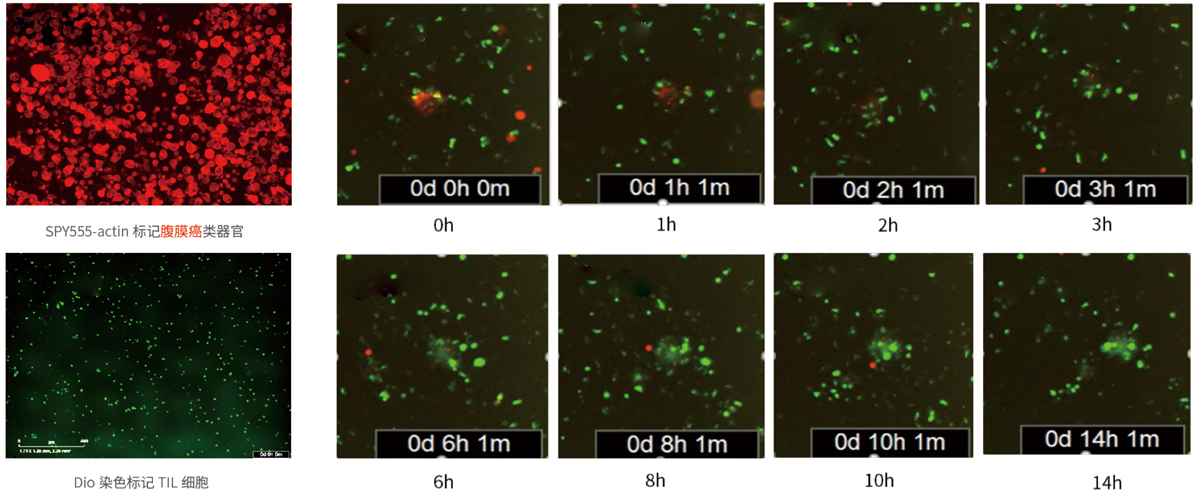
TIL细胞(绿色)杀伤腹膜癌类器官(红)
5. 乳腺癌类器官与TIL细胞共培养
Caspase-3/7(绿色)标记乳腺癌类器官,共培养4h后凋亡细胞显著增多。

成像分析用于测定共培养物中类器官凋亡情况
3. 胃癌类器官与NK细胞共培养
NK细胞(红色,细胞膜,DIL)可被胃癌腹水来源的类器官(蓝色,细胞核,Hoechst 33342)激活,并对类器官具有杀伤作用。12h后,NK细胞的荧光信号显著上调,24h后类器官的荧光信号明显下调。
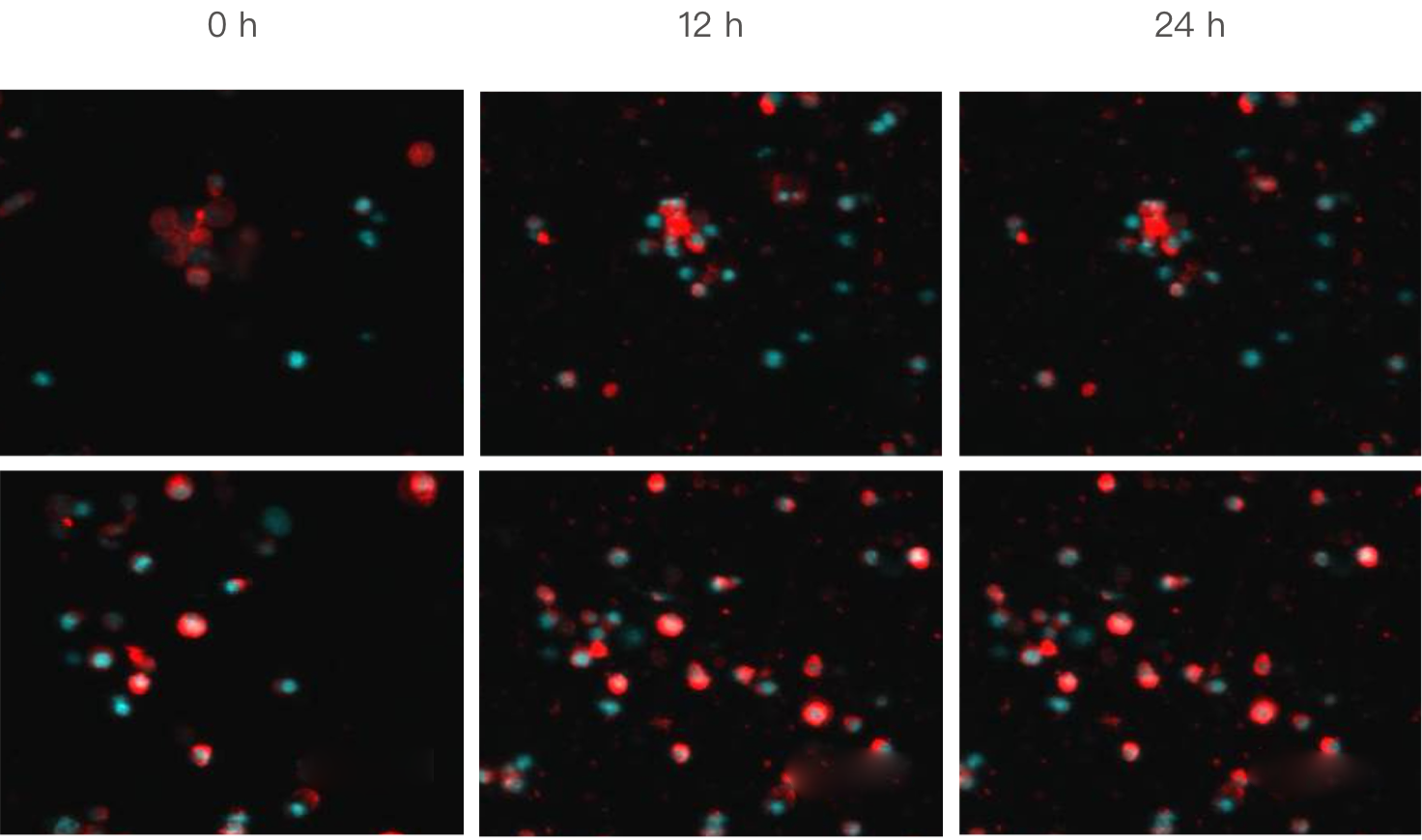
NK细胞(红)杀伤胃癌类器官(蓝)
