
时间:2026-01-13浏览次数:283
膀胱癌类器官是从膀胱癌患者的肿瘤组织中提取细胞,在体外培养形成的三维结构,能够模拟原发肿瘤的基因突变和表达特征。这些类器官可用于药物筛选和疾病建模,是研究膀胱癌的重要工具。
一、 传代膀胱肿瘤类器官
注意:建议当膀胱肿瘤类器官的直径达到 100-150 μm 时通过。
1. 将 500 μL 胶原酶/分散酶添加到含有肿瘤类器官的 24 孔板中的类器官培养基中。上下移液管基底膜基质和培养基。在 37 °C 下孵育 20 分钟,然后将细胞收获到 15 mL 试管中><。 注意:在显微镜下检查从基底膜基质中分离的类器官。如果类器官未从基底膜基质上分离,则增加孵育时间或移液更多次。
2. 加入 5 mL 预热的 DMEM,在 4 °C 下以 400 x g 离心管 3 分钟,然后吸出上清液。
3. 使用 1 mL 预热的 0.25% 胰蛋白酶-EDTA 和 10 μM Y-27632 重悬沉淀。在 37 °C 水浴中孵育 5 分钟。用力上下移液细胞,并使用 5 mL 含 10% FBS 的 DMEM 中和胰蛋白酶。
4. 将试管在 4 °C 下以 400 x g 离心 3 分钟并吸出上清液。
5. 使用 1 mL 预热的类器官培养基重悬沉淀,并计数单个肿瘤细胞的数量。
二、. 膀胱类器官的原位移植(图 1A)
1、准备用于原位移植的膀胱肿瘤类器官
1. 移植前,如上所述,将膀胱肿瘤类器官培养 5-7 天。
2. 将 500 μL 胶原酶/分散酶添加到含有肿瘤类器官的 24 孔板中的类器官培养基中。在基底膜基质和培养基上上下移液。在 37 °C 下孵育 20 分钟,并将细胞收集到 15 mL 试管中。
3. 加入 5 mL 预热的 DMEM,在 4 °C 下以 400 x g 离心管 3 分钟,然后吸出上清液。
4. 用 1 mL DMEM 重悬沉淀,并将溶液转移到 90 mm 培养皿中。
5. 在显微镜下,使用 P10 微量移液器拾取 100-100 个肿瘤类器官200,并将它们收集到冰上的微管中。
6. 将试管在 4 °C 下以 400 x g 离心 3 分钟,然后小心弃去上清液。
7. 将细胞沉淀保持在冰上,直到小鼠准备好进行手术。
2、粘膜下膀胱壁移植
1. 在实验前至少 1 周准备一只 8 至 10 周龄的雄性裸鼠 (CAnN.Cg-Foxn1nu/Crl),以使其适应新环境。手术前 24 小时皮下注射恩诺沙星 (5 mg/kg)。
2. 用肥皂和水清洁工作台表面。在外科手术前对手术器械进行高压灭菌,并使用无菌器械进行手术。
3. 将 29 G 胰岛素注射器、移液器吸头和基底膜基质放在冰上。麻醉前皮下注射酮洛芬 (5 mg/kg)。
4. 在诱导室中用 4% 异氟醚麻醉小鼠。一旦达到全身麻醉,将小鼠置于仰卧位,并通过面罩吸入 2% 汽化异氟醚来维持麻醉。
注意:如果麻醉时间超过 30 分钟,请使用棉签将眼药膏涂抹在双眼上,以避免角膜干燥。
5. 用无菌纱布涂抹聚维酮碘,并用 70% 乙醇擦拭。每次用新纱布或棉签重复 3 次。
6. 使用一次性无菌手术单覆盖肛门和手术区域。
7. 使用解剖显微镜进行放大,用无菌手术剪刀在下中线腹部的皮肤和肌肉壁上做一个小的横向切口(小于 1.5 厘米)。从腹腔露出膀胱,并用浸有盐水的棉签支撑它。注意:如果膀胱充满尿液,轻轻按压膀胱以略微减压。
8. 类器官沉淀重悬于 80 μL 含有 50% 高浓度基底膜基质的类器官培养基中(表 1 和材料表)。
9. 解剖显微镜下使用 29 G 胰岛素注射器将类器官悬浮液注射到膀胱圆顶的前部。
10. 用抗菌可吸收缝合线闭合腹壁内层,然后用 4-0 尼龙缝合线闭合外层。用聚维酮碘和 70% 乙醇对手术部位进行消毒。
11. 让鼠标在红外线照射器下恢复 10-15 分钟。监测鼠标,直到它恢复意识和运动能力。
12. 手术后 1 天,检查小鼠的一般状况和吻合口瘘。术后每天一次服用酮洛芬 (5 mg/kg),持续 3 天,术后每天一次治疗恩诺沙星 (5 mg/kg),持续 10 天。
13. 当切口部位愈合时(手术后 10-14 天),取下缝合线。在肿瘤类器官注射后 2-3 周内监测小鼠膀胱肿瘤的生长。
14. 如果观察到膀胱肿瘤生长,则使用二氧化碳吸入对小鼠实施安乐死,并收获整个膀胱肿瘤。使用冷 DPBS 清洗(图 1B)。
15. 为了分析膀胱肿瘤组织学,使用苏木精和伊红 (H&E) 染色对组织的石蜡包埋切片进行染色(图 1B)。
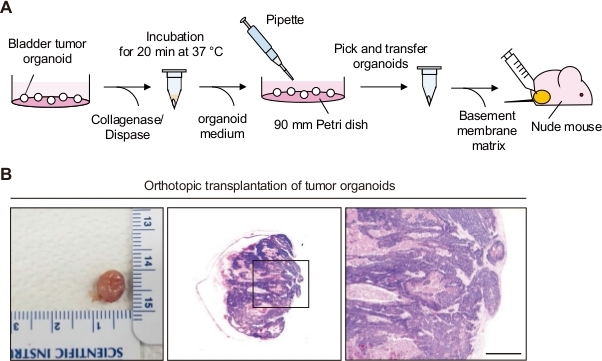
图 1:膀胱肿瘤类器官的原位移植。(A) 膀胱肿瘤类器官原位移植到裸鼠的示意图。(B) 膀胱肿瘤类器官原位移植小鼠的膀胱和 H&E 染色切片的代表性图像。中间面板中框区的放大视图显示在左侧面板中。比例尺 = 500 μm。
