国自然热点 “免疫调控” 研究之真菌菌群驱动胰腺癌分泌IL-33并促进2型免疫
时间:2023-04-24 阅读:2001真菌菌群驱动胰腺癌分泌IL-33并促进2型免疫
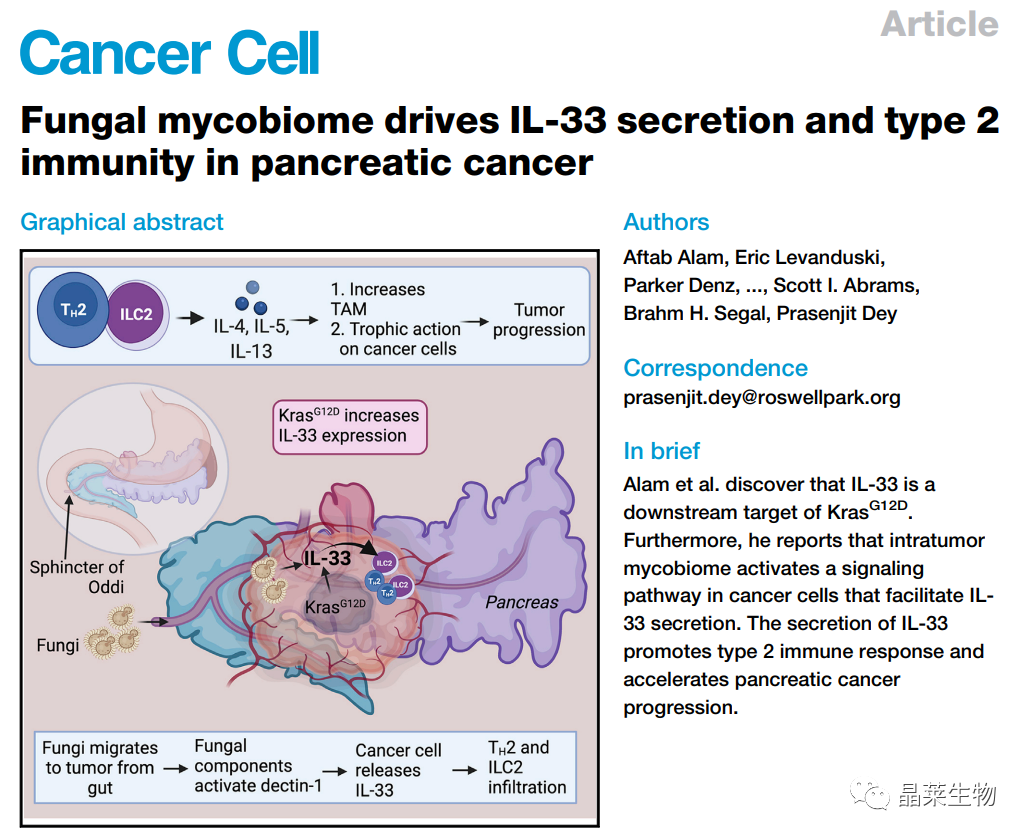
研究背景
1、人体微生物群如细菌、古细菌、真菌、原生生物、蠕虫和病毒等,在人体内建立了共生关系。不仅在发展免疫系统和维持细胞免疫稳态方面发挥着至关重要的作用,而且在癌症等疾病的进展中也起着至关重要的作用。
2、胰腺癌是消化道常见恶性肿瘤之一,素有“癌症之王”的称号,具有独特的肿瘤免疫特征,存在大量免疫抑制细胞,如肿瘤相关巨噬细胞、调节性T(Treg)细胞、CD4+ 2型辅助T(Th2)细胞和骨髓来源的抑制细胞,共同抑制效应T细胞,导致了肿瘤免疫逃逸和癌症的快速发展。
3、研究发现,Th2细胞在肿瘤发生的早期阶段渗入胰腺并分泌II型细胞因子(如IL-4和IL-13),并促进胰腺癌发展。
研究目的
探究Th2细胞是如何在肿瘤微环境(TME)中被募集并促进癌症发展的机制,为癌症治疗提供新的思路
研究思路
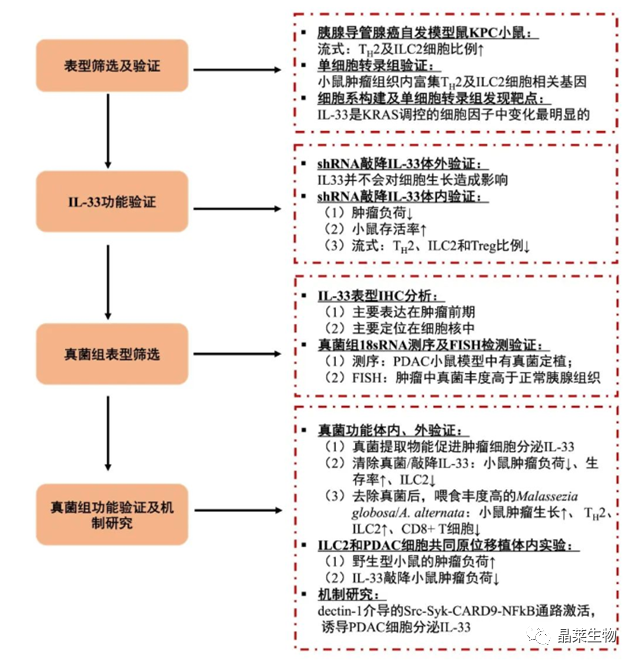
研究内容及分析
1. 胰腺癌肿瘤微环境中II型免疫细胞浸润显著增多
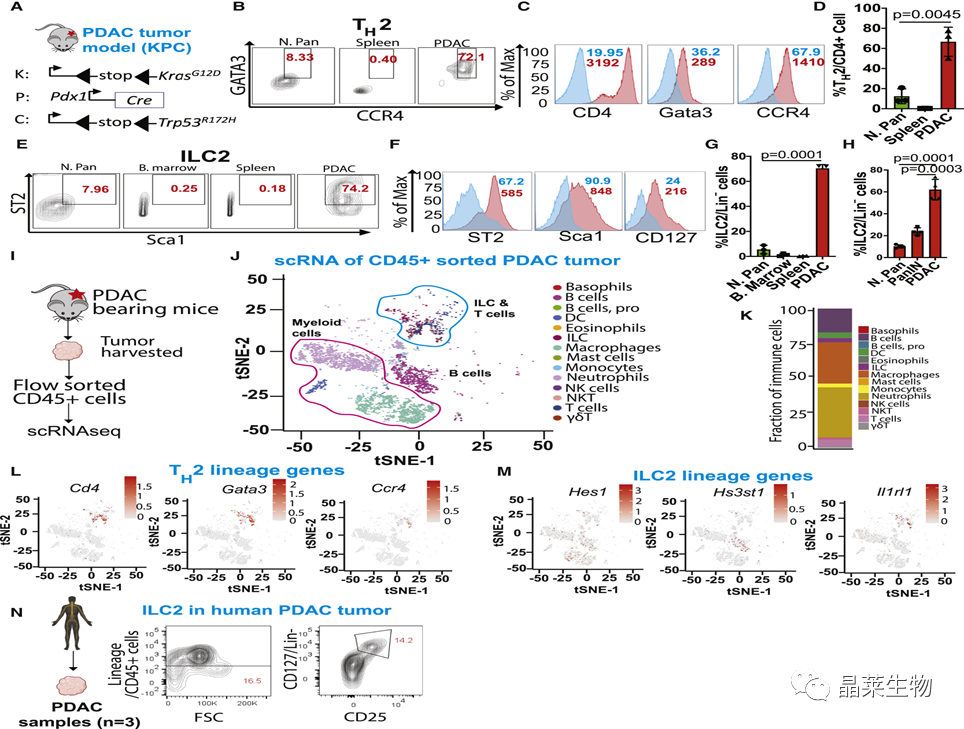
这些Th2细胞和ILC2细胞是哪里来的?
2. KrasG12D-MEK信号能引起PDAC细胞IL-33表达
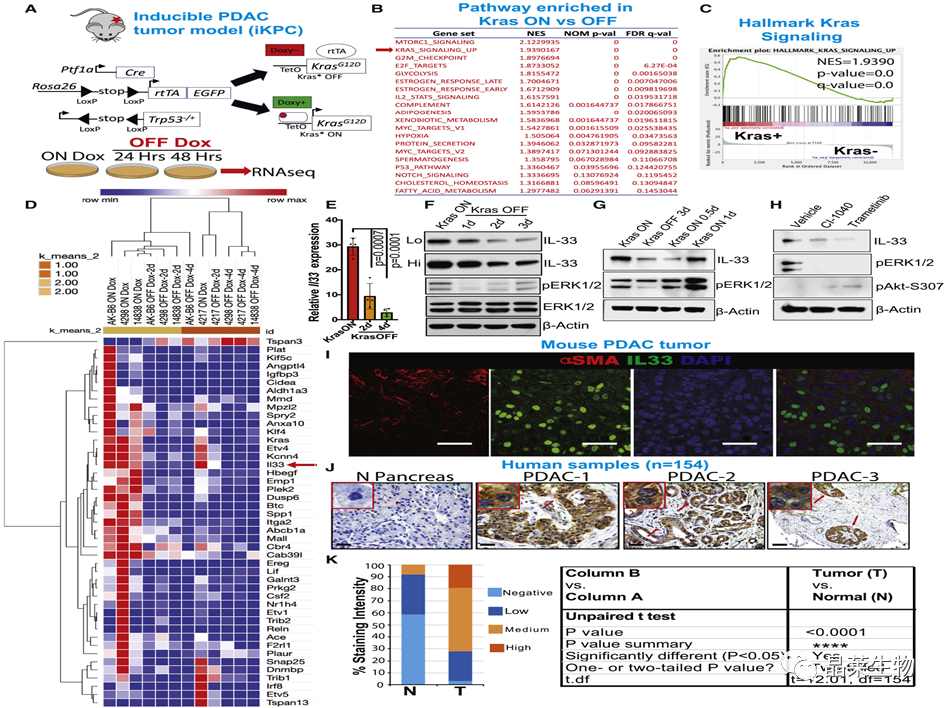
(A) 多西环素 (Dox) 诱导的转基因小鼠模型。
(B)比较Kras ON和Kras OFF的RNA-seq数据集的基因集富集分析富集的途径。
(C)RNA-seq数据集的GSEA分析显示比较Kras ON和Kras OFF的标志性Kras信号富集。
(D)在比较四个小鼠细胞系中的Kras ON,OFF-2天和OFF-4天时富集在Kras信号通路中的基因的热图。
(E)Il33在Kras ON,OFF-2天和OFF-4天(n = 3)中表达的qRT-PCR分析。
(F) IL-33的蛋白质印迹分析。
(G)小鼠细胞系中Kras ON,OFF和re-ON中IL-33和pERK1 / 2的蛋白质印迹分析。
(H) 在小鼠细胞系中用 MEK 抑制剂(CI-1040 和曲美替尼)处理后对 IL-33、pERK1/2 (P-p42/44) 和 pAkt-S307 进行蛋白质印迹分析。
(I)小鼠PDAC肿瘤中IL-33和α-平滑肌肌动蛋白(α-SMA)染色的代表性共聚焦图像。
(J)人PDAC肿瘤中IL-33的代表性免疫组织化学(IHC)图像。
(K)人PDAC TMA的IL-33染色的统计分析。
3. 肿瘤细胞来源的IL-33能够募集和激活2型免疫细胞进入PDAC肿瘤微环境
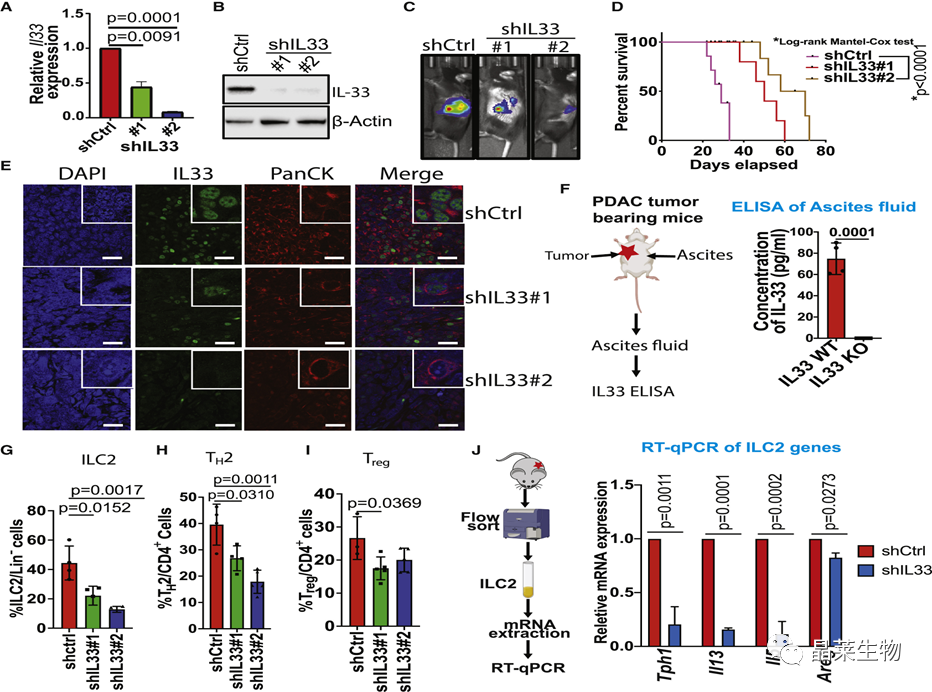
A)通过qRT-PCR在非靶标(shCtrl)与shIL33(#1和#2)稳定鼠细胞系(n = 3)中相对于β-肌动蛋白确定Il33基因表达。
(B)蛋白质印迹分析显示shIL33(#1和#2)鼠细胞系中Il33的稳定敲低。
(C)具有代表性的生物发光图像显示原位移植的PDAC肿瘤。
(D)用shCtrl和shIL33(#1和#2)稳定的PDAC同基因小鼠细胞系(n = 10)原位移植小鼠的Kaplan-Meier存活曲线。
(E)代表性共聚焦图像显示原位移植shCtrl和shIL33 PDAC肿瘤中IL-33(绿色)的癌细胞特异性核表达。
(F)显示原位移植shCtrl和shIL33 PDAC荷瘤小鼠第25-28天腹水积聚的示意图(左)。
(G)原位移植shCtrl和shIL33 PDAC肿瘤中ILC2相对于总林的频率−细胞。
(h) T 的频率H2在原位移植的shCtrl和shIL33 PDAC肿瘤中相对于总CD4细胞。
(一)T的频率注册在原位移植的shCtrl和shIL33 PDAC肿瘤中相对于总CD4细胞。
(J)显示来自原位移植shCtrl和shIL33 PDAC肿瘤的ILC2细胞的流动分选示意图(左)。对ILC2谱系特征基因Tph1,Il13,Il5和Aleg(右)进行了qRT-PCR分析。
IL-33是为何被释放到肿瘤微环境?
4. 瘤内真菌促进PDAC细胞分泌IL-33
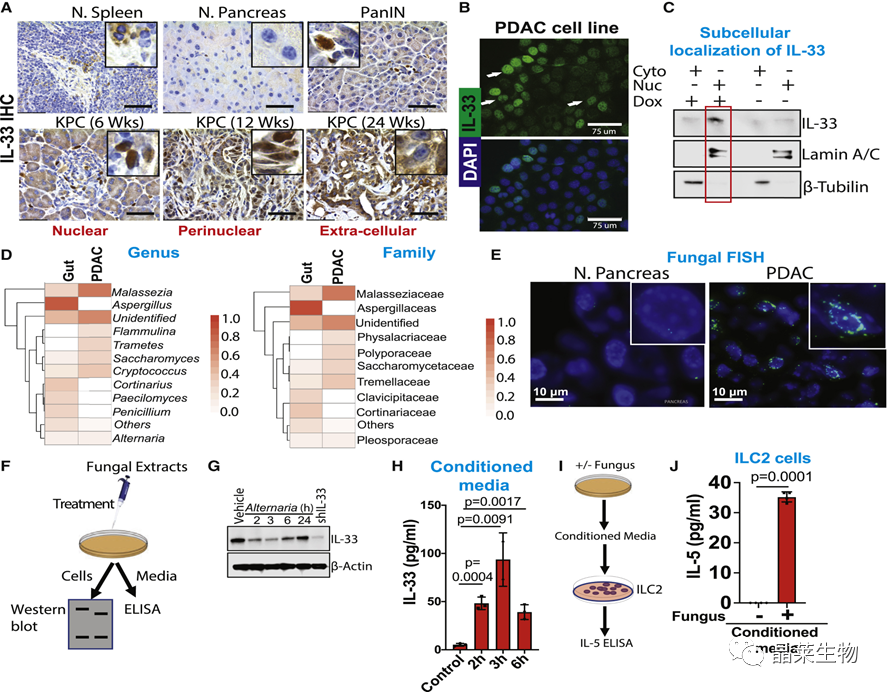
(A)6周龄、12周龄和24周龄小鼠脾脏、正常胰腺、PanIN(KC小鼠)和PDAC(KPC小鼠)中IL-33的代表性IHC图像。
(B)荧光图像显示PDAC细胞系中IL-33(绿色)的核表达。
(C)Dox诱导的小鼠PDAC细胞系的亚细胞分级分离,显示IL-33在细胞质和细胞核中的表达。
(D)通过18S内部转录空间(ITS)测序分析PDAC荷瘤小鼠的肠道和胰腺内真菌组。
(E)荧光原位杂交(FISH)显示正常胰腺中的真菌种群与PDAC。
(F)示意图显示了真菌提取物处理的策略,然后进行生化测定,以确定链格孢处理后细胞和条件培养基中的IL-33表达。
(G)用载体和真菌提取物(A. alternata)处理的PDAC细胞系中IL-33的不同时间点和shIL33 PDAC细胞系中的IL-33的蛋白质印迹分析。
(H) IL-33 在条件培养基中使用 ELISA 在用互生曲霉提取物处理的 PDAC 细胞系中测量不同时间点。
(I) 示意图显示了用早期用真菌提取物处理的 PDAC 细胞条件培养基培养的流动分选 ILC2 细胞中 IL-5 的定量策略。
(J) 使用由 ILC2 产生的 ELISA 测量,在用真菌提取物处理的癌细胞条件培养基处理时。
5. 瘤内真菌加速PDAC肿瘤生长
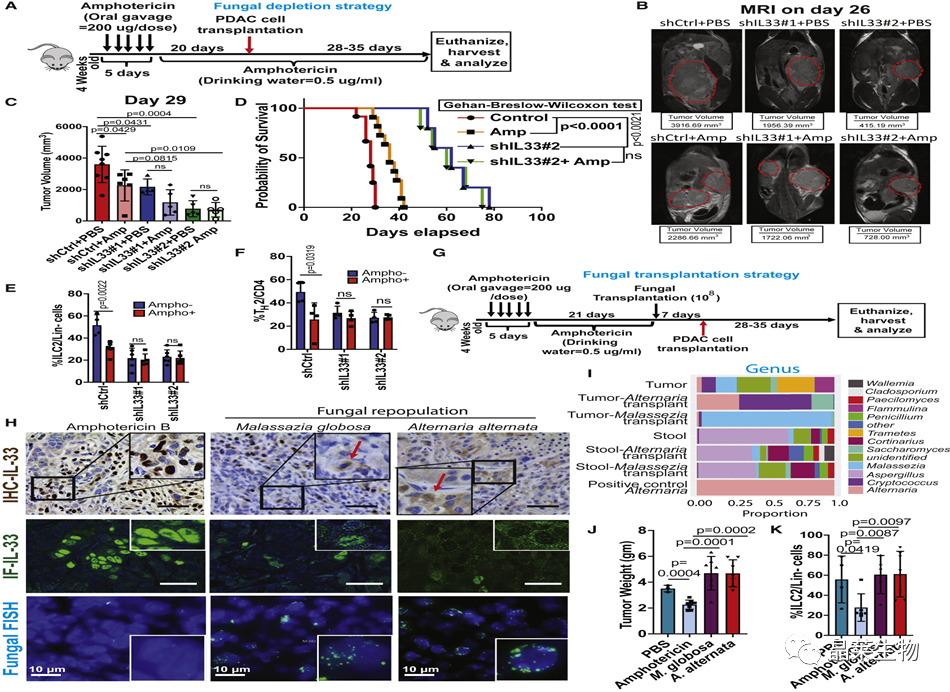
(A)显示使用两性霉素B(200μg/剂量)进行PDAC细胞原位移植和肿瘤进展研究的真菌去除策略的示意图。
(B)第26天具有代表性的MRI图像及其相对体积(n = 5),显示原位移植的shCtrl和shIL33 PDAC肿瘤,有或没有两性霉素B治疗。
(C)条形图显示原位移植shCtrl和shIL33 PDAC肿瘤(n = 14)和shIL33(#1 [n = 9]和#2 [n = 10])的肿瘤体积,有或没有两性霉素B治疗。
(D)用shCtrl和shIL33 PDAC肿瘤原位移植的小鼠的Kaplan-Meier存活曲线,有或没有两性霉素B治疗(n = 10)。使用Gehan-Breslow Wilcoxon检验进行统计分析。
(E)原位移植shCtrl和shIL33 PDAC肿瘤中ILC2的频率,有或没有两性霉素B治疗相对于总林−细胞。
(F) 频率H原位移植 shCtrl 和 shIL33 PDAC 肿瘤中的 2 个细胞,有或没有两性霉素 B 治疗相对于总 CD4 细胞。
(G)显示真菌移植策略的示意图,然后是PDAC细胞的原位移植和肿瘤进展研究。
(H)PDAC肿瘤的代表性IHC(顶部)和免疫荧光(中)图像显示通过口服强饲法(n = 10)在对照和真菌移植小鼠中表达IL-33。
(I)18S rRNA序列显示通过口服强饲法移植的A. alternata和Malassezia globosa移植小鼠的PDAC肿瘤中的真菌种类。
(J)显示对照,两性霉素B和真菌移植小鼠的PDAC肿瘤的湿重的条形图(n = 10)。
(K) ILC2/总林的频率−对照,两性霉素B和真菌移植小鼠的PDAC肿瘤中的细胞。
6. IL-33介导的ILC2激活是肿瘤进展的必要条件
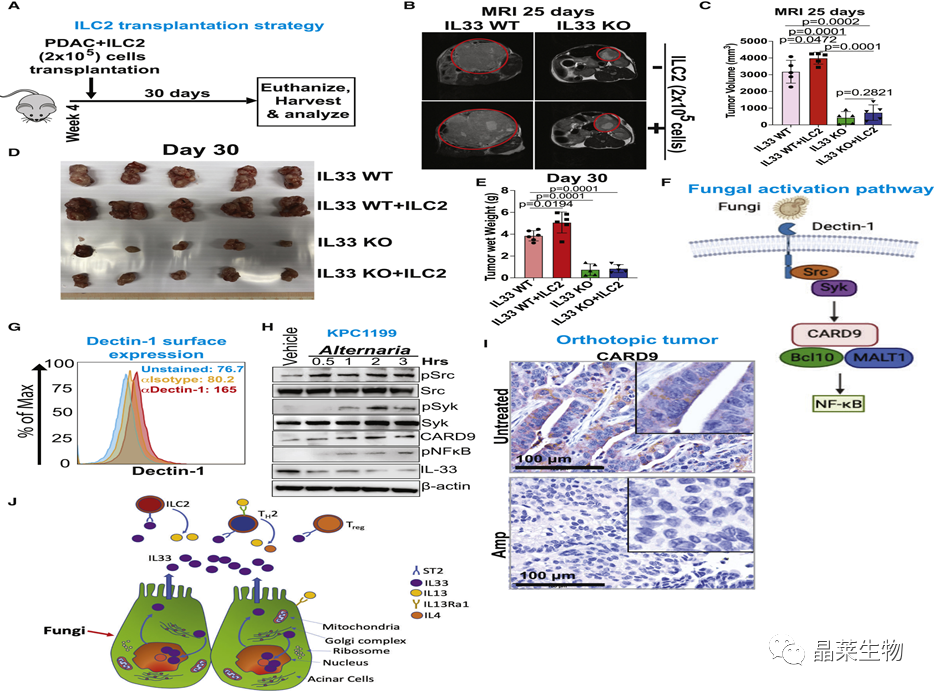
A)PDAC和ILC2细胞原位共移植策略示意图。
(B)代表性MRI扫描显示CRISPR / Cas9敲除肿瘤(IL-33 WT与IL-33 KO)的轴向图像,有或没有ILC2共同移植。
(C)显示通过MRI图像分析计算的肿瘤体积的条形图(n = 5-7)。
(D)图片显示IL-33 WT中带有或不具有ILC2的PDAC大肿瘤与IL-33 KO小鼠(n = 5)。
(E)条形图显示IL-33 WT小鼠中PDAC肿瘤湿重与IL-33 KO小鼠(n = 5-7)。
(F)显示真菌激活途径的示意图,其中dectin-1受体连接真菌成分并诱导Src-Syk-CARD9信号级联反应。
(G)直方图显示PDAC细胞系上dectin-1表达,通过流式细胞术分析(n = 3)。
(H)蛋白质印迹显示用交替曲霉处理后pSrc,Src,pSyk,Syk,CARD9,p-NFκB和IL-33的表达。β-肌动蛋白被用作加载对照。
(I)代表性的IHC图像显示CARD9在有或没有抗真菌治疗的原位移植肿瘤中的表达。比例尺,100 μm。
(J)工作模型显示真菌介导的PDAC肿瘤分泌IL-33,吸引2型免疫细胞(ILC2,TH2 和 T注册),从而促进肿瘤进展。
文献结论
肿瘤内真菌可刺激PDAC细胞分泌IL-33,从而促进II型免疫应答和肿瘤进展。
文献总结
创新点:
1.发现了肿瘤内真菌可引起肿瘤细胞分泌IL-33,并募集Th2细胞和ILC2细胞,进而促进肿瘤进展。
2.扩展了人们对驱动PDAC肿瘤进展机制的认识,并提出靶向肿瘤内真菌组驱动IL-33分泌的治疗途径,为胰腺癌的临床治疗提供了新的思路。
延伸:
1.真菌之外,生物化学因素,例如活性氧(ROS)和氧化应激也能促进IL-33的细胞外分泌。上述这些因子可能作为IL-33分泌的刺激物和增强剂与真菌群落协同作用。
2.除了肿瘤内的真菌微生物组,细菌微生物组的作用也不能被排除
3.IL-33和ILC2可能在不同癌症类型、早晚期发挥不同的作用。
4.临床患者是否存在同样的真菌组表型?对患者抗真菌治疗是否能够提高其预后?
文献使用的实验技术

关注公众号,了解更多!














