
时间:2026-02-08浏览次数:107
代谢功能障碍相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis,MASH,原称为NASH)是一种与代谢紊乱相关的肝脏疾病。其特征是肝脏中脂肪的异常积累,伴随着炎症和肝细胞损伤,这种炎症和损伤可能导致肝纤维化、肝硬化、肝衰竭甚至死亡。
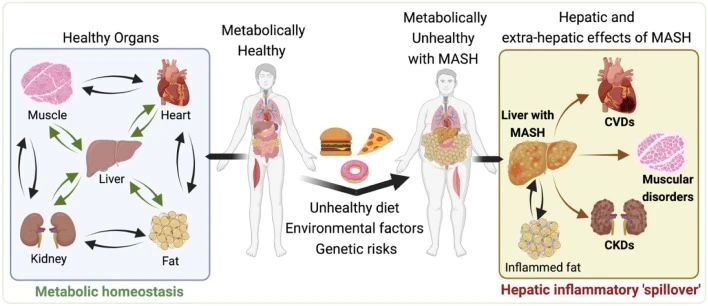
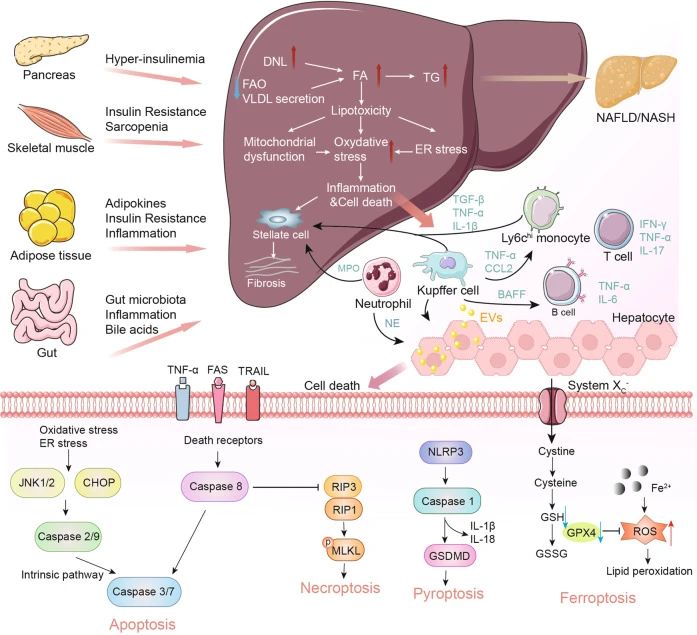
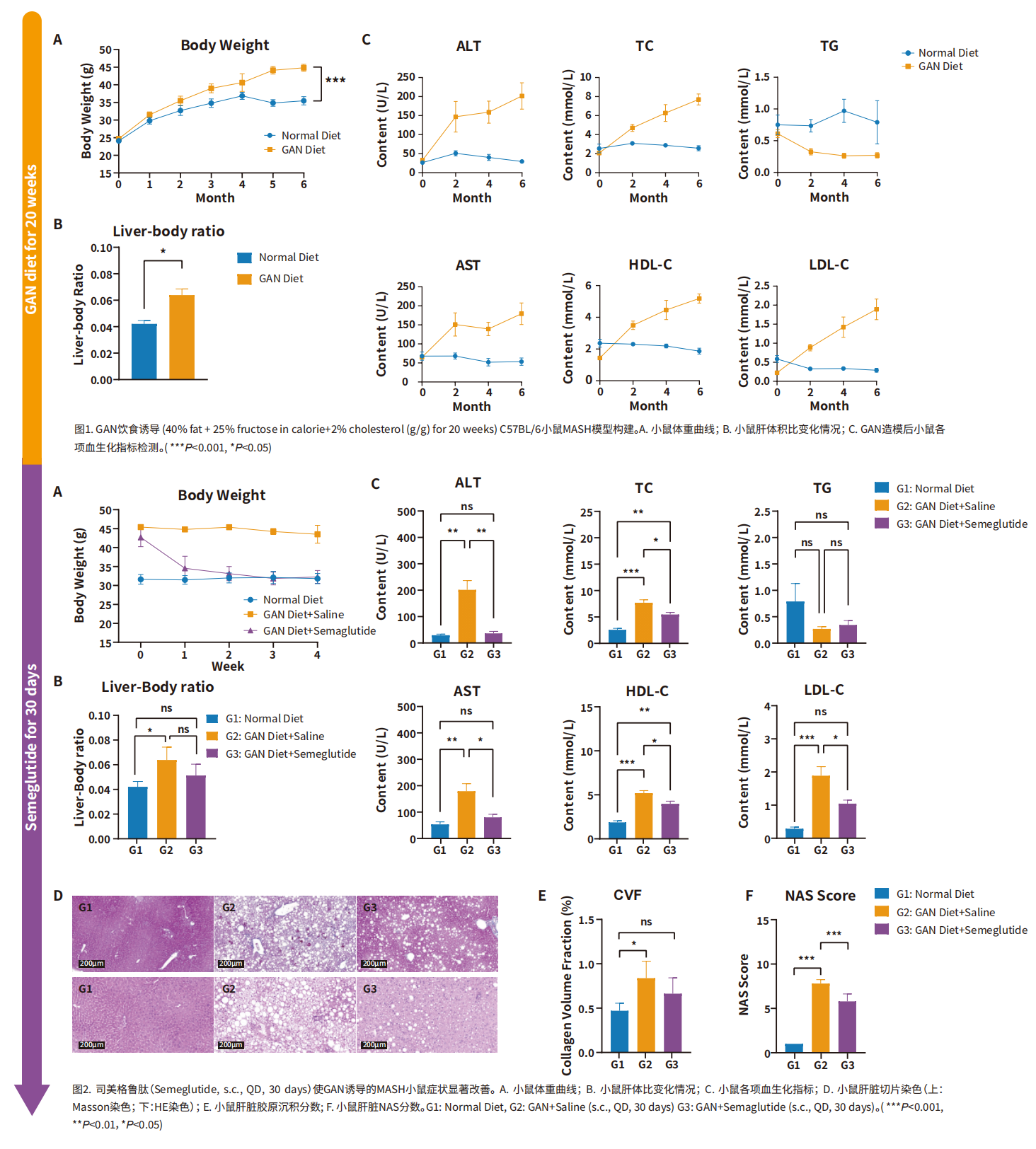
一、MASH引起的肝脏疾病进展 1、脂肪肝的形成: MASH的最初阶段通常是脂肪肝。虽然脂肪肝本身可能不会引起严重的肝损伤,但它为更严重的肝病提供了基础。 2、炎症和肝细胞损伤: 随着疾病的发展,脂肪肝可能进展为肝炎。这一阶段的特点是肝脏中发生炎症和肝细胞损伤,同时可能伴随着肝功能轻微下降。炎症和损伤是由肝脏中积累的脂肪导致的,这种状况如果不加以控制,可能会导致更严重的肝病。 3、纤维化与肝硬化: 持续的炎症和损伤会导致肝脏产生过多的瘢痕组织,这一过程被称为纤维化。肝纤维化这是一种肝功能严重受损的状态,会显著增加肝衰竭和肝癌的风险。 4、肝癌风险的增加: 在MASH发展的晚期阶段,持续的肝损伤和纤维化导致其发展为肝癌的风险显著增加,需要尽早发现和治疗。 二、MASH的主要病理特征 糖尿病、肥胖和高脂血症是促使MASH发生发展的重要因素。研究表明,MASH发病机制较为复杂,胰岛素抵抗、氧化应激、炎症反应和脂质代谢异常等多个环节均与之相关[6]。 1、脂质过度积累: 当出现胰岛素抵抗时,脂肪组织中脂肪分解的过度激活会增加循环中游离脂肪酸(FFAs)的水平,最终促进脂肪在肝脏中沉积,导致脂肪肝。此外,摄入过量碳水化合物或部分由胰岛素抵抗条件下肝脏脂肪生成的转录调控紊乱会促进肝脏中的脂肪的新生合成,其中固醇调节元件结合蛋白1c(SREBP1c)和碳水化合物调节元件结合蛋白(ChREBP)是催化脂肪生成的两个重要转录因子,是影响脂肪变性发展为MASH的关键因素。过量的胆固醇会明显加剧细胞毒性以及肝细胞、免疫细胞和造血干细胞的促炎和促组织坏死作用。 2、免疫细胞浸润: 脂质的过度积累会破坏肝细胞的正常功能,引发内质网(ER)应激、线粒体功能障碍和活性氧(ROS)的产生。这些事件激活了关键的信号通路,包括c-Jun N端激酶(JNK)通路和NF-κB通路,从而诱发炎症和细胞凋亡,成为MASH发展的主要驱动因素。 3、造血干细胞活化: 若不加以防治,MASLD可发展为不可逆的肝纤维化,甚至肝癌。在造血干细胞诱导的纤维化发展过程中,多种生长因子发挥着关键作用,例如TGF-β、血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)等。此外,免疫细胞介导的肝细胞杀伤也是导致肝纤维化的原因之一,因此抑制特定趋化因子和NF-κB可减轻肝纤维化的进展。 小鼠模型在MASH(代谢功能障碍相关脂肪性肝炎)研究中扮演着至关重要的角色。通过小鼠模型,研究人员可以观察和分析MASH的病理生理过程,包括脂肪在肝脏中的积累、炎症反应、纤维化进程以及与代谢紊乱的相互作用,这对于疾病进展研究和治疗干预有重要意义。 1、GAN饮食诱导的MASH模型: GAN(Gubra-Amylin NASH)饮食是一种经过改良、无反式脂肪的高脂高胆固醇高果糖饲料,其诱导的MASH动物模型更好地模拟了人类疾病的发生,在生理、代谢和组织病理学方面有良好的转化性。 2、HFD+CCl4诱导的MASH模型: HFD+CCL4模型的构建由两部分组成:首先是高脂饮食(High-Fat Diet,HFD)单独诱导肝脂肪变性以及炎症反应,然后在HFD的基础上用CCL4诱导肝纤维化。 3、MCD饮食诱导的MASH模型: 甲硫氨酸和胆碱缺乏饮食(Methionine‒Choline-Deficient Diet,MCD)含有21%脂肪,63%蔗糖为主的碳水化合物,缺乏胆碱和甲硫氨酸,该饮食方案可通过引起肝脏脂类的输出障碍从而驱动肝损伤。MCD模型在较短的时间内即可表现出MASH和肝纤维化。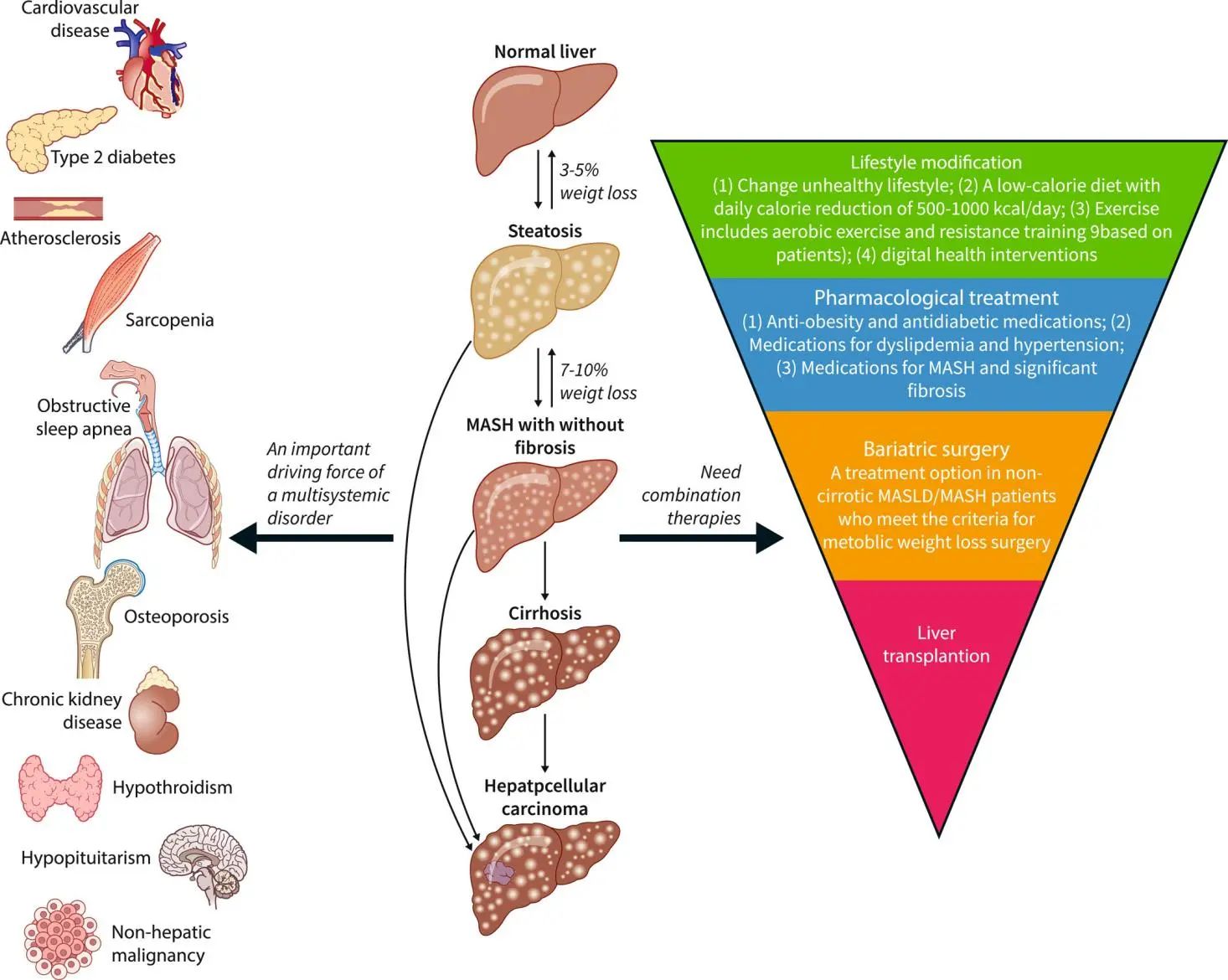
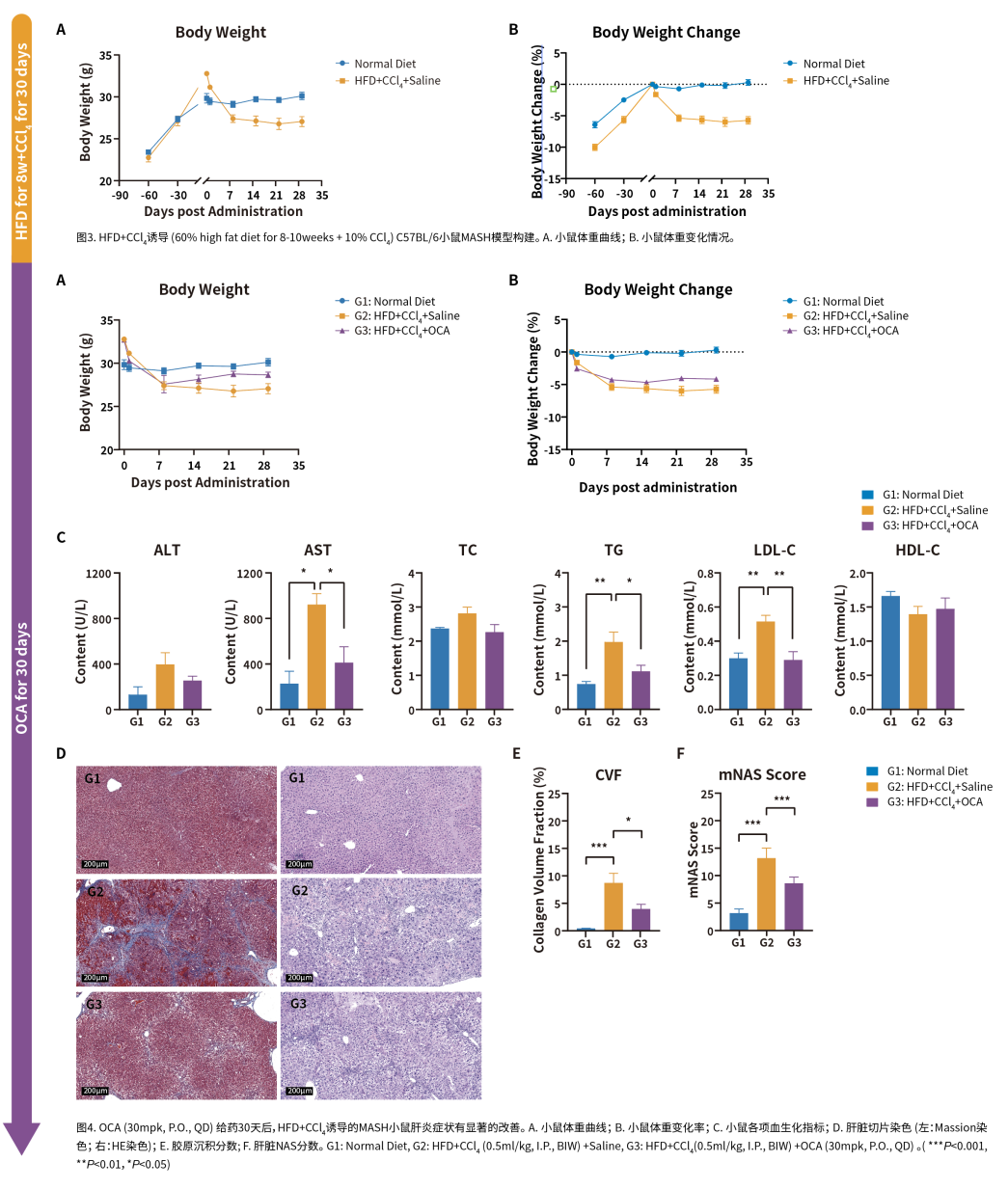
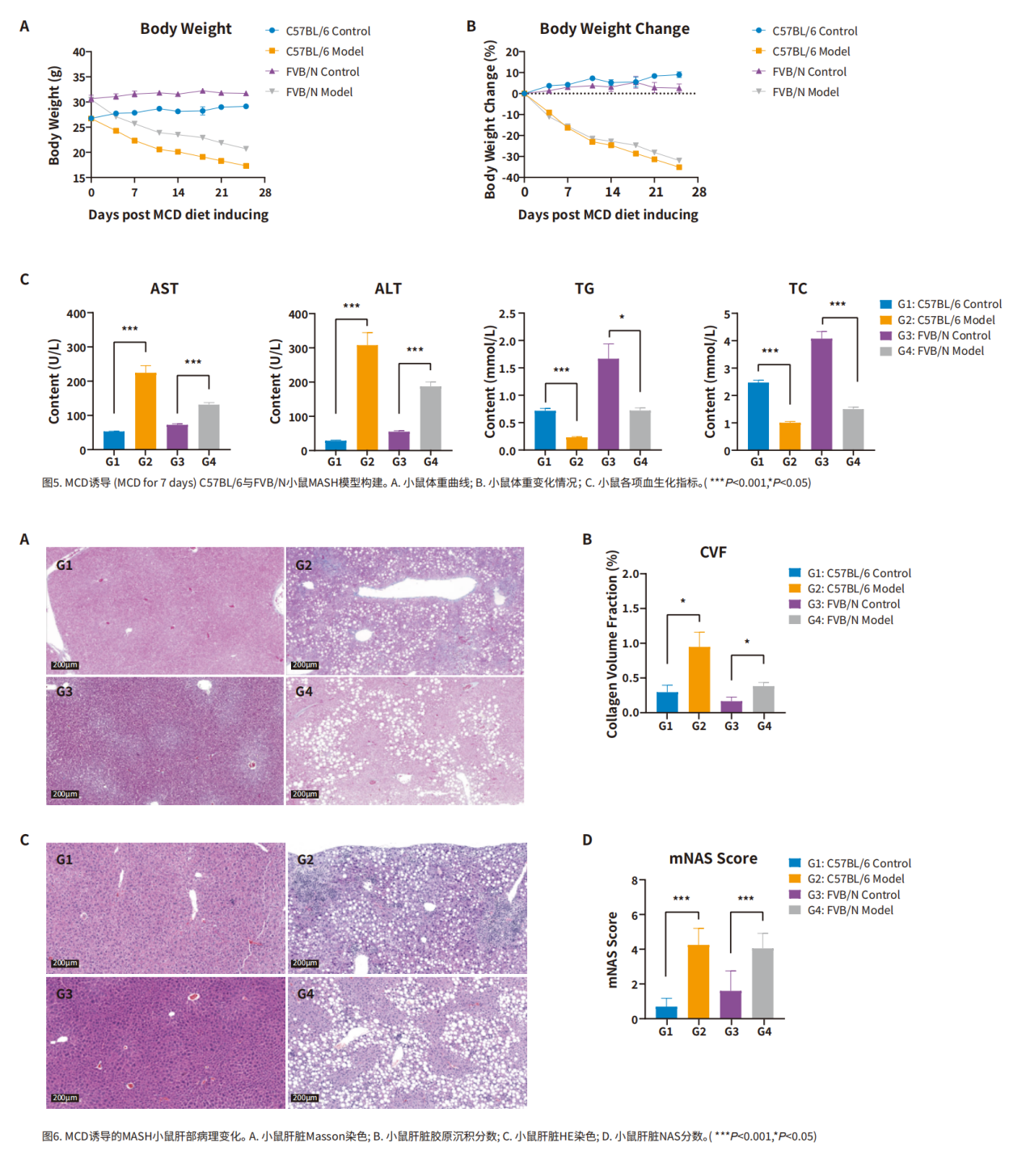
下一篇:药物胃肠道毒性评价
