
时间:2026-02-06浏览次数:109
由干细胞来源的心肌细胞和支持细胞组成的人类心脏类器官能重现心脏组织结构、收缩功能和电生理学的关键特征,所以成为预测药物化合物心脏毒性的重要替代方法。
阿霉素诱导的心脏毒性已在心脏类器官中被验证。暴露于阿霉素会降低类器官存活率,升高乳酸脱氢酶(LDH)和脑钠肽(BNP)水平,并诱导细胞凋亡、纤维化及线粒体功能障碍。
(DOI:10.1016/j.cbi.2023.110777)
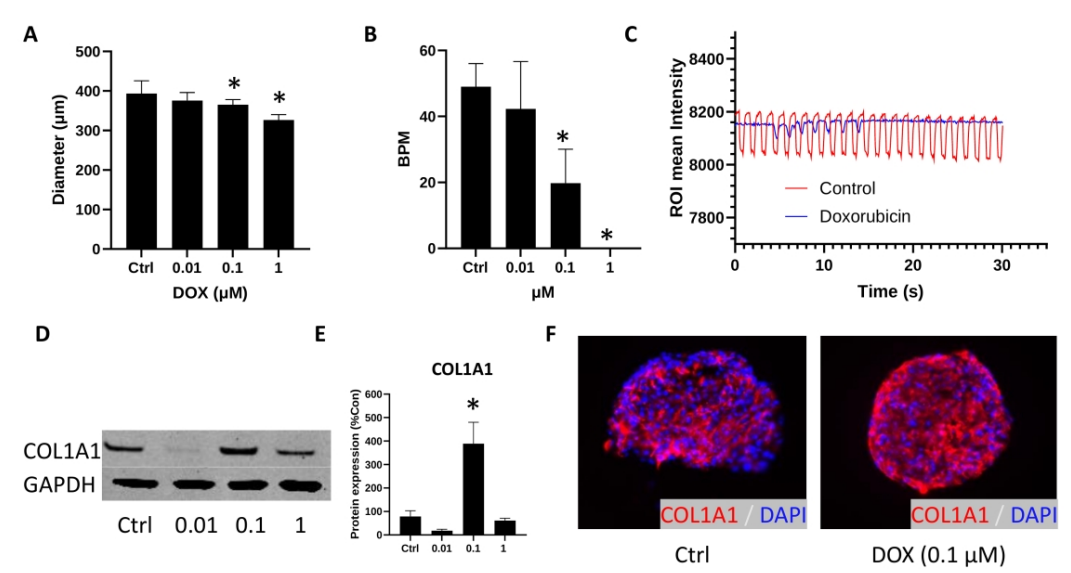
在无细胞外基质(ECM)类器官模型中,阿霉素处理会导致类器官萎缩、节律性受损、胶原沉积、成纤维细胞活化以及内皮-间质转化的早期迹象。
(DOI:10.1093/toxsci/kfaf115)
在模拟缺血后组织的心肌梗死类器官模型中,阿霉素加剧了缺氧敏感性损伤,破坏了协调收缩所需的钙循环,并促进梗死核心区纤维化的出现。
(doi: 10.1038/s41551-020-0539-4)
心脏类器官平台也被用于筛选一系列临床相关药物。一项评估FDA召回化合物(阿司咪唑、西沙必利、米贝拉地尔、培高利特、特罗地林、罗非昔布、伐地昔布、溴芬酸、替尼酸和曲格列酮)的研究表明,类器官比二维单层细胞更有效地检测剂量依赖性ATP耗竭和搏动紊乱。
(doi: 10.1088/1758-5090/ab6d36.)
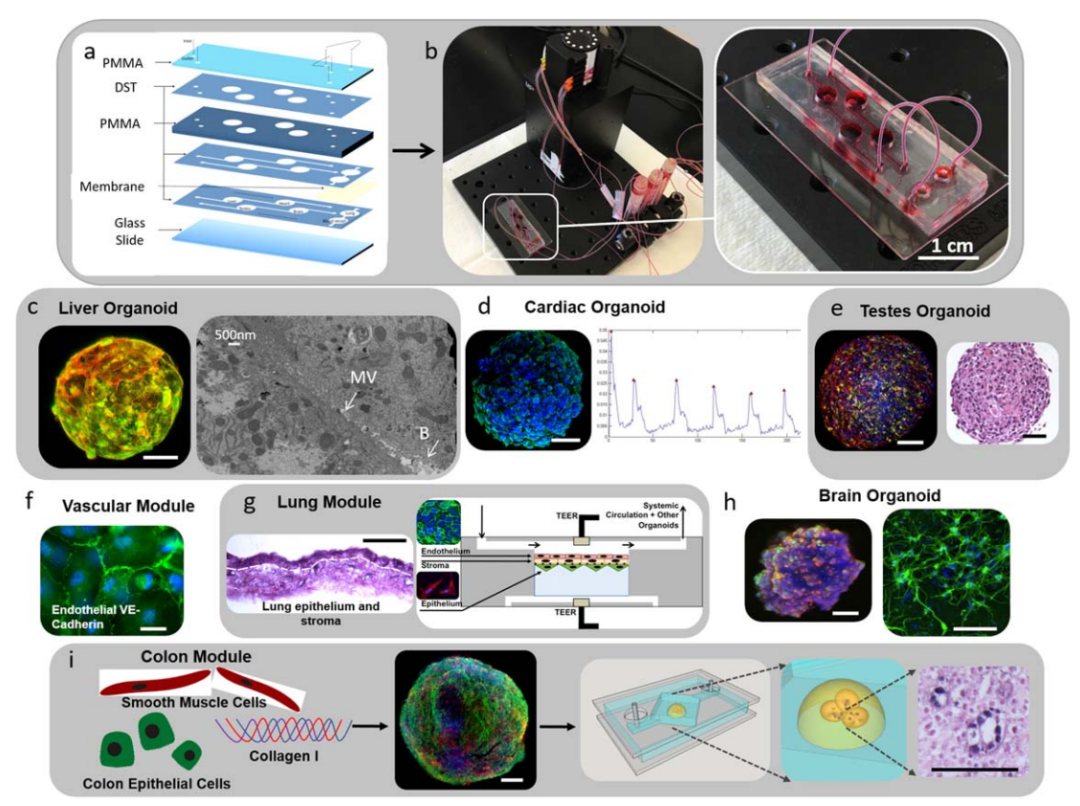
其他高通量筛选(HTS)研究还发现,靶向GSK3、 TGFβ 和甲羟戊酸途径的促增殖化合物虽能刺激心肌细胞增殖,但会同时导致心肌细胞收缩时间延长或收缩力减弱。这表明尽管这些化合物仍存在功能性副作用。
(doi: 10.1016/j.stem.2019.03.009.)
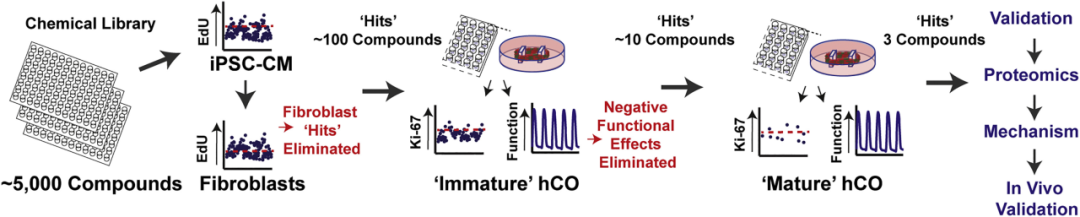
空间有序排列的心脏类器官也被用于模拟发育毒性。沙利度胺暴露会减少心脏组织形成并损害功能,其中较大型类器官表现出更稳定的搏动特征,而较小型类器官则出现松弛延迟和形态学变异。
(doi: 10.1016/j.stemcr.2021.03.013.)
最后,多器官平台研究揭示了其他组织的代谢如何驱动心脏毒性。在肝-心共培养体系中,氯米帕明经细胞色素P450酶转化为去甲基氯米帕明后,会导致心脏类器官搏动减弱、钙离子流紊乱及细胞死亡——当缺乏肝类器官时这些效应均未出现,表明肝细胞是观察到的毒性来源。
(doi: 10.1039/d0lc00921k.)
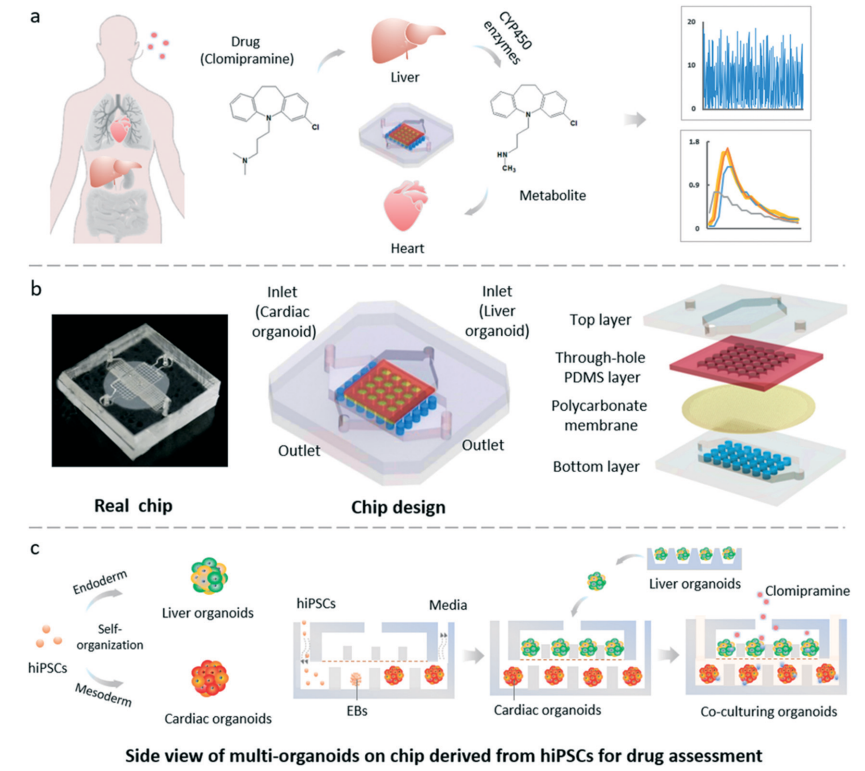
六组织串联芯片同样证实卡培他滨和异环磷酰胺的肝脏代谢会引发下游心脏毒性反应,证明了器官间交互作用在心脏毒性中的关键作用。
(doi: 10.1016/j.actbio.2020.02.015.)
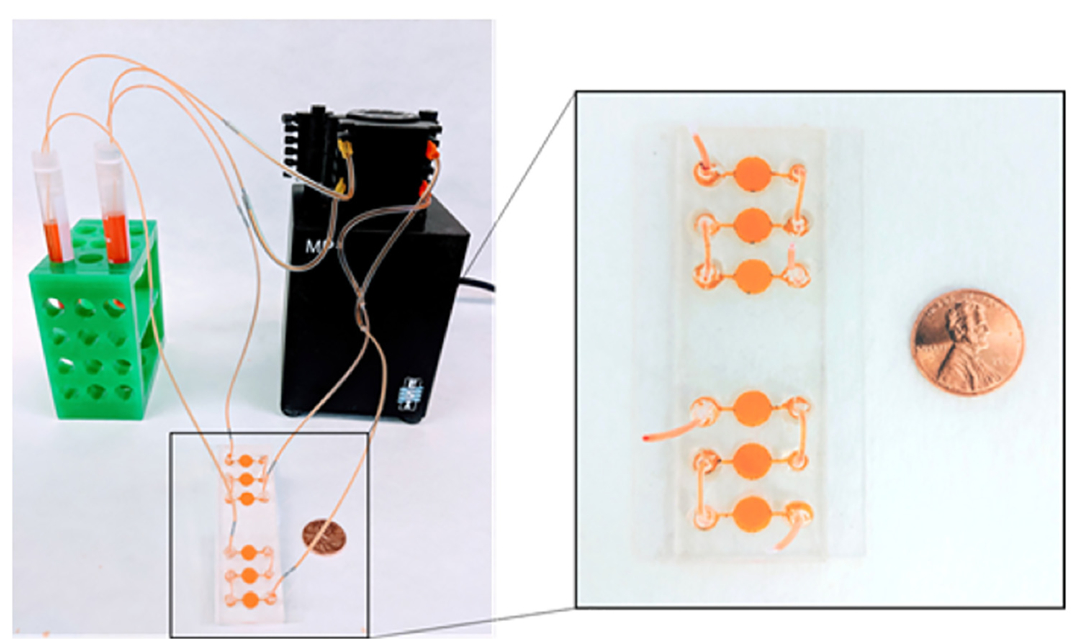
基于类器官的药物临床前安全性评价
常规类器官预测现有药物安全性的能力目前仍在探索中,但新一代具有更高复杂度的生物工程类器官平台已展现出进一步提升药物安全性测试的能力。
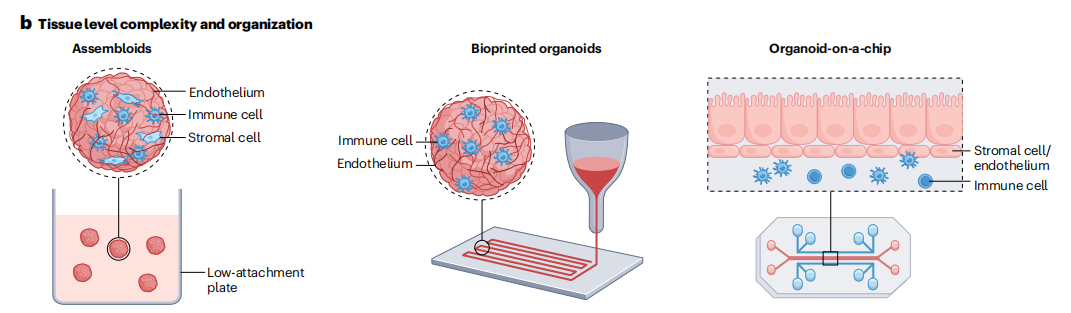
此类模型整合了血管和免疫系统,可研究药物对组织微环境及全身反应的影响,
(doi: 10.1038/s41592-019-0325-y.)
或内置生物传感器可实时检测ATP与ADP比值以评估药物诱导的肾毒性
(doi: 10.3389/fcell.2023.1138504.)。
近年来,生物工程二维类器官(如微型结肠和微型肠道芯片平台)通过维持类器官分化和顶-基极性,同时借助流体流动实现管腔通达,进一步拓展了药物安全性评估能力。
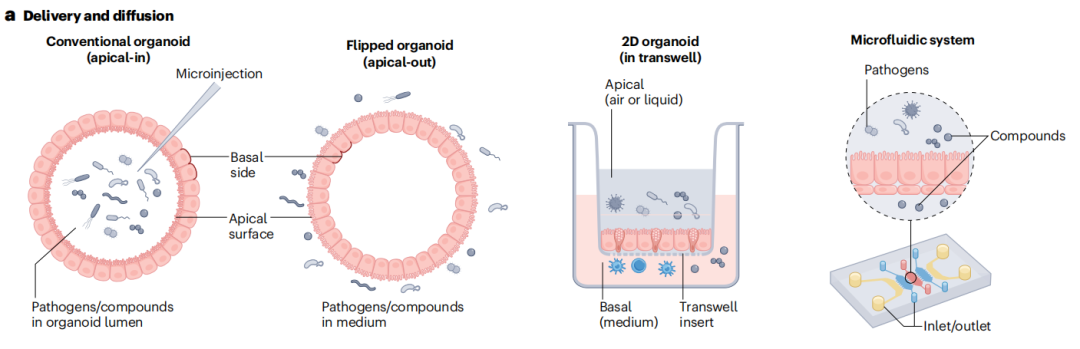
在此实验体系中,三维类器官被“打开”后,其外表面(基底面)被置于二维基质上,而类器官的内表面/管腔/顶表面则可从上方自由接触。该方法在测试阿糖胞苷和伊达奴林等靶向干细胞的癌症化疗药物时效果尤为显著。
(doi: 10.1016/j.stem.2024.05.007.)
这些将类器官生物学与生物工程技术相结合的先进平台,为应对作用机制日益复杂的治疗药物带来的转化安全挑战提供了新选择。
此外,基于Transwell的类器官单层还可通过跨上皮电阻(TEER)测量实现上皮屏障完整性的定量评估,为组织极化和紧密连接功能提供无创且动态的检测手段。
(doi: 10.1038/s41586-020-2724-8.)
此外,作为TEER测量的替代方法,基于荧光染料在组织屏障中扩散的图像分析技术也被用于体外测定完整肠类器官的屏障完整性。
上一篇:类器官的药物临床前安全性评价
下一篇:药物肾脏毒性评价
