
时间:2026-02-04浏览次数:112
实验内容:
1.形态学变化
2.类器官ATP检测(CTG法)
3.细胞Caspase凋亡检测(荧光拍照)
4.CYP3A4、CYP1A2、CYP2C9酶活检测(荧光测定法)
5.IL-6、TNF-α炎症因子检测(ELISA)
6.ALT、AST、ALB检测(生化)
实验说明:
使用iPS来源的肝脏类器官,测试药物对肝脏类器官活力、相关酶活力、炎症因子,肝功指标的影响。
肝脏是人体中负责药物代谢、生物转化及毒性物质清除的核心器官,在药物研发流程中占据至关重要的地位。药物性肝损伤(Drug-Induced Liver Injury, DILI)是新药研发失败、临床试验中止乃至上市药物退市的主要原因之一,其风险贯穿药物生命周期的各个阶段。据统计,约60%具有潜在肝毒性的药物,在临床前阶段(如动物实验或传统细胞模型)未能被有效识别(即出现“假阴性”结果),直至进入临床试验才暴露毒性。这不仅造成巨大的研发资源浪费,更严重威胁患者用药安全。
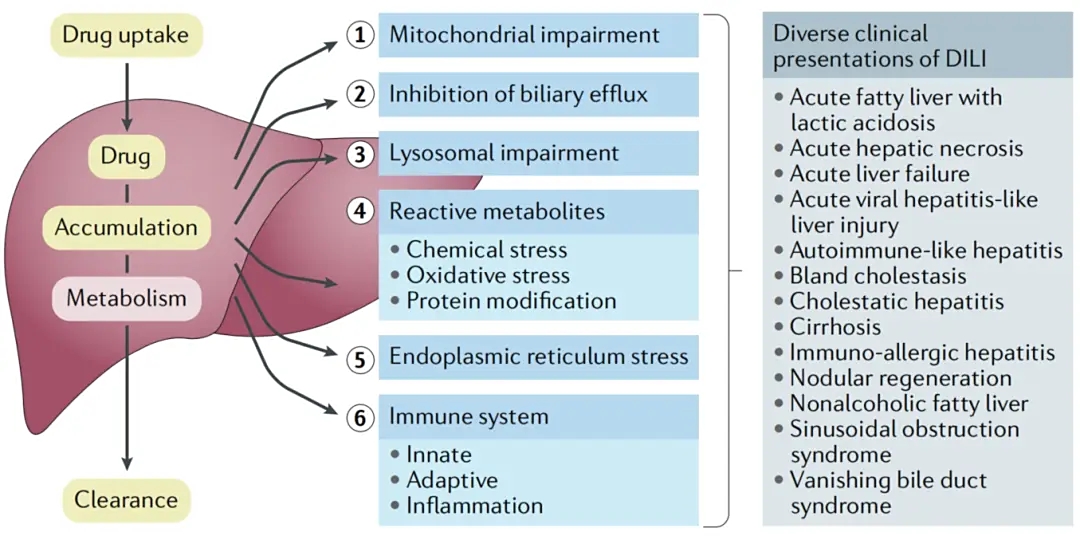
类器官(Organoids)是由干细胞在三维培养条件下自组织形成的微型器官结构,具备一定的组织分层和功能。肝脏类器官(Liver Organoids)通常由人诱导多能干细胞(iPSC)或成体干细胞分化而来,能够形成包含肝实质细胞(如肝细胞)和非实质细胞(如胆管细胞、星状细胞)等多种细胞类型的复杂结构。这种高度仿生的多细胞组成,使肝脏类器官能够更准确地模拟体内肝脏的代谢功能和毒性反应,成为继动物模型和二维细胞模型之后的理想替代方案。
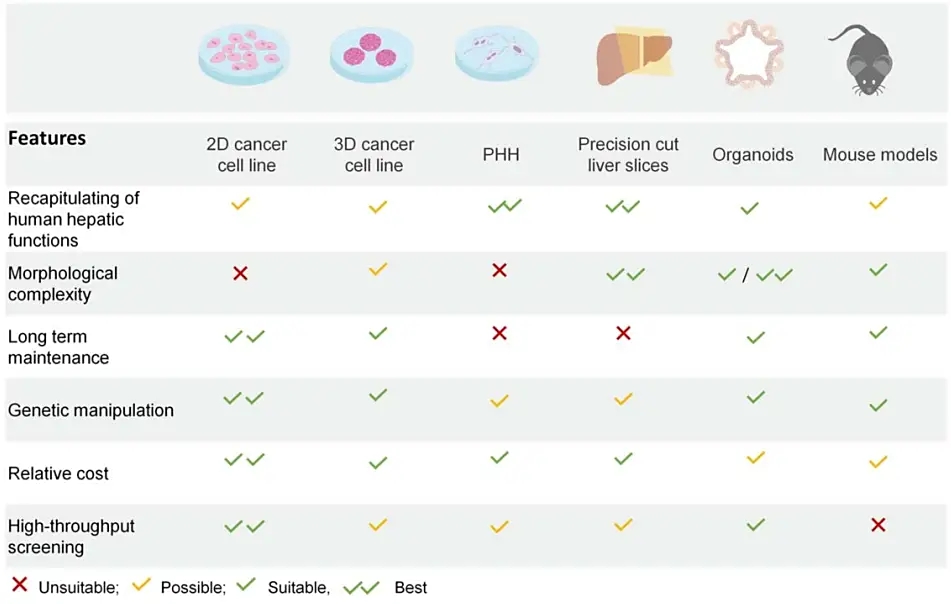
肝脏类器官在药物研发各阶段的应用场景日益丰富。在药物毒理检测方面,它能够识别代谢依赖性或隐匿性毒性药物,弥补传统模型在低剂量慢性毒性和胆汁淤积毒性检测中的不足;在药物代谢研究中,肝脏类器官能够稳定表达多种关键代谢酶,适用于评估细胞色素P450(CYP)酶诱导、胆红素代谢等药代动力学指标。同时,它还可用于构建脂肪肝、非酒精性脂肪性肝炎(MASH)、胆汁淤积等疾病模型,支持机制研究和药物筛选。凭借这些优势,肝脏类器官正在逐步成为临床前安全性评价中的体外替代方案,推动药物开发向更高效、更安全的方向发展。
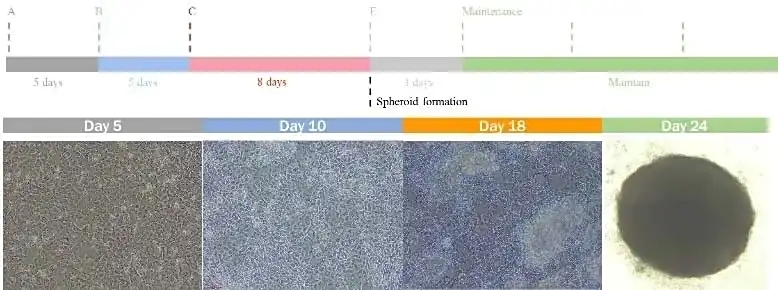
肝脏类器官分化时间表
免疫荧光染色显示,类器官中包含多种关键肝脏细胞类型:表达血小板内皮细胞黏附分子1(CD31)的血管内皮细胞在肝脏类器官表面和内部均有分布,表达白蛋白(ALB)的肝实质细胞和表达细胞角蛋白19(CK19)的胆管细胞也清晰可见,且胆管细胞主要分布于肝脏类器官的外周区域。这一特征模拟了天然肝脏组织的极性结构——在肝小叶中,肝细胞位于中央区域,而胆管细胞则分布在外周的门管区附近。
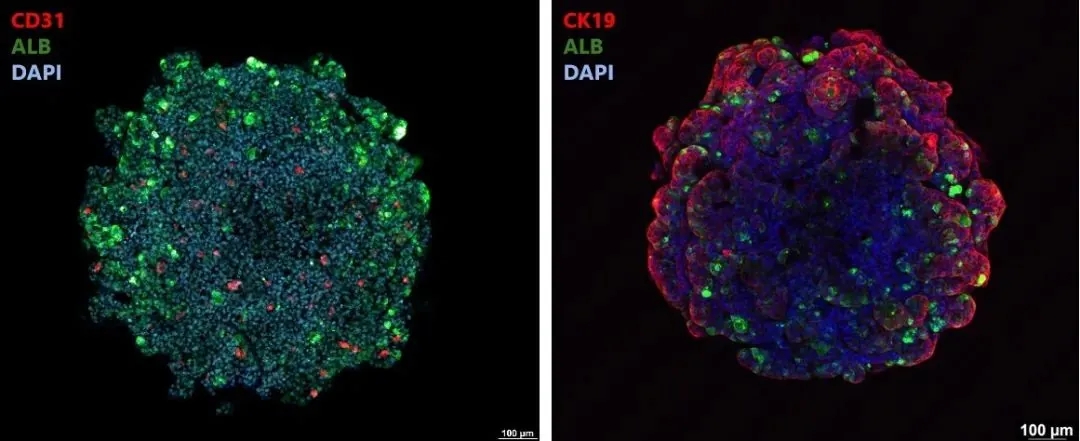
iPSC来源的肝脏类器官的细胞组成特征
1、利用肝脏类器官模拟炎症
在高脂高糖刺激的基础上,加入脂多糖(LPS)处理肝脏类器官。结果表明,LPS显著诱导了先天免疫相关因子(如IL家族蛋白)和肿瘤坏死因子α(TNF-α)的上调,说明肝脏类器官能够有效地模拟肝脏在病理刺激下的炎症反应及相关通路的激活。
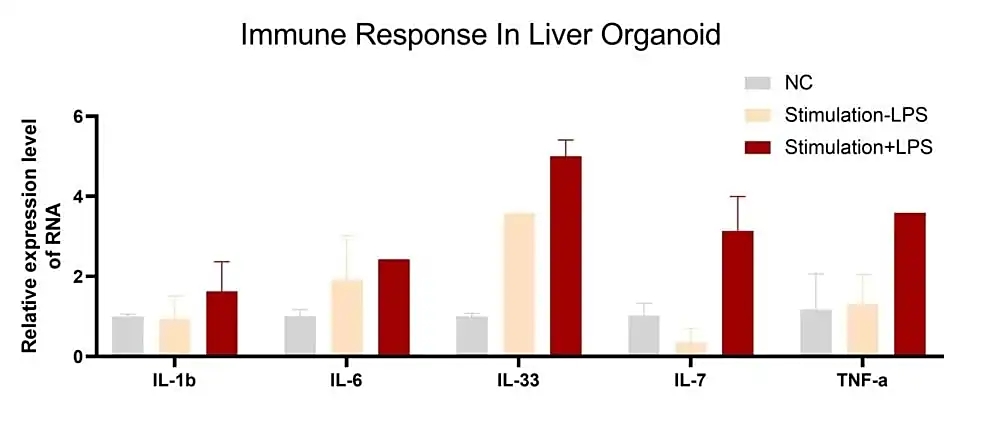
高脂高糖刺激和LPS处理诱导肝脏类器官内炎症因子表达水平上调
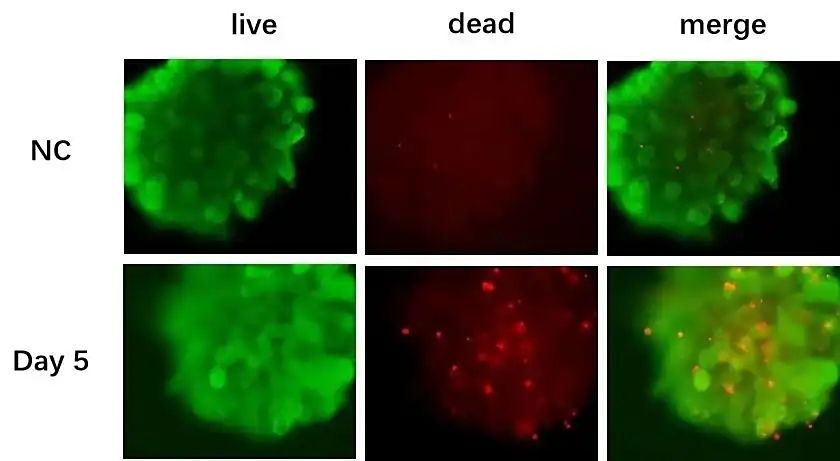
2、利用肝脏类器官评估药物对细胞活率的影响
使用肝毒性阳性药物曲格列酮(Troglitazone)处理肝脏类器官,并通过AO/PI(吖啶橙/碘化丙啶)双染法检测细胞活力。结果显示,处理组中红色荧光信号(指示死细胞)显著增强,细胞死亡率显著升高。这表明,肝脏类器官可有效模拟药物对肝细胞的直接损伤作用,具备可靠的药物肝毒性评估能力。
3、利用肝脏类器官评估药物诱导的氧化应激反应
使用肝毒性阳性药物对乙酰氨基酚(APAP)处理肝脏类器官,利用活性氧(ROS)特异性荧光探针检测细胞内ROS的累积情况,以评估药物诱导的氧化应激反应。结果显示,APAP处理显著提高了类器官内的ROS水平,红色荧光信号的强度和分布范围均明显增强,表明肝脏类器官能够有效模拟氧化应激引起的肝损伤。
作为肝毒性评价中常用的阳性对照药物,APAP在肝脏中需经CYP酶系代谢生成毒性中间体N-乙酰基-对本醌亚胺(NAPQI),进而诱导肝损伤。因此,APAP诱导的ROS累积效应也验证了ACRO肝脏类器官具备相关酶活性,能够有效模拟药物代谢反应。
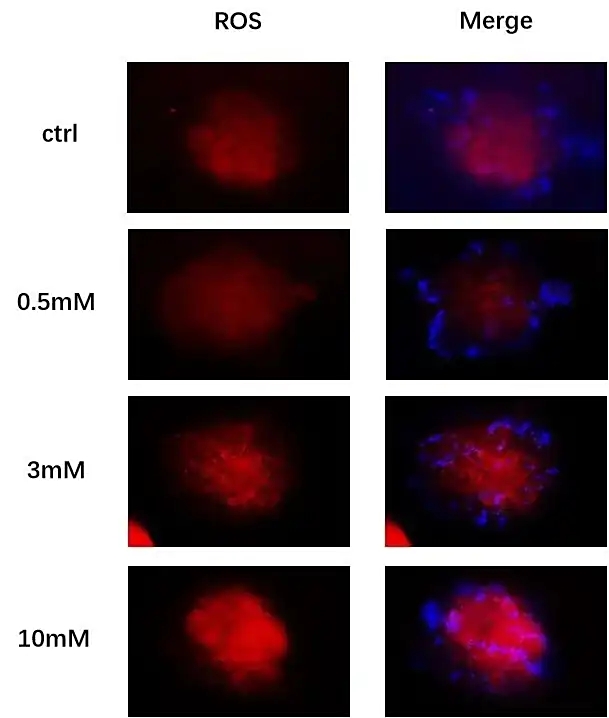
APAP处理引起肝脏类器官ROS水平上升
上一篇:药物肾脏毒性评价
