
时间:2026-01-16浏览次数:162
肠道类器官是一种来源于干细胞的三维体外培养系统,能够在体外模拟肠道的组织结构与功能。它是利用干细胞(包括成体干细胞和多能干细胞)在含有生长因子的三维基质(如Matrigel)中诱导形成,具有与体内肠道上皮相似的细胞组成和组织结构。
小肠与大肠(源于网络)
1. 小肠与结肠的肠隐窝微环境
肠隐窝微环境是肠干细胞生长、增殖和分化的关键场所。在小肠和结肠中,肠干细胞与周围细胞之间的相互作用非常重要,这些细胞通过各种信号分子维持着肠干细胞的功能,并调控其增殖与分化。尽管小肠和结肠的微环境有所不同,但它们都依赖于紧密的细胞间合作来维持肠道的正常生理功能。
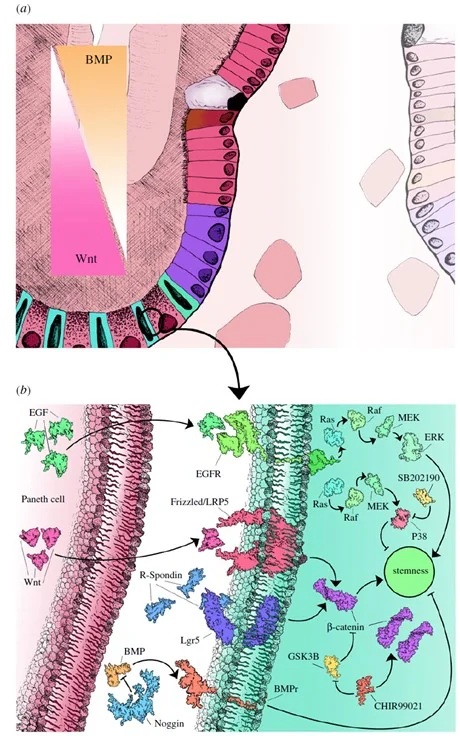
肠道干细胞生态位的信号调节
1.1 小肠隐窝微环境:
小肠LGR5+干细胞与周围细胞的相互作用:小肠的LGR5+干细胞位于隐窝底部,这些细胞通过不对称分裂产生新一代细胞,快速向上迁移并最终分化成不同类型的肠上皮细胞。在隐窝底部,潘氏细胞、肠内分泌细胞以及周围的基质细胞(如间充质细胞)共同构成了干细胞生态位。
潘氏细胞的作用:潘氏细胞通过分泌Wnt3a、EGF和TGFα等细胞因子,支持LGR5+干细胞的增殖与自我更新。它们还通过分泌抗菌肽帮助维持肠道免疫防御,保证肠道微生态的平衡。
信号通路的调控:小肠隐窝中的Wnt3a浓度梯度是决定干细胞维持与分化的关键因素,Wnt信号在隐窝底部最强,逐渐向隐窝顶部减少。同时,隐窝顶部的Notch信号减少和BMP信号增加有助于促进干细胞的分化。
1.2 结肠隐窝微环境:
结肠LGR5+干细胞与周围细胞的相互作用:与小肠不同,结肠隐窝中的LGR5+干细胞与Reg4+分泌细胞紧密相邻,没有潘氏细胞。但Reg4+分泌细胞可与周围的间充质组织共同维持LGR5+干细胞的干性,并促进其增殖和分化。
Reg4+细胞的作用:Reg4+细胞在结肠中的功能类似于小肠的潘氏细胞,尽管它们不分泌Wnt3a,而通过通过分泌EGF和Notch配体(如DII1、DII4)调节干细胞的增殖与定位,维持结肠中LGR5+干细胞的干性与自我更新。
信号通路的调控:结肠微环境中的Wnt信号、EGF和Notch信号共同作用,确保LGR5+干细胞的自我更新。结肠中的间充质组织提供Wnt3a,这对于结肠干细胞的维持十分重要。
2. 小肠类器官和结肠类器官的建立方法
小肠和结肠的肠隐窝微环境差异使它们的类器官建立方法有所不同,主要体现在细胞因子来源的不同,使得培养基的添加物不同。Wnt信号通路是LGR5+肠干细胞维持自我更新能力的关键调控因子。Wnt3a作为Wnt信号通路的配体,能够激活β-catenin依赖的转录程序,从而促进干细胞的增殖和维持干性。若缺乏Wnt信号,会肠道干细胞过度分化或死亡。小肠自身能产生Wnt3a,因此在其类器官培养条件中适当加入Wnt信号通路激动剂(R-spondin1)即可。而结肠本身不产生Wnt3a,由周围的间充质组织提供,结肠类器官也没有间充质组织,因此结肠类器官培养基中需额外添加Wnt3a及R-spondin1。
接下来,我们对原代组织来源以及ESC/iPSCs来源的小肠和结肠类器官的基本建立过程进行整理,便于大家快速了解大致过程。
2.1 从原代组织或活检中取材建立肠道类器官
(1)材料准备:
组织样本:从健康或病变的小肠、结肠组织中获取。
缓冲液和试剂:包括无钙镁离子PBS、EDTA缓冲液、胶原酶、Matrigel基质胶等。
培养基关键添加物:Wnt3a(结肠类器官培养基必需,小肠类器官为非必需),EGF,Noggin(BMP信号通路抑制剂,防止干细胞过早分化),R-spondin1,Rho激酶抑制剂(Y-27632,抑制细胞凋亡,与Wnt信号具有协同作用)等。
(2)步骤:(小肠类器官与结肠类器官操作步骤相同)
组织处理:将新鲜组织或活检样本冲洗干净,去除表面脂肪,剪切成小块,用胶原酶消化以分离肠隐窝细胞。
肠隐窝富集:通过离心和过滤去除不需要的组织成分,确保隐窝细胞的富集。
嵌入基质:将分离出的肠隐窝细胞悬液与Matrigel混合,然后将其滴加到预热的多孔板中,形成“基质圆顶”。
添加培养基:向每个孔中加入含有特定生长因子的培养基(如Wnt3a、R-spondin1、EGF等),以促进类器官的生长和扩增。
定期传代:小肠/结肠类器官可以在7-10天后进行机械分裂和传代,以维持长期培养。每次传代时,小肠/结肠类器官会被分解为更小的片段,重新嵌入新的基质中继续生长。
冷冻保存:收集类器官,重悬于冷冻保存介质中,转移至1mL冻存管中,-80℃过夜后转移至液氮中可长期保存。
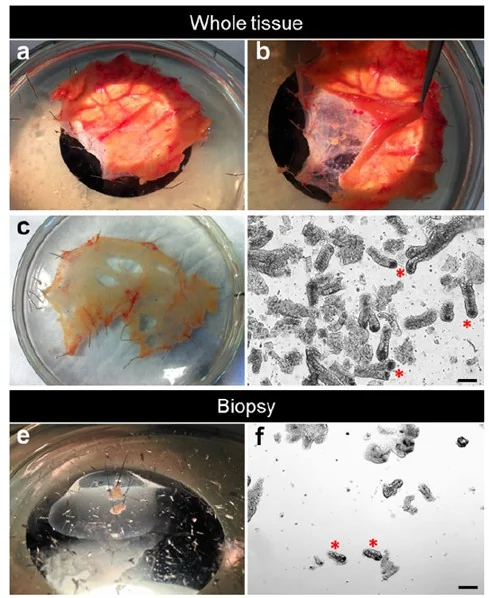
肠隐窝分离过程
(3)注意事项:不同供体的类器官生长速度可能不同,因此传代时间需要根据实际情况调整。过早或过晚传代都可能影响类器官的生长状态。
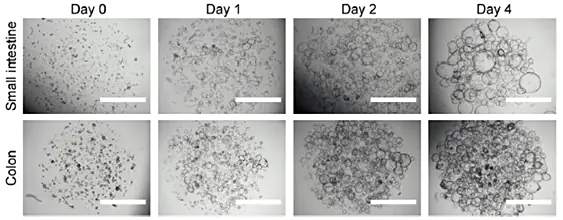
不同阶段肠道类器官培养物形态
2.2 从ESC/iPSCs开始建立小肠或结肠类器官
2.2.1 ESC/iPSCs诱导小肠类器官
(1)干细胞培养
ESC或iPSCs在无饲养层条件下生长,使用Matrigel包被的六孔Nunclon表面板,并维持在mTESR1培养基中,温度37°C,5% CO2。
每天检查细胞是否有分化迹象,适时进行传代,以确保未分化状态。
(2)定向分化为确定内胚层
使用Accutase消化后,以105个细胞/孔的密度接种到Matrigel包被的24孔板中。
第一天加入Y27632化合物至培养基中。
第二天更换为mTESR1培养基并继续培养24小时。
然后用Activin A处理3天。
(3)进一步定向分化为后部肠道球体
内胚层随后用含有Activin A、FGF4和Chiron 99021的培养基处理4天,诱导形成中后肠球体。
(4)3D培养诱导生成小肠类器官
后肠球体在3D环境中继续生长,最终形成具有小肠特征的小肠类器官。
2.2.2 ESC/iPSCs诱导结肠类器官
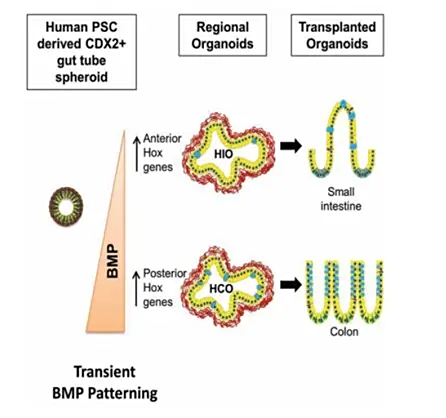
BMP信号诱导结肠类器官分化
(1)瞬时激活BMP信号
在上述诱导小肠类器官的步骤基础上,为了生成结肠类器官,研究者们发现短暂激活BMP信号通路是关键。
研究人员首先抑制了BMP信号,然后通过添加BMP2来激活它,可将hiPSCs衍生的类肠道细胞培养物导向分化为结肠类器官。
(2)维持和扩增结肠类器官
在第20天,细胞被分解成单细胞悬浮液,并重新悬浮于Matrigel中,在 Nunclon Delta Surface 板的中央形成固体穹顶结构。
接着,用结肠培养基培养细胞,并在前两天添加Y-27632。
在接下来的3周内,单个结肠干细胞产生结肠类器官,这些类器官每隔10天以1:4的比例传代。
结肠类器官可在这些条件下维持和扩增长达3个月。
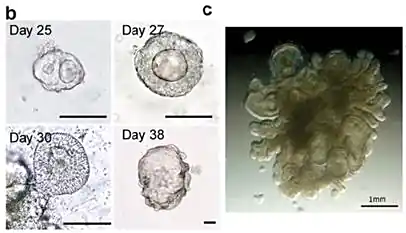
hESC诱导的结肠类器官
总的来说,小肠类器官和结肠类器官的建立方法已得到广泛的应用和发展,尽管原代组织或是多能干细胞生成类器官的方法及过程尚未有一个明确的标准,但其中的关键步骤已基本达成共识,例如Wnt信号、EGF等细胞因子的添加。
参考文献
[1] Fair KL, Colquhoun J, Hannan NRF. Intestinal organoids for modelling intestinal development and disease. Philos Trans R Soc Lond B Biol Sci. 2018 Jul 5;373(1750):20170217.
[2] Crespo M, Vilar E, Tsai SY, Chang K, Amin S, Srinivasan T, Zhang T, Pipalia NH, Chen HJ, Witherspoon M, Gordillo M, Xiang JZ, Maxfield FR, Lipkin S, Evans T, Chen S. Colonic organoids derived from human induced pluripotent stem cells for modeling colorectal cancer and drug testing. Nat Med. 2017 Jul;23(7):878-884. doi: 10.1038/nm.4355. Epub 2017 Jun 19. Erratum in: Nat Med. 2018 Apr 10;24(4):526.
[3] Múnera JO, Sundaram N, Rankin SA, Hill D, Watson C, Mahe M, Vallance JE, Shroyer NF, Sinagoga KL, Zarzoso-Lacoste A, Hudson JR, Howell JC, Chatuvedi P, Spence JR, Shannon JM, Zorn AM, Helmrath MA, Wells JM. Differentiation of Human Pluripotent Stem Cells into Colonic Organoids via Transient Activation of BMP Signaling. Cell Stem Cell. 2017 Jul 6;21(1):51-64.e6. doi: 10.1016/j.stem.2017.05.020. Epub 2017 Jun 22. Erratum in: Cell Stem Cell. 2019 May 2;24(5):829.
[4] Tsuruta S, Uchida H, Akutsu H. Intestinal Organoids Generated from Human Pluripotent Stem Cells. JMA J. 2020 Jan 15;3(1):9-19.
[5] Mithal A, Capilla A, Heinze D, Berical A, Villacorta-Martin C, Vedaie M, Jacob A, Abo K, Szymaniak A, Peasley M, Stuffer A, Mahoney J, Kotton DN, Hawkins F, Mostoslavsky G. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nat Commun. 2020 Jan 10;11(1):215.
[6] Mahe MM, Sundaram N, Watson CL, Shroyer NF, Helmrath MA. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. J Vis Exp. 2015 Mar 6;(97):52483.
[7] Pleguezuelos-Manzano C, Puschhof J, van den Brink S, Geurts V, Beumer J, Clevers H. Establishment and Culture of Human Intestinal Organoids Derived from Adult Stem Cells. Curr Protoc Immunol. 2020 Sep;130(1):e106.
下一篇:人胰腺类器官
