
时间:2026-01-07浏览次数:194
外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMC)是免疫学、肿瘤学及相关领域研究中的核心材料。PBMC主要包括T细胞、B细胞、自然杀伤细胞(NK细胞)和单核细胞等,是外周血中关键的免疫细胞群体。通过密度梯度离心法,我们可以高效地从外周血中分离出PBMC,为后续的细胞培养、功能分析或冷冻保存提供高质量的细胞样本。
PBMC分离流程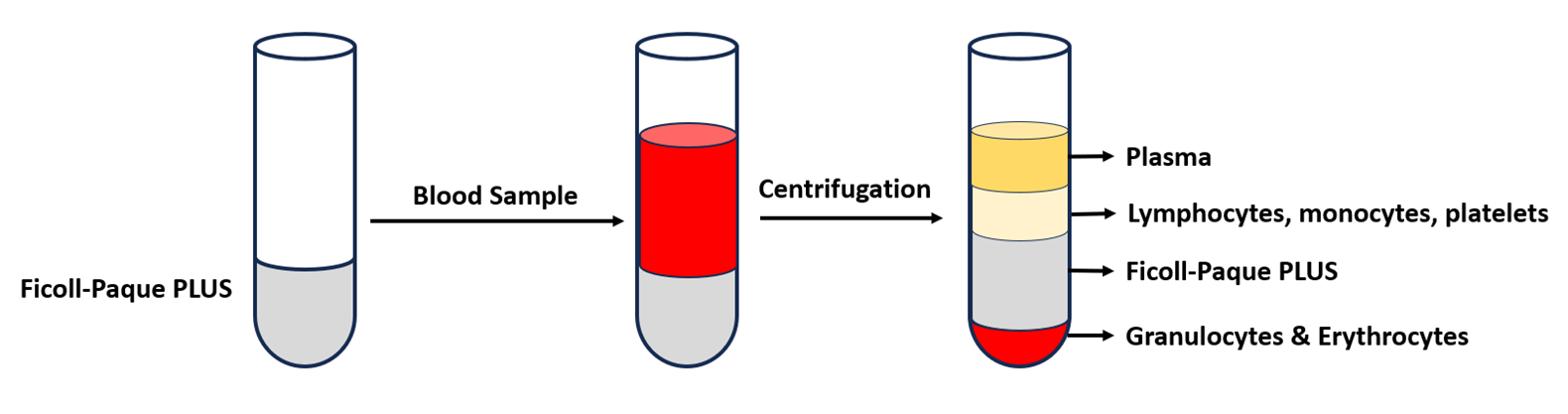
样本准备
为避免血液凝固,需使用抗凝剂处理样本,常用抗凝剂为EDTA。采集时,需确保采血过程无菌,并尽快进行后续操作,以减少细胞活性的损失。
血样稀释
将采集的外周血样本与无菌平衡盐溶液按 1:1 的比例进行稀释。稀释时需轻柔混匀,避免产生气泡或破坏细胞。建议在无菌操作台内完成此步骤,以确保实验环境的洁净。
密度梯度离心
密度梯度离心是PBMC分离的核心步骤。操作时,在15 ml或50 ml离心管中加入等体积的密度梯度介质。随后,小心将稀释后的血样沿离心管壁缓慢加入,使其层叠在Ficoll-Paque液面上,确保两者界面清晰,避免混合。
离心操作
将装有血样和Ficoll-Paque的离心管置于离心机中,设置离心参数为400 g,30分钟,室温(18-25°C)。为防止分层界面被扰乱,离心时需关闭离心机的制动功能。离心结束后,血液将分层:底部为红细胞层,中部为Ficoll-Paque层,顶部为血浆层,而PBMC则形成一层白色的雾状环,位于Ficoll-Paque与血浆的界面处。
PBMC收集
使用无菌的巴斯德吸管或移液枪,小心吸取白色雾状的PBMC层,转移至新的离心管中。操作时需轻柔,避免吸入过多Ficoll-Paque或血浆,以免影响后续实验的纯度。
PBMC洗涤
为去除残留的Ficoll-Paque、血浆成分及其他杂质,需用平衡盐溶液(如 D-PBS)对PBMC进行两次洗涤。加入适量D-PBS(约10 ml),轻柔混匀后,以 300 g,10分钟 的参数离心,弃上清。重复此步骤,确保细胞干净。
细胞计数与活力检测
洗涤后的PBMC需进行细胞计数和活力检测,以评估细胞质量。推荐使用 台盼蓝染色法,通过显微镜观察活细胞(不被染色的细胞)与死细胞(被染成蓝色的细胞)比例。结合血细胞计数板,准确计算PBMC的浓度和存活率。
PBMC保存与应用
分离后的PBMC可根据实验需求直接用于细胞培养、流式细胞术分析或功能实验。
注意事项
无菌操作:整个分离过程需在生物安全柜内完成,避免污染。
时间控制:血液采集后应尽快进行分离,最好在4小时内完成,以确保细胞活性。
温度管理:除冷冻保存外,分离过程建议在室温下进行,避免温度变化对细胞活性的影响。
离心参数:离心速度和时间需严格控制,过高的离心力或过长的离心时间可能导致细胞损伤。
上一篇:成纤维原代细胞提取
