
时间:2026-01-12浏览次数:449
食管是连接口腔与胃的管状器官,主要功能是通过肌肉收缩(蠕动)将食物从咽部输送至胃部。其结构复杂,功能多样,由内向外分为四层,其中还包含肠神经系统:
(1)黏膜层:包含复层鳞状上皮,由基底细胞层(增殖性祖细胞)和腔细胞层(终末分化细胞)组成,通过不断增殖、迁移和脱落维持动态平衡;具有屏障功能,抵御机械摩擦和化学刺激。
(2)黏膜下层:富含血管、淋巴管、神经丛及食管腺,为上皮提供营养支持。
(3)肌层:由平滑肌组成,包括内层环形肌和外层纵形肌,通过蠕动推动食物下行。
(4)外膜:食管最外层的薄层结缔组织,与周围组织相连。
(5)肠神经系统:由神经嵴衍生的神经细胞和神经纤维组成,嵌在食管的黏膜下层和肌层中,负责调控食管的肌肉收缩(蠕动)和腺体分泌,以协调食物运输。
食管癌类器官作为一种新兴的三维细胞培养模型,正在为食管癌研究开辟新的道路。它能够从患者肿瘤组织中提取细胞,在体外模拟出与原始肿瘤高度相似的结构和功能,为科学家们提供了一个强大的研究平台。 与传统的二维细胞培养和动物模型相比,食管癌类器官具有显著优势。首先,它能够保留肿瘤的异质性,包含多种细胞类型,更真实地反映肿瘤的复杂特征。其次,食管癌类器官可以作为个体化治疗的平台,通过药物敏感性测试,为患者筛选出最有效的治疗方案,实现精准医疗。
建立原位食管癌小鼠模型
本方法介绍原位移植手术及体内活体成像监测步骤。受体小鼠需为BALB/cA-nu,年龄≥6周,性别不限。
原位移植手术
1. 用TrypLE收集足量类器官(每只小鼠约2×10⁵-5×10⁵个细胞,或2-4个孔的类器官)。
2. 将编辑后的类器官用PBS与Matrigel按1:1混合后重悬,总体积20 μL,置冰上备用,但不超过2小时。
3. 使用异氟烷麻醉受体小鼠。
4. 用胶带固定四肢,使小鼠仰卧。
5. 用70%乙醇喷洒小鼠腹面及操作区。
6. 在小鼠左侧肋下缘处切开0.5 cm切口进入腹腔:
a. 将肝脏拨向一侧,显露胃部。
b. 轻轻夹住胃部,用镊子定位食管,在胃食管交界处,从胃侧向食管方向插入针头。
c. 将针头定位在距食管出口约3 mm处。
d. 确保针头平行食管,置于肌层与黏膜层之间,插入深度约3 mm。
e. 用胰岛素针向食管黏膜内注射约20 μL细胞悬液(图A)。
7. 立即缝合切口。
8. 移植20天后使用D-luciferin成像系统监测肿瘤生长(图B)。
注意:建议选用≥8周龄小鼠,因过年龄过小的小鼠食管过薄,手术操作困难。裸鼠与C57BL/6均可作受体,但裸鼠20天左右即可成瘤,而C57BL/6约需40天。成瘤监测时间受类器官编辑效率、活性及移植成功率影响。在我们的TPSCK模型中,约20天后可检测到荧光信号,并可持续约60天。实验终点定义为因肿瘤导致死亡或因食管梗阻导致体重降至<15 g。
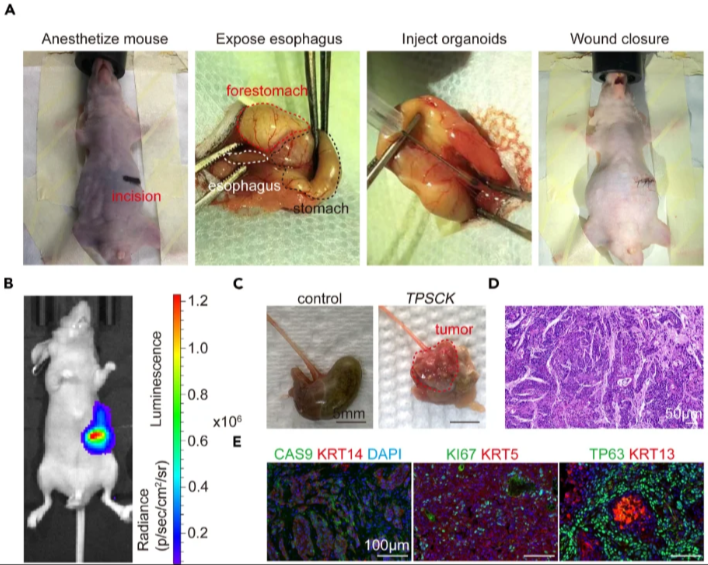
本方法建立了一套原发性、原位且具有明确遗传背景的肿瘤模型构建方案。该方案包括:分离小鼠食管原代细胞、建立食管类器官培养体系、进行类器官基因组编辑及原位移植。
嵌入Matrigel的食管上皮细胞最终发育成具有特征性“草帽样”形态的中间角化型类器官,再现了小鼠食管组织中观察到的中度角化及周围干细胞增殖特征,也与人类食管类器官的病理表现一致。
在ESCC患者队列中,常见的基因组事件包括:抑癌基因TP53、PTEN和SMAD4的功能缺失(缺失或突变),以及MYC与KRAS的拷贝数扩增。基于此推测联合破坏这些基因可能驱动肿瘤发生。
为验证这一假设,研究者从Trp53/ROSA-CAG-Cas9-iRES-eGFP小鼠中分离原代食管细胞并建立类器官培养。随后通过共表达mCherry的慢病毒载体敲除Pten与Smad4,并利用携带荧光素酶报告基因的逆转录病毒载体实现cMyc和KrasG12D过表达。
通过Sanger测序验证抑癌基因敲除效率,并用qPCR检测癌基因过表达水平。由于小鼠食管壁较薄且胸段食管手术暴露困难,研究者将基因编辑后的TPSCK类器官(Trp53-/-;sgPten;sgSmad4;cMyc;KrasG12D)原位移植至胃食管交界处的食管黏膜层。
D-荧光素生物发光成像证实移植物在移植部位稳定存活并持续生长。肉眼观察发现,移植物可完全占据胃食管交界处。组织病理学分析显示其具有典型的ESCC组织学特征,免疫组化进一步证实其表达 鳞状细胞癌标志物TP63、KRT5、KRT13、KRT14(图C-E)。
本方法建立了一种从小鼠食管组织分离原代细胞并培养类器官的方法。然而,由于食管通过口腔与外界相通且并非无菌环境,在操作过程中难免出现细菌或真菌污染。一旦发生污染,必须及时处理以防止其进一步扩散。
在ESCC患者中,食管鳞状细胞癌多发生于食管上段和中段。但由于手术操作难度较大,本模型难以完全模拟这些主要发病部位。小鼠食管较细窄,一旦肿瘤形成,易引起食管梗阻,导致营养不良甚至死亡。
此外,由于ESCC中基因突变频率高且患者间突变组合复杂,目前的策略只能模拟部分可能的突变组合并研究特定基因功能,仍与患者真实情况存在差距。
另外,食管癌中大段染色体片段的缺失和扩增远多于单基因突变或功能缺失,但由于人鼠两种生物间染色体结构差异明显,本模型难以再现这些染色体改变对食管癌发生发展的影响。
Q1
在类器官培养、传代及感染过程中,Matrigel小穹顶内出现气泡,影响类器官发育
解决方案:气泡主要由吹打过度引起。当用Matrigel重悬类器官时,如果吸头内液体被完全推出,空气就会混入。建议在吹出时保留少量液体,以防止空气进入Matrigel中。
Q2
类器官培养或传代过程中,Matrigel小穹顶塌陷,导致类器官发育不良
解决方案:主要原因是在重悬类器官时残留胰蛋白酶或TrypLE未清除干净。可在重悬前使用200 μL吸头将残余酶液彻底吸除,以避免Matrigel结构受损。
Q3
感染后类器官生长缓慢或发生凋亡
解决方案:主要原因是病毒滴度过高或感染孵育时间过长。可通过用培养基稀释病毒或缩短感染时间来改善类器官存活率和生长情况。
Q4
手术过程中类器官无法准确移植到食管肌层与黏膜层之间
解决方案:腹部切口位置错误,未能准确暴露贲门食管。应在左侧肋缘下方切口以便进入腹腔并暴露目标部位。胰岛素针注射角度或位置不正确,误刺入食管腔导致类器官无法定植。应将针头与食管平行约3 mm深插入,避免刺破食管包膜,并轻轻旋转针头以确保未进入食管腔。
Q5
基因编辑后的类器官在原位移植后未能形成肿瘤
解决方案:移植时类器官数量不足或活性不佳。需每只小鼠至少移植2×10⁵个活性细胞。使用嘌呤霉素筛选可提高编辑类器官的纯度与效率。手术过程中若类器官泄漏至腹腔也会导致成瘤失败,可在体视显微镜辅助下进行移植以提高精确度。
参考文献
Wang J, Du J, Luo X, et al. Protocol to generate genetically engineered organoid-initiated mouse models of esophageal cancer. STAR Protoc. 2025;6(3):104028. doi:10.1016/j.xpro.2025.104028
