
时间:2026-01-08浏览次数:303
乳腺癌是全球女性中最常见的癌症类型,且发病率呈现年轻化的趋势。手术切除、化疗、靶向治疗是临床中治疗乳腺癌的常用手段,但这些方法往往容易复发和产生耐药性,并且不同个体之间也存在显著差异,导致对治疗的效果无法预测。因此,找到一种能够准确模拟体内肿瘤微环境的理想肿瘤模型至关重要。传统的二维细胞模型和人源肿瘤异种移植模型虽能在一定程度上模拟体内肿瘤,但仍存在生物稳定性差、无法进行高通量筛选以及动物伦理等问题。类器官肿瘤切片培养模型平衡了二维细胞模型和人源肿瘤异种移植模型的优缺点,可以在短时间内保留基本的组织病理学结构,用于精准药物筛选。但类器官肿瘤切片难以长时间保留,因此只适用于对肿瘤组织进行部分表征。
类器官技术在一定程度上能克服传统培养技术的局限性。乳腺癌类器官是一种体外培养的三维细胞模型,由患者来源的肿瘤干细胞或癌变组织在含有支架材料(如基质胶)的体外培养体系中形成,能够高度模拟原发肿瘤的细胞成分、组织结构和分子表型特征。这类模型通过保留肿瘤的遗传异质性和功能异质性,为研究乳腺癌的病理机制、药物筛选及个体化治疗提供了新型实验平台,同时也降低了动物实验的伦理风险。
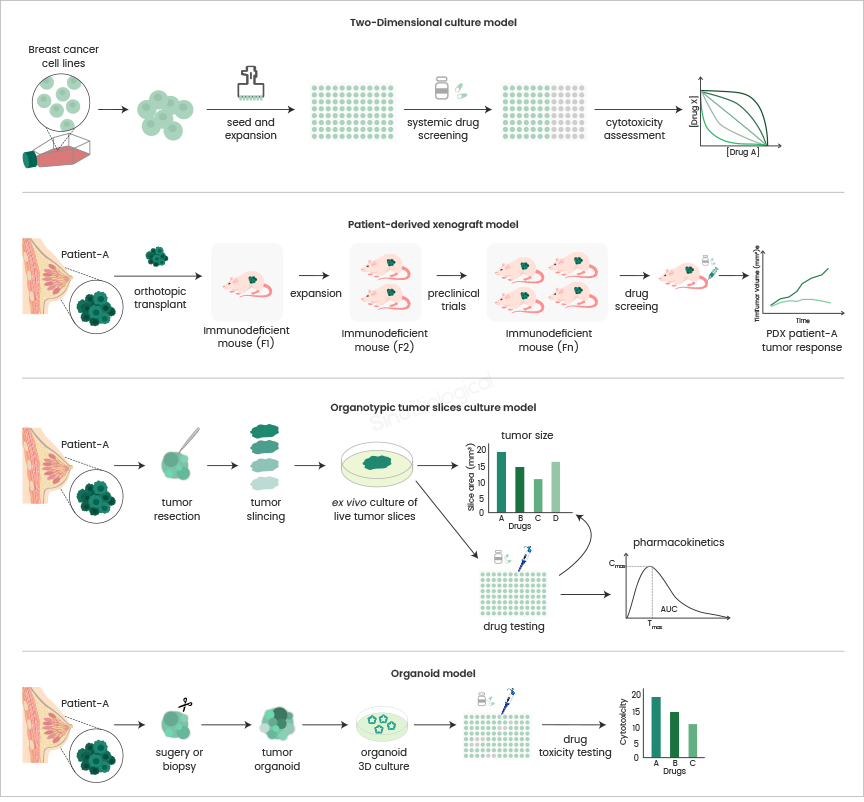
不同乳腺癌模型体外培养示意图
乳腺癌类器官培养方案
本实验方案展示了乳腺癌类器官培养的通用流程,该方案参考自: Dekkers, J.F. et al. Long-term culture, genetic manipulation, and xenotransplantation of human normal and breast cancer organoids. Nat Protoc 16, 1936–1965 (2021)。本操作流程仅作经验分享,为科研工作提供参考。
1. 组织前处理
新鲜乳腺组织样本(体积<3–4 cm³)需立即置于含冰镇D-BSA溶液的50 mL离心管中,以维持细胞活性。然后将组织转移至10 cm玻璃培养皿,使用标尺进行拍照记录尺寸参数,并对坏死区域及血管分布等形态学特征进行标准化描述。去除过量D-BSA溶液后,采用交叉刃手术刀将组织机械切割为2–4 mm³的规则块状结构。
2. 类器官分离与制备
使用双手术刀将剩余组织精细切割至0.5–1 mm³碎片,随后置于含I型胶原酶(1 mg/mL)与ROCK抑制剂(10 μM)的消化液中,通过轨道摇床(140转/分,37°C,1-2小时)进行酶解消化,期间辅以间歇性吹打提升解离效率。当显微镜下观察到5-10个细胞簇形成时,通过添加胎牛血清终止消化反应。经三级过滤(100 μm细胞筛)去除未消化残渣后,进行梯度离心(450g,5分钟,8°C)。离心沉淀细胞以4:1的基质-细胞比例重悬于基底膜基质(BME),点样为<20 μL微滴。将培养板倒置固化(37°C,30分钟)后,加入类器官专用培养基(750 μL/孔,37°C,5% CO₂环境),维持每2-4日换液周期。
3. 培养基更换操作
常规维护时,将BME包埋的类器官培养板倾斜45°,沿孔板边缘吸除废液。采用P1000移液器或血清学移液管(5-100 mL规格)逐滴加入37°C预热的扩增培养基(750 μL/孔),通过定向灌注至孔板下角区域以避免基质结构损伤。
4. 类器官维持与冻存
类器官解离采用TrypLE消化液(1 mL/孔)结合机械吹打(6-20次)获得单细胞悬液或碎片,经镜检确认解离效果。解离产物经冰adDMEM/F12+++培养基(10 mL)中和后离心(300g,5分钟,4°C),重悬于扩增培养基进行台盼蓝染色活率检测(按12孔板规格接种20-50万细胞/孔)。离心沉淀细胞可用于再接种或基因编辑操作(包括转染、电穿孔及慢病毒转导)。
冻存程序采用标准化密度重悬细胞于冻存液(如90%胎牛血清+10% DMSO),保存于液氮气相层。通过定期传代(7-21天)与培养基更新(每2-4天)维持细胞增殖潜能。
乳腺癌类器官培养常见问题解答
在乳腺癌类器官培养过程中,细胞活性低下、生长模式异质化及肿瘤特征丢失等问题可能影响实验的可重复性。现就关键问题提出标准化解决方案:
•解冻后存活率低:通过逐步减少冷冻保护剂(如DMSO)和用富含层粘连蛋白的ECM(70-80%基质胶)预包被培养板来优化解冻。添加10 μM ROCK抑制剂,24-48小时以阻断失巢凋亡。对于CTC来源的类器官,补充NRG1-β1以激活HER3信号。
•异质性生长:使用IV型胶原酶/分散酶进行温和解离,通过40 μm过滤器过滤,并以500-1,000细胞/μL的密度接种(根据TNBC侵袭性调整)。微流体系统(如DSO Nebula)通过灌注提高均一性。
•ECM破碎:添加2 μg/mL抑肽酶以抑制蛋白酶。I型胶原基质可稳定激素受体阳性亚型,而ALI培养或合成水凝胶(如KemiGel)支持HER2+类器官。
•正常类器官污染:来自活检的非恶性上皮细胞可能主导培养。为抑制正常类器官生长,通过差异离心或葡萄糖限制(5 mM)富集肿瘤细胞。
乳腺癌类器官培养细胞因子
乳腺癌类器官的成功构建及体外维持,关键在于对模拟肿瘤微环境的细胞因子组合进行精准优化。该培养体系通过维持干细胞特性、抑制细胞凋亡以及促进谱系特异性分化等关键生物学过程,精准复现肿瘤特异性信号通路。乳腺癌类器官培养常用的细胞因子有Wnt3a、EGF、R-spondin,该组合能够形成关键调控模块,驱动细胞粘附、极性建立并激活Wnt/β-catenin和EGFR-MAPK等致癌信号通路。同时,在培养过程中加入小分子化合物可以拮抗应激诱导的细胞死亡,确保培养体系的长期稳定性。

乳腺癌类器官培养用细胞因子和小分子化合物及推荐浓度
乳腺癌类器官的鉴定
乳腺癌类器官的鉴定需建立多维度表征体系,确保其与源肿瘤组织在结构和功能上的高度一致性。免疫组织化学(IHC)与免疫荧光(IF)分析的核心生物标志物包括:
• Ki67(增殖活性标志物):定量评估肿瘤类器官的侵袭性及药物敏感性
• ER/PR(激素受体):指导分子分型与内分泌治疗模型的构建
• HER2(膜表面受体):界定靶向治疗适用性(如曲妥珠单抗)
ER阳性类器官(核染色特征)可模拟激素响应型肿瘤,而HER2膜阳性类器官则适用于靶向治疗研究。PR作为辅助分型标志,其表达水平在类器官与原发组织间可能存在差异,需结合临床病理进行校正。
此外,H&E染色验证能够确保类器官保留乳腺肿瘤典型组织学特征,包括细胞极性丧失、核异型性及腺样结构形成等。通过qPCR、RNA测序及Western blot等分子技术,可系统验证TP53/PTEN等乳腺癌高频突变基因的表达模式。该多层级验证体系能有效确认类器官与患者肿瘤的生物学一致性,为药物筛选与个体化医疗提供可靠模型。
乳腺癌类器官的应用
乳腺癌类器官已成为肿瘤学研究和个性化医疗的关键工具。这些类器官能高度复现原始肿瘤的组织学与遗传特征,相较于传统二维细胞培养模型,更能准确反映体内肿瘤特征。乳腺癌类器官的重要应用领域之一是药物筛选与开发。通过培养患者个体化类器官,研究人员能够测试不同治疗药物的疗效与毒性,从而筛选出针对患者特异性肿瘤特征的最有效治疗方案。这种个体化策略在提高治疗成功率的同时显著降低了副作用。
乳腺癌类器官为研究肿瘤生物学及其进展机制提供了重要模型。该技术能够用于研究肿瘤-间质相互作用、转移机制以及驱动癌症发展的基因突变。这些研究成果对发现新型治疗靶点和推进癌症治疗模式发展具有关键价值。
相比之下,正常乳腺类器官能够在三维环境中维持乳腺腺泡样结构和双层上皮特征,适用于研究雌激素、孕激素等激素对乳腺发育与功能的调控作用。此外,该模型也常被用于分析乳腺干/祖细胞的分化谱系及其调控机制,为探索乳腺发育异常与癌前病变之间的潜在联系提供了基础。
乳腺癌类器官的前景和挑战
尽管乳腺癌类器官在肿瘤建模、药物测试及发育机制研究中展现出重要应用价值,但其临床转化仍面临多重技术挑战。现有培养体系存在建系成功率偏低(<80%)、类器官表型批间差异显著等核心问题,即便采用同源组织样本且在标准化操作流程下,仍难以保证培养结果的一致性。更为关键的是,当前模型因缺乏功能性血管网络,且无法精准模拟免疫逃逸、基质细胞信号传导等动态微环境互作机制,导致其生理相关性显著降低。
针对上述挑战,研究者正通过多维度技术创新寻求突破,如开发整合免疫细胞、成纤维细胞及血管内皮细胞的新型共培养体系,结合3D生物打印技术构建仿生微环境;配套开发标准化培养方案与基于深度学习的表型分析平台,显著提升模型可重复性及临床预测效度。突破这些技术瓶颈对实现类器官指导的个体化精准治疗、降低传统试错性治疗方案依赖具有关键转化医学意义。
参考文献
[1] Sachs N, de Ligt J, Kopper O, et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 2018;172(1-2):373-386.e10. doi:10.1016/j.cell.2017.11.010
[2] Dekkers JF, van Vliet EJ, Sachs N, et al. Long-term culture, genetic manipulation and xenotransplantation of human normal and breast cancer organoids. Nat Protoc. 2021;16(4):1936-1965. doi:10.1038/s41596-020-00474-1
[3] Tzeng YT, Hsiao JH, Tseng LM, Hou MF, Li CJ. Breast cancer organoids derived from patients: A platform for tailored drug screening. Biochem Pharmacol. 2023;217:115803. doi:10.1016/j.bcp.2023.115803
[4] Yu J, Huang W. The Progress and Clinical Application of Breast Cancer Organoids. Int J Stem Cells. 2020;13(3):295-304. doi:10.15283/ijsc20082
[5] Mohan SC, Lee TY, Giuliano AE, Cui X. Current Status of Breast Organoid Models. Front Bioeng Biotechnol. 2021;9:745943. Published 2021 Nov 5. doi:10.3389/fbioe.2021.745943
[6] Guan D, Liu X, Shi Q, He B, Zheng C, Meng X. Breast cancer organoids and their applications for precision cancer immunotherapy. World J Surg Oncol. 2023;21(1):343. Published 2023 Oct 26. doi:10.1186/s12957-023-03231-2
