
时间:2020-03-16浏览次数:4671
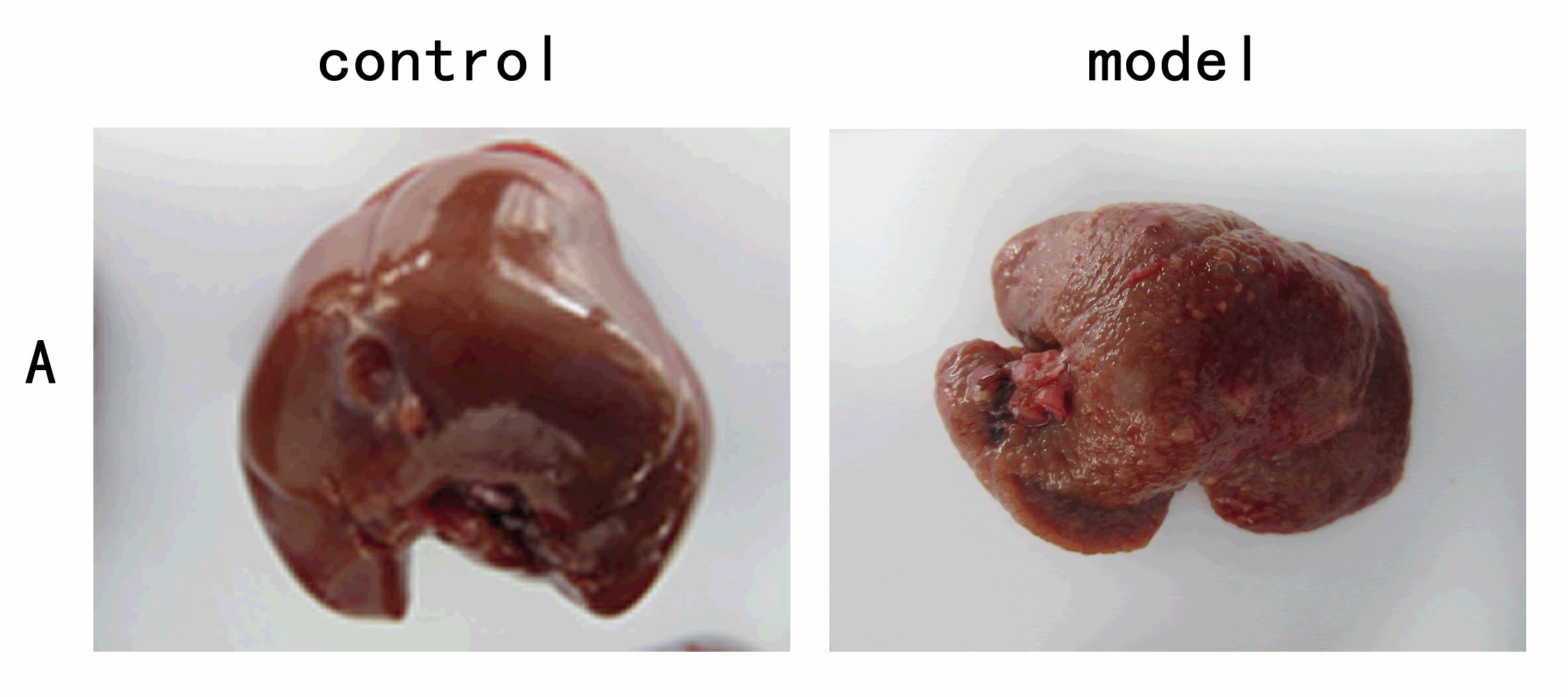
肝纤维化(Hepatic fibrosis)是一个病理生理过程,其基本表征是肝细胞被反复破坏后再生胶原、蛋白多糖等细胞外基质,在肝脏中弥漫性过度沉积与异常分布。任何肝脏损伤在肝脏修复愈合的过程中都有肝纤维化的过程,肝纤维化进一步发展,可引起肝脏的结构紊乱、肝细胞结节样再生,形成假小叶结构,即肝硬化。
肝纤维化是慢性肝损伤后细胞外基质(ECM)过度沉积的病理过程,最终可能进展为肝硬化或肝癌。动物模型是研究肝纤维化机制和药物开发的重要工具。以下是不同造模方法的核心机制、关键蛋白及临床研究关联的详细分析:
一、常见肝纤维化动物模型及造模方法
1. 化学诱导模型
方法:
四氯化碳(CCl₄):腹腔注射或皮下注射,每周2-3次,持续4-8周。
硫代乙酰胺(TAA):腹腔注射或饮水给药,持续6-12周。
机制:
CCl₄通过细胞色素P450代谢生成自由基(如CCl₃•),引起脂质过氧化和肝细胞坏死,激活炎症反应和HSC。
TAA代谢生成毒性中间体(TAA-S-氧化物),直接损伤肝细胞。
特点:操作简单、成本低,但周期长,动物死亡率较高。
2. 胆管结扎模型(BDL)
方法:手术结扎胆总管,模拟胆汁淤积性肝损伤。
机制:
胆汁酸蓄积导致肝细胞凋亡和胆管反应性增生,激活HSC和巨噬细胞。
炎症因子(如TNF-α、IL-6)和TGF-β1通路显著上调。
特点:快速诱导纤维化(2-4周),但需手术操作,适合胆汁淤积相关研究。
3. 免疫诱导模型
方法:
刀豆蛋白A(ConA):静脉注射诱导T细胞介导的肝损伤。
猪血清(PS):反复腹腔注射诱导免疫性纤维化。
机制:
T细胞和巨噬细胞浸润,释放IFN-γ、IL-4等细胞因子,激活HSC。
慢性免疫反应导致ECM沉积。
特点:适用于研究自身免疫性肝病。
4. 高脂饮食/代谢模型
方法:高脂饮食(如胆碱缺乏饲料)联合果糖/酒精,诱导非酒精性脂肪性肝炎(NASH)相关纤维化。
机制:
脂毒性导致肝细胞损伤,激活Kupffer细胞释放ROS和TGF-β1。
胰岛素抵抗促进HSC活化。
特点:模拟代谢综合征相关肝纤维化,周期较长(12-24周)。
5. 基因修饰模型
方法:
TGF-β1过表达小鼠:直接激活纤维化通路。
Mdr2⁻/⁻小鼠:胆管发育异常导致自发性纤维化。
机制:靶向调控特定通路(如TGF-β、Wnt/β-catenin)。
特点:特异性强,但成本高,需基因工程技术。
二、核心机制通路及关键蛋白
1. 肝星状细胞(HSC)活化
关键事件:静息HSC(储存维生素A)→ 肌成纤维细胞(分泌ECM)。
调控蛋白:
α-SMA(活化标志物)、PDGFR-β(增殖信号)。
TIMP-1/2(抑制基质降解)。
2. TGF-β/Smad通路
机制:
TGF-β1结合受体(TβRII),磷酸化Smad2/3,与Smad4形成复合物入核,促进胶原(COL1A1/COL3A1)和α-SMA表达。
关键蛋白:TGF-β1、Smad2/3、Smad7(抑制因子)。
3. MAPK/ERK通路
机制:氧化应激或炎症激活ERK、JNK、p38,促进HSC增殖和ECM合成。
关键蛋白:Ras、Raf、MEK、ERK。
4. NF-κB通路
机制:炎症因子(TNF-α、IL-1β)激活NF-κB,促进炎症和HSC存活。
关键蛋白:IκB激酶(IKK)、p65/p50。
5. Wnt/β-catenin通路
机制:Wnt配体结合受体,抑制β-catenin降解,入核后促进纤维化相关基因表达。
关键蛋白:β-catenin、GSK-3β、LRP5/6。
三、临床研究关联
1. 靶向TGF-β通路的药物
临床试验:
Galunisertib(TβRI抑制剂):在肝癌合并纤维化患者中显示一定疗效,但对单纯肝纤维化效果有限。
Fresolimumab(抗TGF-β抗体):因全身性副作用(免疫抑制)终止试验。
2. 抗炎及抗氧化治疗
吡非尼酮:抑制TGF-β和TNF-α,在NASH患者中减少肝纤维化评分(FIB-4)。
维生素E:通过抑制脂质过氧化,改善NASH患者肝组织学(PIVENS试验)。
3. 靶向ECM降解
Simtuzumab(LOXL2抑制剂):在Ⅱ期临床试验中未能显著逆转纤维化。
MMP-9抑制剂:因脱靶效应(如骨代谢异常)开发受阻。
4. 趋化因子靶点
Cenicriviroc(CCR2/CCR5拮抗剂):在NASH患者中降低纤维化评分(CENTAUR试验)。
四、模型选择与临床转化的挑战
模型局限性:
动物模型难以模拟人类疾病的异质性(如代谢、免疫差异)。
大部分药物在动物模型中有效,但临床试验失败率高(如Simtuzumab)。
未来方向:
开发人源化小鼠模型(如移植人肝细胞或免疫细胞)。
多组学整合分析(单细胞测序、空间转录组)揭示跨物种保守通路。
五、总结表格:模型-机制-临床关联
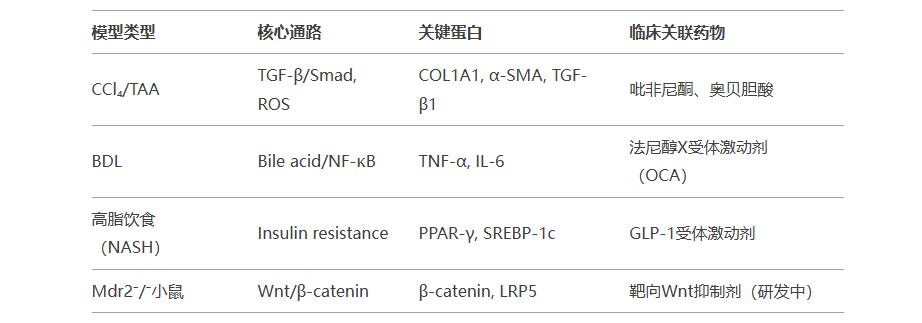
通过深入理解不同模型的分子机制,研究者可更精准地选择模型并设计靶向治疗策略,加速肝纤维化临床转化。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

