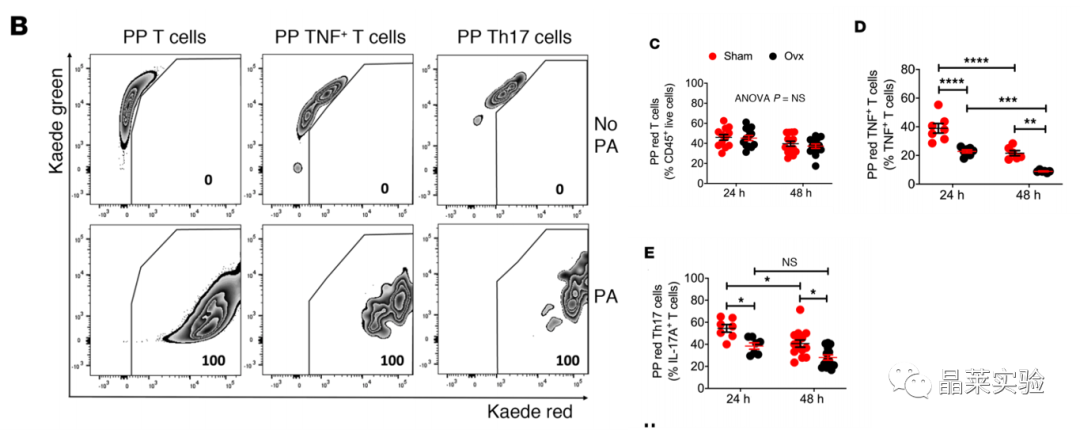
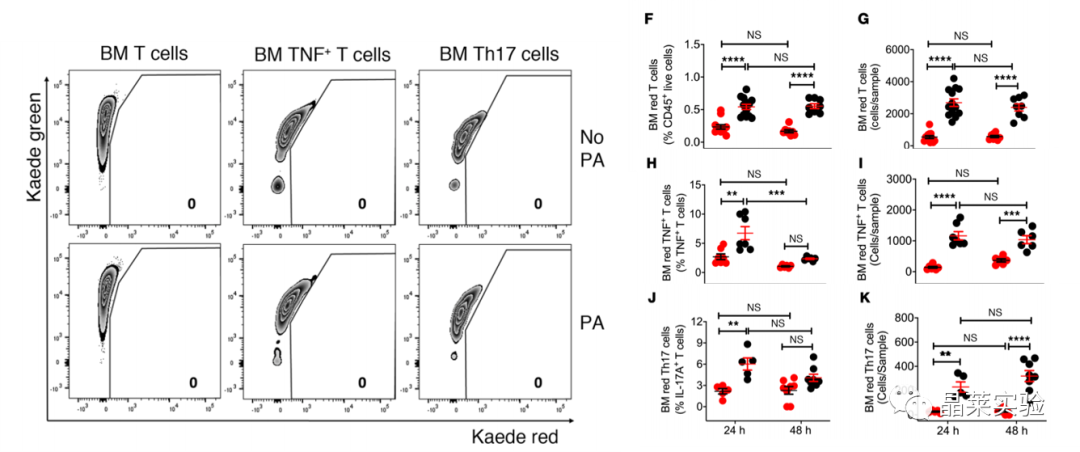
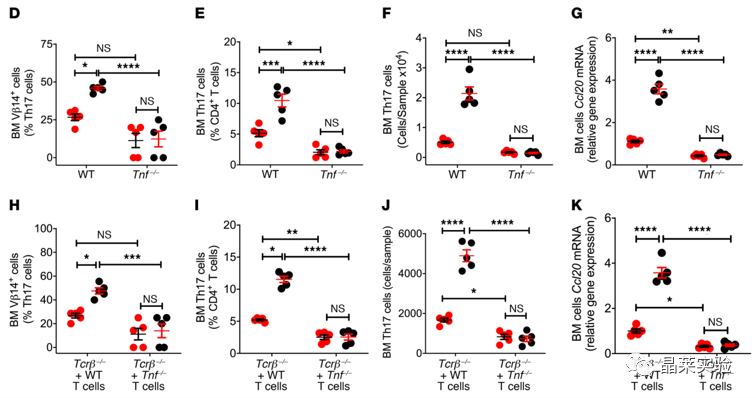
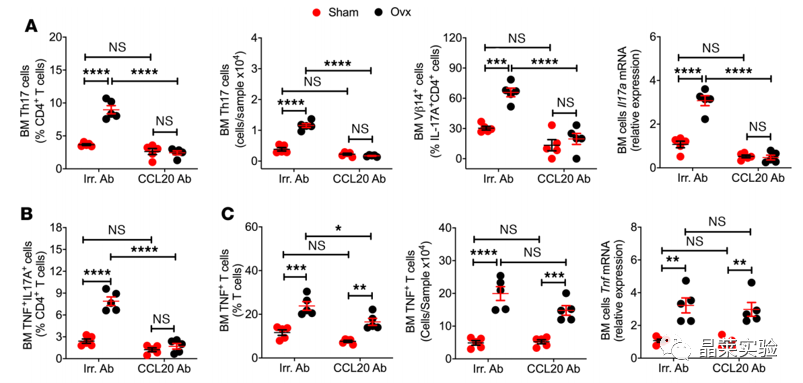
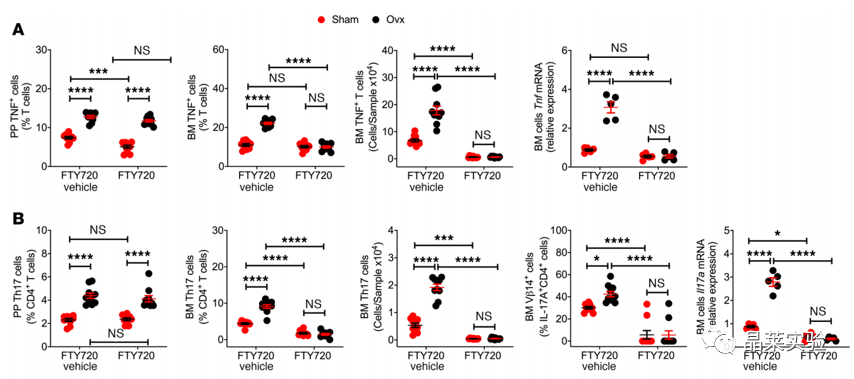
国自然热点通路研究文献之”卵巢去势通过肠道菌群驱动TNF+T细胞和Th17细胞运输诱导骨缺失“
时间:2022-05-05 阅读:2043Ovariectomy induces bone loss via microbialdependent trafficking of intestinal TNF+ T cells and Th17 cells 卵巢去势通过肠道菌群驱动TNF+T细胞和Th17细胞运输诱导骨缺失 期刊:JOURNAL OF CLINICAL INVESTIGATION 影响因子:10.271 发表:2021.02 研究背景 雌激素缺乏骨质疏松症 雌激素缺乏骨质疏松症是一种常见的骨骼疾病,可导致易发骨折。该疾病主要源于卵巢功能的停止,雌激素水平的下降,导致骨吸收的刺激信号产生,影响骨形成,导致一段时间内的快速骨丢失。雌激素消耗的影响可以通过卵巢去势(ovx)来模拟。 骨重塑 骨重塑由成骨和骨吸收稳态维持,雌激素缺乏诱导骨丢失的中心机制是破骨细胞生成和寿命延长。破骨细胞生成主要驱动因素是免疫因子RANKL、TNF和IL-17的产生增加,RANKL拮抗剂骨保护素(OPG) 分泌减少,而RANKL是破骨细胞形成的最终诱导剂。TNF和IL-17在ovx诱导的骨丢失中的作用已在多种模型中得到证实。 肠道菌群与Th17细胞 Th17细胞主要产生并驻留在肠道固有层中,它的形成依赖于分节丝状菌(SFB) 的存在,SFB可有效诱导Th17细胞的分化。人体中,已知约有20株无毒的肠道菌株可诱导Th17细胞分化。前期已有研究基础,固醇类性激素可增加小鼠肠道通透性,促进微生物成分激活T细胞,且无菌小鼠可减少固醇类性激素剥夺引起的骨丢失,表明肠道菌群可能驱动了经过ovx的小鼠的T细胞激活与分化。 技术路线 研究结果及分析 1.1 体外光转化效率验证,排除组织特异性表达 1.2 Ovx 增加了 T 细胞从小肠到 BM 的运输 1.3 Ovx 增加了 T 细胞从小肠到 BM 的运输 这些数据表明ovx促进肠道总T细胞,TNF T细胞和Th17细胞从肠道组织迁移到BM。在48小时时,KaedeR TNF T细胞和Th17细胞的绝对增加可能进一步表明,额外的细胞群可能在48小时时在BM中积累。 2.1 Ovx通过TNF依赖性机制增加TH17数目并促进向BM转移 2.2 Ovx通过TNF依赖性机制增加TH17数目并促进向BM转移 所有数据均根据夏皮罗-威尔克正态性检验呈正态分布,并通过双因子方差分析和应用邦费罗尼校正进行多重比较的事后检验进行分析。 发现表明,T细胞产生TNF是ovx扩增Th17细胞和上调BM细胞CCL20表达所必需的。Ovx通过TNF依赖性机制增加BM Th17细胞对BM的营养。 3.1 CCL20 Ab处理假手术/ovx 后PP、BM中TNF+T细胞、TH17变化 3.2 CCL20 Ab处理假手术/ovx 后PP、BM中TNF+T细胞、TH17变化 (A)ovx对BM Th17细胞和Vβ14 Th17细胞的频率以及Il17a转录本水平的影响。 (B)ovx对BM TNFIL-17 T细胞频率的影响。 (C)ovx对BM TNF T细胞数量和Tnf转录本水平的影响。 (D)ovx对股骨BV/TV、Tb.Th、Tb.N和Tb.Sp.的影响。 (E) ovx对脊柱BV/TV、Tb.Th、Tb.N和Tb.Sp的影响。 (F)ovx对血清CTX水平和血清骨钙素水平的影响。 (G)ovx对股 Ct.Ar 和 Ct.Th 的影响,小鼠用抗CCL20 Ab或不相关 通过抗CCL20 Ab处理阻断Th17细胞流入BM,可防止Th17细胞的扩增和ovx诱导的骨质流失。 4.1 CCL20 Ab处理假手术/ovx 后PP、BM中TNF+T细胞、TH17变化 4.2 CT扫描股骨和椎骨小梁体积/总体积分数 (A)ovx对用FTY720处理的小鼠的PP和BM TNF T细胞数量以及Tnf转录本水平的影响。 (B)ovx对用FTY720处理的小鼠的PP和BM Th17细胞数量以及Il17a转录本水平的影响。 (C)ovx对FTY720处理小鼠BV /TV,Tb.Th,Tb.N和Tb.Sp的影响。 (D)ovx对FTY720处理小鼠脊柱BV / TV,Tb.Th,Tb.N和Tb.Sp的影响。 阻断T细胞从肠道流出可防止TNF T细胞和Th17细胞的扩增以及ovx诱导的骨质流失。 文献总结 验证了ovx 诱导的骨丢失有关的 TNF + T 细胞和 Th17 细胞起源于肠道,通过 S1PR1 依赖性机制排出肠道,然后转移到 BM。 阐明了TNF + T 细胞转移至 BM 由趋化因子受体 CXCR3 驱动的机制,TNF + T 细胞转移至 BM 是由趋化因子受体 CXCR3 驱动,BM 基质细胞高度表达CXCL9、CXCL10 和 CXCL11,CXCR3 可与这些配体结合并驱动T细胞转移。 不能完全排除肠道中产生的细胞因子可能通过体循环到达 BM 并导致雌激素缺乏引起的骨质流失的可能性。 综述,肠道T细胞是与小梁骨质流失相关的性类固醇缺乏症的近端靶标。阻断TNF T细胞或Th17细胞肠道出口或阻断其在BM中的流入可防止ovx诱导的骨质流失的观察结果为T细胞运输的药理调节可能代表绝经后骨质流失的治疗策略提供了原理证明。 文献使用的实验技术 关于晶莱 晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台,(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),拥有数十名硕博研究生团队及上千种生物资源库。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型。 晶莱生物目前与300+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。