国自然热点文献解读之“膳食omega-3 PUFA改善了缺血诱导小鼠急性肾损伤后的肾小管功能,但不能减轻肾功能损害”
时间:2022-04-20 阅读:2049Dietary omega-3 PUFA improved tubular function after ischemia induced acute kidney injury in mice but did not attenuate impairment of renal function
膳食omega-3 PUFA改善了缺血诱导小鼠急性肾损伤后的肾小管功能,但不能减轻肾功能损害
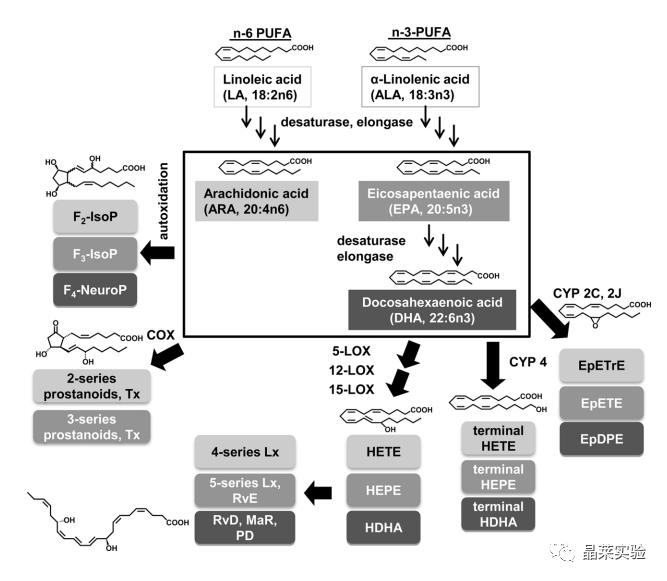
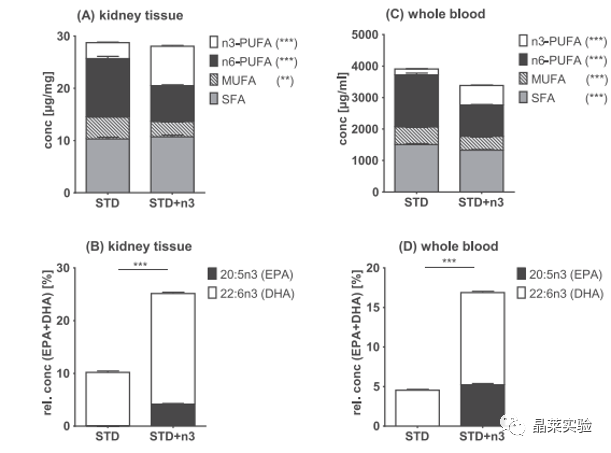
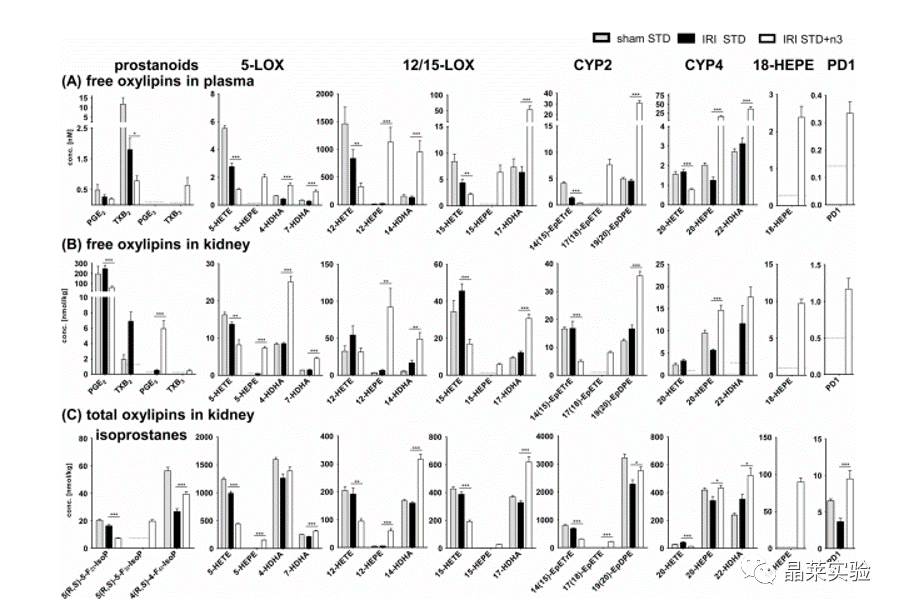
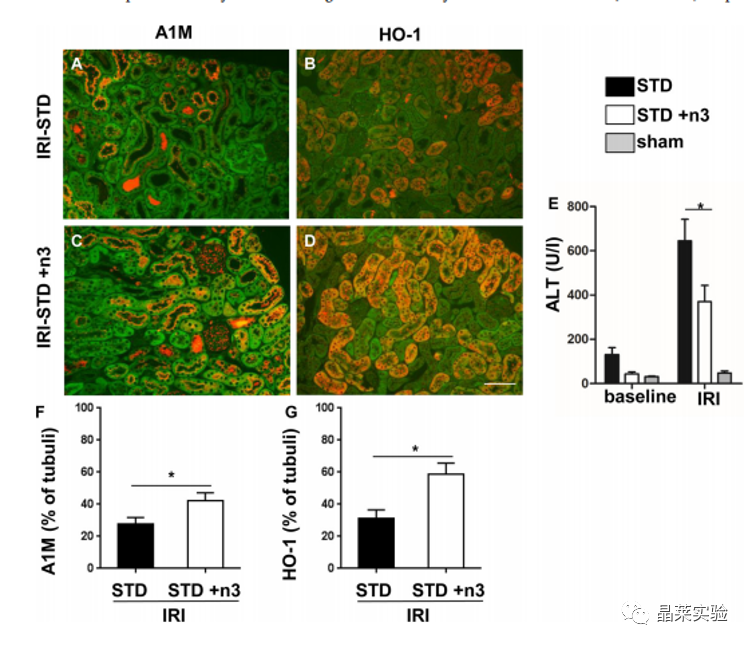
期刊名:Prostaglandins & Other Lipid Mediators; 2021年影响因子:5.093 研究背景与意义 1、急性肾损伤(Acute kidney injury,AKI)是大手术(如心脏手术、实体器官移植以及创伤手术)的重要并发症。AKI 的发作会增加患者的发病率和死亡率,其特征是血清肌酐升高/或降低肾小球滤过率(GFR)。 2、研究表明,AKI不仅是一种急性事件,而且还增加了慢性肾脏疾病(CKD)的风险。即使血清肌酐升高在AKI后不久恢复到正常水平,也有相当一部分患者会发展为CKD,甚至会进入终末期肾脏疾病, 需要肾脏替代治疗。 3、由低血压、大出血和缺氧引起的肾缺血再灌注损伤(IRI)会引起肾内血管收缩,激活促氧化机制、促炎细胞因子的释放和随后的白细胞侵袭。AKI的严重程度与长期预后和CKD的进展相关。即使在心脏瓣膜置换术等常规手术中,也缺乏预防或减轻AKI的既定策略 。一些研究讨论了omega-3多不饱和脂肪酸(n3PUFA)在肾脏疾病中的有益作用。对于预防心血管疾病,n3-PUFA的营养状况是一个公认的危险因素 。通常是由红细胞中EPA和DHA的相对含量决定,n3-PUFA的掺入量越高,心血管疾病和死亡的风险就越低。 4、在一些实验性的AKI模型中,n3-PUFA的使用与肾功能的改善相关。 5、n3-PUFA有益作用的分子机制:例如与离子通道或转录因子结合,例如NFκB 或 PPARγ,从而分别降低促炎基因的表达和激活抗炎基因的表达。作为膜的成分,例如主要在磷脂中,n3-PUFA 也影响膜结构和流动性。n3-PUFA 的生理效应的相关部分是由它们的含氧产物介导的,即类花生酸和其他oxylipins 在所谓的花生四烯酸 (ARA) 级联中,多不饱和脂肪酸作为酶促和非酶促转化的底物,产生大量来自 n6-和 n3-PUFA 的脂质介质。 研究意义:本文提出了一项膳食 omega-3 多不饱和脂肪酸 (n3-PUFA) 补充研究,以研究预处理是否可以减少小鼠缺血诱导的 AKI。 研究思路 在小鼠中使用了一个特征良好的缺血诱导 AKI 模型 ;研究膳食 n3-PUFA(EPA 和 DHA)补充剂的效果 - 基于富含亚油酸的类西方饮食;手术前 14 天 - 与缺血再灌注损伤后 24 小时的肾损伤和炎症相比,血液和肾组织中的脂肪酸组成和氧脂模式。 技术路线 研究内容 研究方法: 12-14 周龄雄性 C57BL/6 J 小鼠接受富含亚油酸的葵花油标准饮食:含有 10% 脂肪 (STD) 或富含 n3-PUFA(含有 1% EPA 和 1% DHA)的相同饮食(STD + n3)。喂养14天后,进行双侧30分钟肾缺血再灌注损伤(IRI)以诱导AKI,并过深度全身麻醉和冰冷的 PBS 进行全身灌注;在24小时处死小鼠。(先预处理;再造模;研究 n3-PUFA保护作用机制) 1、动物喂养实验;动物分组:n=8; 2、肾缺血再灌注损伤实验(IRI);动物分组:n=8; 4、检测内容: (1)测量血清肌酐和血尿素氮(BUN)以及肝酶升高情况。 (2)通过组织学和免疫组织化学分析肾损伤:PAS(过碘酸-希夫)染色+IHC;半定量分级系统进行AKI评分; (3)通过 qPCR 测定促炎细胞因子(IL-6、MCP-1)。 (4)分别通过 GC-FID 和 LC-MS/MS 对血液和肾脏中的脂肪酸 FA 和 氧化脂质oxylipin 模式进行定量。 研究结果及分析 1. 血液和肾组织的脂肪酸及其氧化代谢物变化 小鼠肾脏IRI后24小时(A)肾组织和(C)全血中的脂肪酸组成向更高水平的n3-PUFA转移,而STD+ n3组的n6-PUFA后反而减少; (STD + n3)与没有EPA和DHA(STD)的相同饮食相比; 在STD+ n3饮食的小鼠中,在(B)肾组织和(D)全血中检测到的所有FA的EPA和DHA的相对水平一致地显着更高。 游离氧脂素在(A)血浆和(B)肾组织中以及(C)肾总氧脂类总量中的浓度,即肾组织中游离和酯化的羟脂蛋白。 显示的是ARA,EPA和DHA的选定(异)前列腺素,5-LOX,12/15-LOX,CYP4和CYP2产物以及18-HEPE和PD1的浓度。除假组外,所有模式均在STD + n3饮食的肾脏IRI后24小时在小鼠中确定。 STD + n3饮食的喂养导致EPA和DHA衍生的脂质介质增加,而ARA衍生的羟脂蛋白减少。 2.肾功能、肾形态和炎症 尽管成功补充n3-PUFA显示PUFA和氧脂素模式的改变,但两组的肾功能损害是相似的。IRI导致血清肌酐升高6倍(图4 I ) .; 根据肾功能恶化,两组通过AKI评分测量的肾损害相似(图4 A , D , G ) . 此外,两组中Gr-1阳性的中性粒细胞浸润均表现为中度至重度的白细胞浸润(图4 B , E , H ) . 在mrna水平上,两组患者的促炎细胞因子IL-6和MCP-1均有所升高。 与STD组 相比,STD+3组甚至表现出更高的趋势。(4C, F). 3. 肾小管功能和血红素加氧酶-1表达 α-1微球蛋白(A1M)在肝脏中合成,由肾小球过滤并被近端小管重新吸收。在健康的肾脏中,A1M存在于60-70%的肾小管细胞质中的囊泡中。AKI时,小管的能量代谢崩溃和运输功能受损,导致细胞质浓度降低A1M 。由于IRI,A1M在STD+n3组中表达降低,但显著升高,表明肾小管稳态和能量 代谢有更好的保存(图5A, C, F)。 血红素加氧酶-1(HO-1)是一种肾保护酶,在AKI后上调并介导愈合。HO-1表达在STD + n3喂养的小鼠(图 5B, D, G)。IRI后由于器官损伤导致肝酶升高 。与STD饮食相比,STD+n3处理引起的肝酶升高较少 。总的来说, 我们观察到STD+n3饮食在肾脏IRI中的一些保护作用。 文献结论 在本研究中,用长链 n3-PUFA EPA 和 DHA 补充西式饮食,即富含亚油酸的饮食,导致 PUFA 和 oxylipin 模式的显着调节。然而,在中度 AKI 小鼠模型中,预先喂食 n3-PUFA 并未减轻肾功能损害、形态学肾损伤和以促炎细胞因子(IL-6 和 MCP-1)mRNA 上调和中性粒细胞浸润为特征的炎症。然而;也观察到有益效果,例如通过增强皮质近端肾小管上皮细胞中的 α-1 微球蛋白 (A1M) 表达和增强肾小管血红素加氧酶-1 (HO-1) 表达的上调来维持肾小管转运功能;与改善肾再生有关。因此,补充 n3-PUFA 可能会导致肾脏对长期损害的保护。 总体而言,得出的结论是:尽管内源性 n3-PUFA 和 n3-PUFA 衍生的氧化脂水平最大升高——在该模型中,n3-PUFA 补充并未导致肾功能损害或急性肾损伤在 24 小时内减轻。 关于晶莱生物 晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台,(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),拥有数十名硕博研究生团队及上千种生物资源库。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型。 晶莱生物目前与300+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。