【五分钟讲实验】Western blot实验六大问题提逐一解读,新手也能避坑!
时间:2026-01-13 阅读:181
WesternBlot实验的是通过聚丙烯酰胺凝胶电泳(SDS-PAGE)将蛋白质样品按分子量大小分离,将分离的蛋白质转移到固相膜(如NC膜或PVDF膜)上。转移后的蛋白质在膜上以非共价键形式固定,保持其生物学活性并通过与特异性抗体的结合,以达到检测目的蛋白的技术。
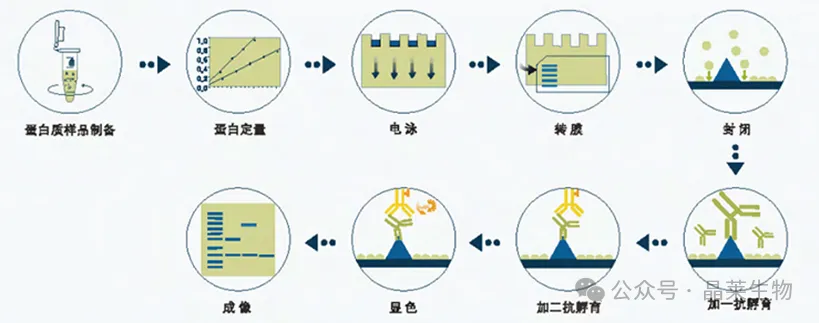
WB实验涉及步骤繁杂、周期偏长,各环节操作均与最终结果紧密相关,极易因细节疏漏引发问题,所以要避开实操中的“雷区”。
下面整理了6个最常见的失败案例,每个案例都帮你找清原因、给出解决办法。
案例1:完全没有条带,目标蛋白“消失不见”

1. 可能原因:
①样品制备失败,蛋白降解或未提取出来;
②上样量不足;
③一抗浓度过高、失效(如反复冻融、保存不当)或一抗与目标蛋白不匹配;
④转膜不充分,蛋白没转移到膜上;
⑤显色底物失效;
⑥封闭不完全。
2. 解决方案:
①重新制备样品,全程加抑制剂,低温操作;
②增加上样量(可根据定量结果调整);
③检查一抗保质期和稀释比例,用阳性对照验证一抗有效性;
④延长转膜时间(大分子蛋白)或提高转膜电流,转膜后用丽春红染色验证;
⑤更换新的显色底物,按说明书要求操作;
⑥加长封闭时间或更换封闭液。
案例2:条带模糊不清,像“蒙了一层雾”

1. 可能原因:
①凝胶浓度不合适,蛋白分离不彻底;
②上样量过多,蛋白过载;
③一抗浓度过高,非特异性结合增加;
④洗膜不充分,残留抗体导致背景干扰;
⑤转膜时蛋白扩散。
2. 解决方案:
①根据目标蛋白分子量调整凝胶浓度;
②减少上样量,保证条带清晰不重叠;
③降低一抗浓度,延长孵育时间(如4℃孵育过夜);
④增加洗膜次数(每次5-10分钟,共3-5次),确保残留抗体洗净;
⑤转膜时保持低温,缩短转膜时间(避免过度转膜)。
案例3:出现黑色杂斑
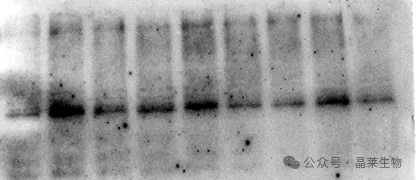
1. 可能原因:
①封闭液溶解不完全或存放时间过长,结块残留在膜;
②一抗二抗产生非特异性结合;
③样本表达过低,曝光时间长。
2. 解决方案:
①可过滤封闭液或更换封闭液;
②更换一抗或优化抗体浓度与孵育条件、匹配二抗种属亚型减少二抗孵育时间、强化封闭洗涤流程;
③提高上样量、优化抗体孵育条件增强信号。
案例4:条带出现拖尾,像“彗星”一样
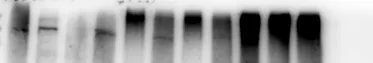
1. 可能原因:
①样品中盐浓度过高,影响电泳效果;
②蛋白发生聚合或降解;
③上样孔有残留样品,导致蛋白扩散;
④凝胶凝固不均匀。
2. 解决方案:
①对样品进行脱盐处理,或减少上样体积;
②重新制备样品,加入新鲜的抑制剂,避免反复冻融;
③上样前清理上样孔,确保样品完全进入凝胶;
④配制凝胶时充分混匀,避免气泡,确保凝固均匀。
案例5:条带两侧深中间浅
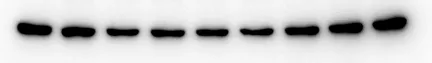
1. 可能原因:
①电泳槽缓冲液液面未完全没过凝胶、电泳时电压过高、电极丝与凝胶接触不均导致边缘泳道的电场强度高于中间泳道;
②配胶时搅拌不均APS/TEMED 加入后未及时混匀、凝胶在室温聚合时边缘先凝固;
③抗体孵育液面未能覆盖膜的正反面;
④三明治结构(海绵-滤纸-凝胶-膜-滤纸-海绵)边缘的压力大于中间,导致边缘蛋白转膜效率更高,条带更深。
2. 决方案:
①保证缓冲液液面高于凝胶至少1cm;降低电泳电压,检查电极丝是否清洁且与凝胶边缘平行接触;
②配胶时轻柔上下颠倒混匀,避免剧烈搅拌产生气泡,APS和TEMED 现配现用,加入后快速混匀并灌胶;
③确保孵育时抗体液完全覆盖膜的正反面,且液面高度超过膜边缘 1-2cm;
④在三明治结构中可减少一侧的海绵,防止边缘的压力大于中间影响转膜。
案例6:条带出现双带或多带
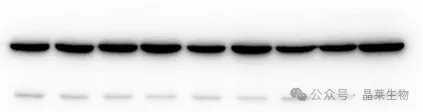
1. 可能原因:
①一抗特异性差,与样品中其他蛋白交叉反应;
②目标蛋白存在不同的剪切体或异构体;
③样品中存在蛋白二聚体或多聚体;
④一抗浓度过高。
2. 解决方案:
①更换特异性更高的一抗,或用阳性对照验证;
②查阅文献,确认目标蛋白是否存在剪切体/异构体;
③样品制备时加入还原剂(如β-巯基乙醇、DTT),破坏二硫键,避免蛋白聚合;
④降低一抗浓度,优化孵育条件。
WB实验小技巧,提升成功率!
1. 做好对照:每次实验设置阳性对照(已知含目标蛋白的样品)和阴性对照(不含目标蛋白的样品),方便判断实验结果的可靠性。
2. 标记清晰:凝胶、膜的正反面要做好标记,避免转膜、孵育时方向出错。
3. 试剂保存:一抗、二抗、显色底物等关键试剂需按要求低温保存,避免反复冻融,影响活性。
4. 耐心洗膜:洗膜是减少背景的关键,不要图快,确保每次洗膜充分。
关于晶莱















