【五分钟讲实验】心血管疾病动物模型系统讲解分析!
时间:2024-07-30 阅读:1086
心血管疾病(CVD)是一类涉及心脏或血管的疾病。CVD包括冠心病(CAD),例如心绞痛和心肌梗塞(通常称为心脏病发作)、中风、心力衰竭、高血压心脏病、风湿性心脏病、心肌病、异常心律、先天性心脏病、瓣膜性心脏病、心脏炎、主动脉瘤、外周动脉疾病、血栓栓塞性疾病、静脉血栓形成和肺栓塞等。
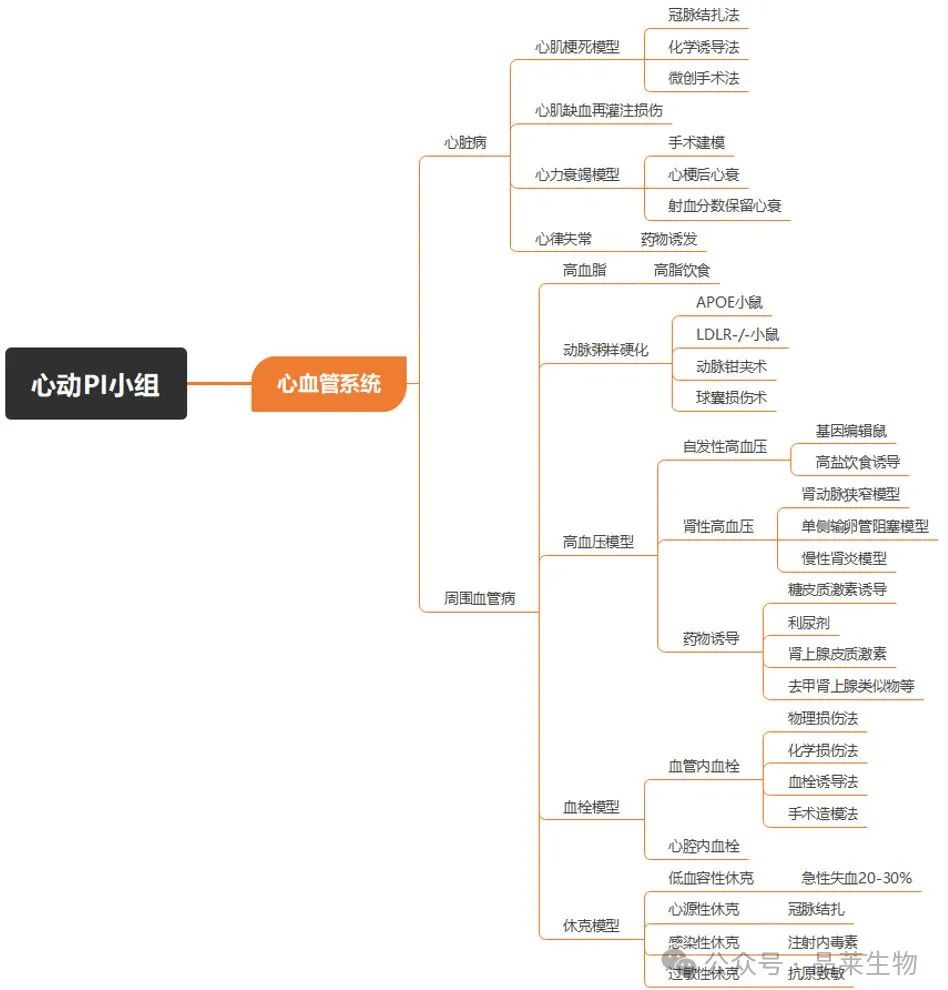
心脏相关动物模型
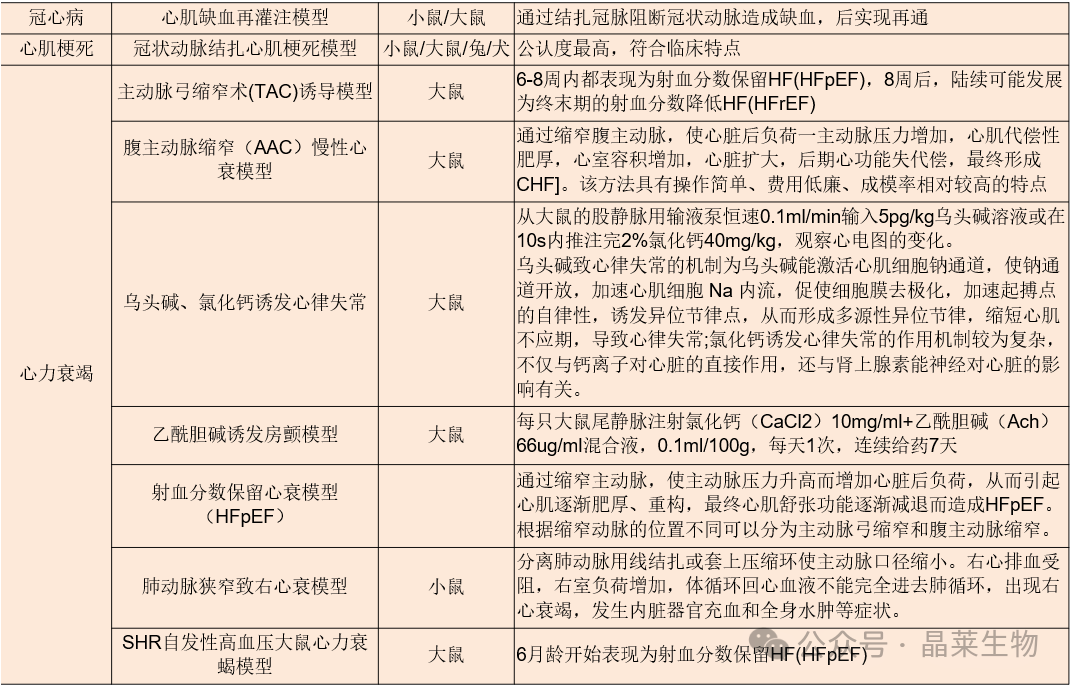
血管相关动物模型
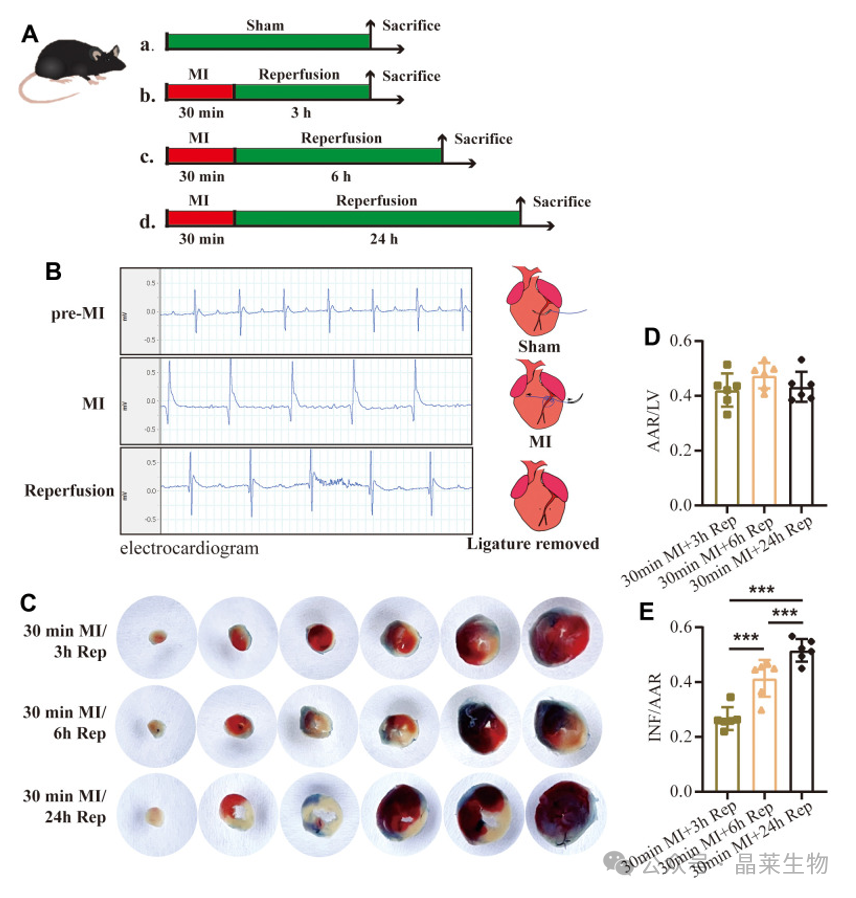
1. 心肌缺血再灌注模型
① 将小鼠麻醉后,仰卧固定在实验台上,去除小鼠胸部毛发;
② 术区消毒,沿小鼠左侧胸肌轮廓边缘做一条1cm切口,切开皮肤;
③ 镊子沿小鼠肌肉走向分开肌肉,暴露第3-5肋;
④ 用止血钳从肋间肌刺破,分开肋骨,同时左手轻捏,挤出心脏;
⑤ 在冠状动脉左前降支处垫一软管,结扎血管时将软管一并扎起;
⑥ 结扎完毕后将心脏还纳胸腔,软管露出胸腔外,依次缝合肌肉和皮肤,创口消毒;
⑦ 结扎45min后抽出软管,心脏再灌。
2. TAC模型
① 将小鼠麻醉后,仰卧,头朝术者固定,将小鼠脖子到第二肋骨区域脱毛,涂抹碘伏消毒;
② 沿正中剪开皮肤,分开颈部肌肉,暴露气管,将锁骨中间剪开,用拉钩将两侧拉开;
③ 拉开肌肉后可见胸腺,用镊子小心分开,暴露主动脉弓;
④ 将结扎线穿过左右颈总动脉间主动脉,结扎,结扎时垫28G针头,打结后抽出针头,造成狭窄;
⑤ 逐层缝合,伤口消毒。

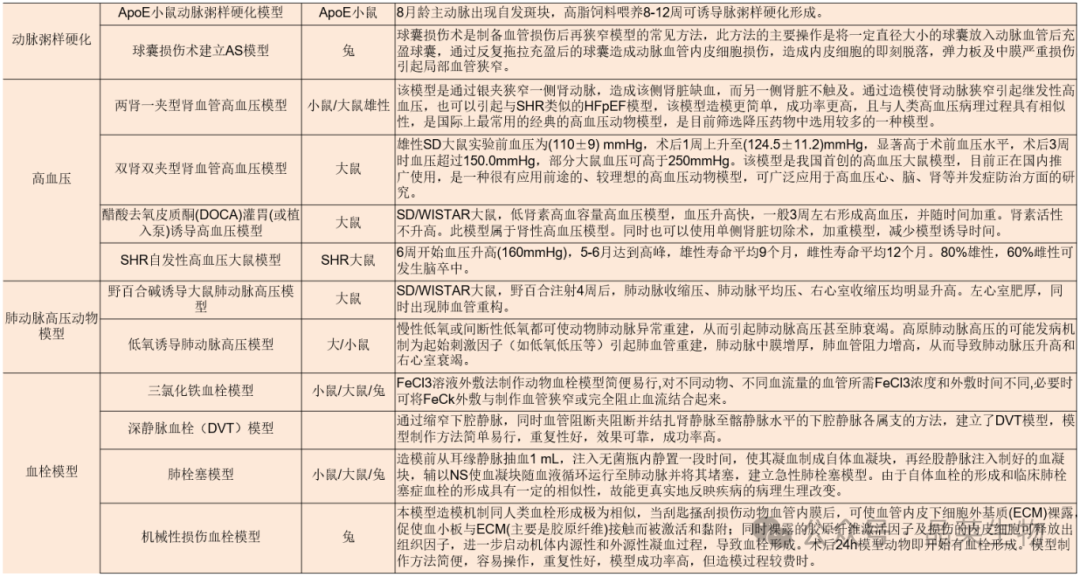
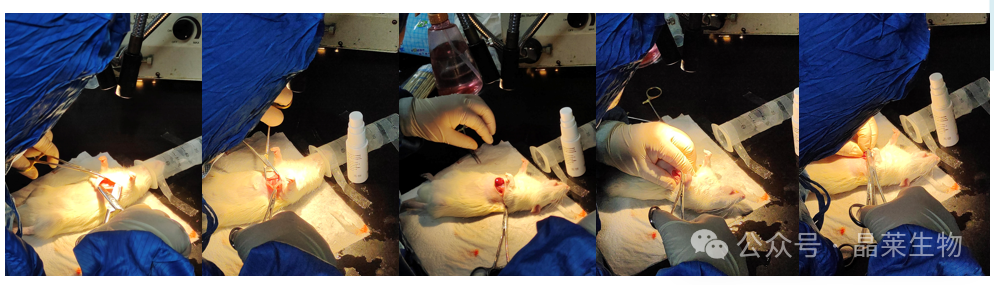
3. 心梗模型
动物仰卧位(右侧卧位为佳)固定左胸前手术区域剔除鼠毛并消毒。距胸骨左缘约1~2 mm 皮肤处做长约1cm纵向切口,切口处行垂直外翻褥式缝合预留缝线。逐层钝性分离胸壁肌肉,从第 3 或第4 肋间隙快速进入胸腔,用止血钳撑开肋间隙,配合心脏跳动左手轻轻挤压使心脏从孔隙中弹出。在左心耳下缘1~2mm、肺动脉圆锥旁05 mm处以7-0带线缝合针穿过冠状动脉前降支将其结扎,松紧适宜,控制进针深度(以隐约可见细针为宜)和行针宽度(2mm左右)。
由于不借助通气装置,要求开胸时间不要超过30s,结扎操作尽量控制在 10s 左右完成。结扎完成后轻柔地将心脏送回胸腔,挤压胸腔排出空气同时收紧结扎切口处预留缝线完成手术。术中逐步调整麻药浓度至零,取下面罩后置于恒温垫上约3~5min 即可复苏。
心电图或心超检测心功能
① 心电图判断:心肌梗死会导致心电图出现特定的异常波形,如 ST 段抬高、T波倒置等。
② 超声判断:在心肌梗死模型中,超声心动图通常显示心脏扩大、心肌变薄、心肌收缩功能下降等。
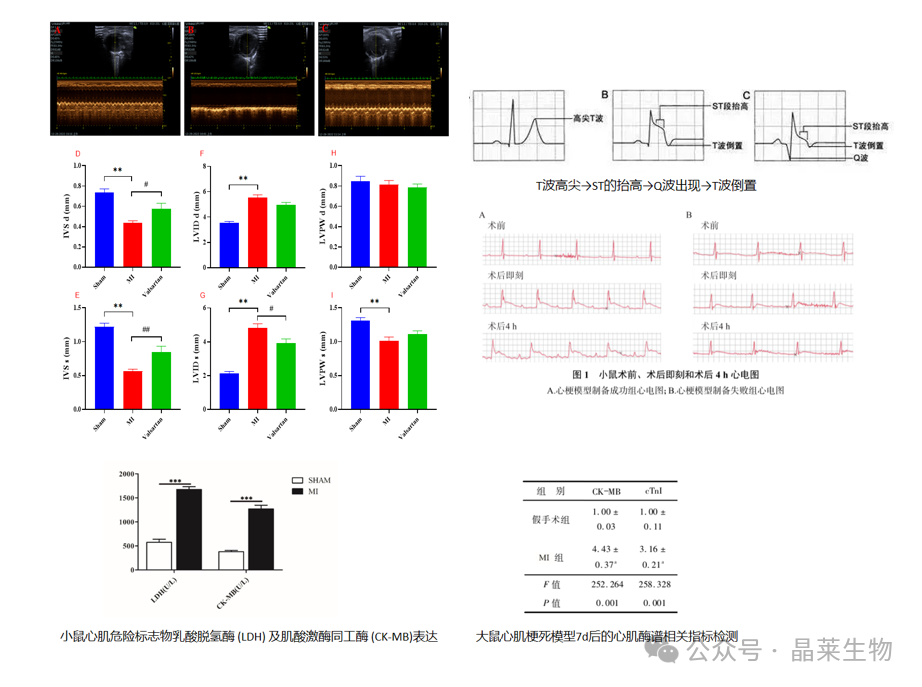
心肌酶谱等指标检测评估心功能
肌红蛋白、肌钙蛋白及肌酸激酶同工酶;脑利钠肽等。
① 肌红蛋白:最早期反映心脏坏死的变化。
② 肌钙蛋白:特异性最高,是反映特异性的心肌损伤的指标,往往在心肌梗塞4-6个小时之后升高,24小时达到高峰,它持续时间比较久,在心肌梗塞之后7-10天才会逐渐消失。
③ 肌酸激酶同工酶:对判断再梗它的效果可能优于肌钙蛋白。
④ 脑利钠肽:心衰定量标志物,不仅反映左室收缩功能障碍,也反映左室舒张功能障碍、瓣膜功能障碍和右室功能障碍情况。
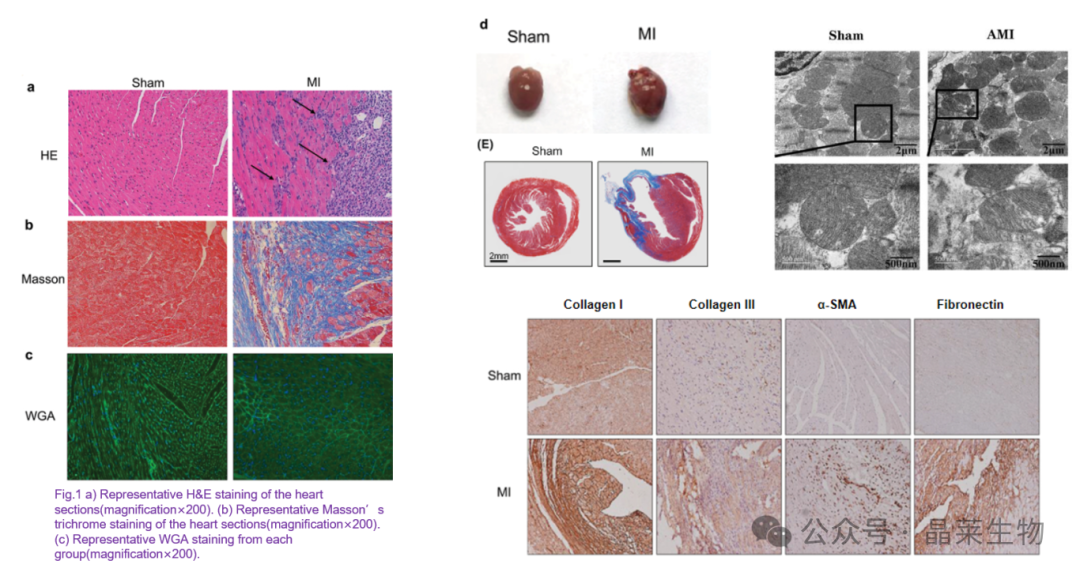
TTC染色和其他病理染色
1. FeCl3诱导血栓模型
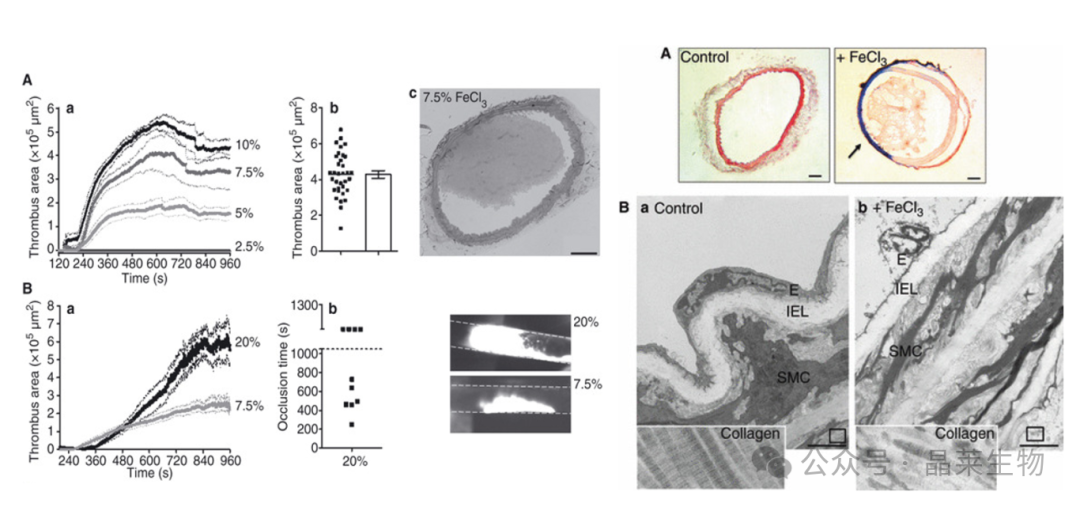
动物麻醉后,暴露颈动脉,将7.5%的FeCl3置于左颈动脉顶部2分钟或将20%的FeCl3 置于血管侧面5分钟(可实现血栓形成可视化)。对干肠系膜动脉,用10%FeCl3饱和的滤纸局部涂敷30s,可实时监测血栓形成情况。
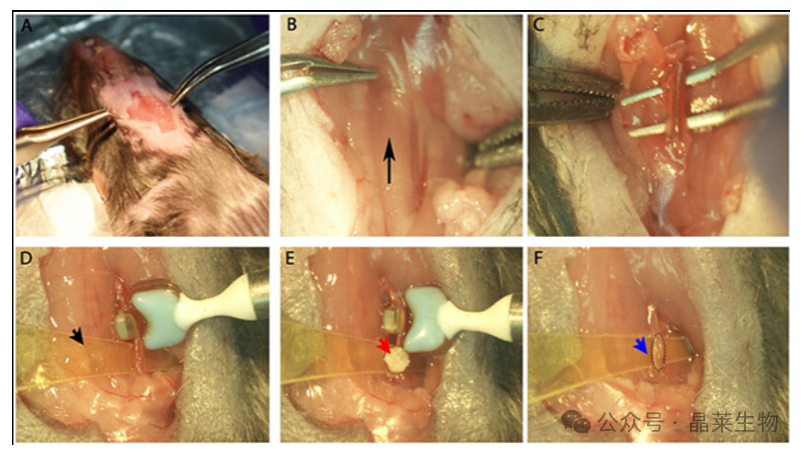
FeCl3诱导的颈动脉损伤的步骤,以测量血管闭塞。(A)用剪刀和手术钳切开中线,轻轻拉开组织,露出颈动脉(B)下方。黑色箭头表示血流方向(B)。清洁环绕颈动脉(C)的周围组织,放置塑料纸(黄色塑料用黑色箭头表示)和探针(D)。通过放置浸过FeCl3的滤纸(红色箭头所示)来进行FeCl3损伤(E)在动脉上取出纸片,观察伤口,未端可见由蓝色箭头(F)表示的血栓。
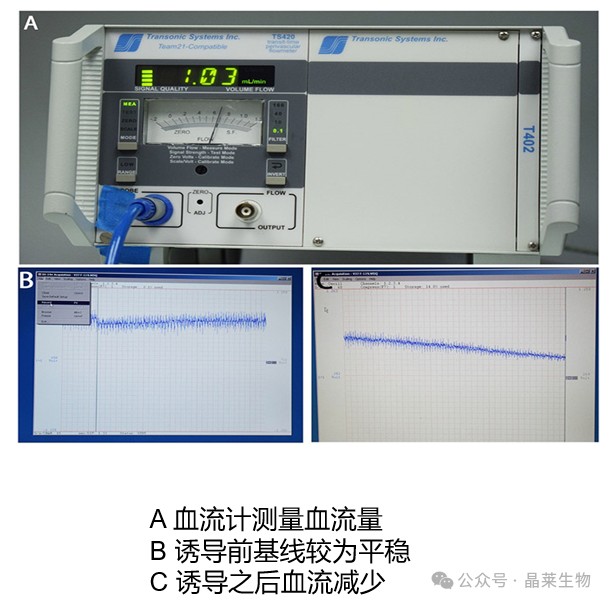
评价指标
① 影像学:彩色多普勒超声、CT静脉成像、核磁静脉成像等。
② 血栓:血栓形态、大小、干重及湿重测定。
③ 凝血四项检测:动脉血APTT、TT、PT、FIB测定。
④ 组织因子:下腔静脉组织组织因子(TF)的表达。 5.病理切片:血栓血管的HE染色等。
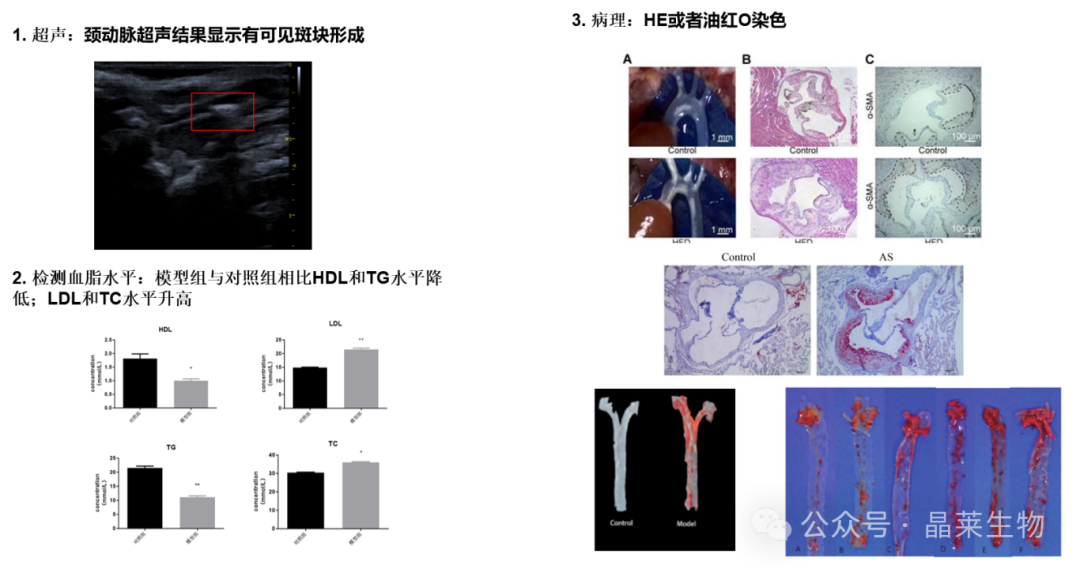
2. 动脉粥样硬化模型
动脉粥样硬化的动物模型是基于由于富含胆固醇/西式饮食、胆固醇代谢相关基因的操纵和动脉粥样硬化额外危险因素的引入而加速斑块形成,主要使用小鼠和兔子模型,其次是猪和非人灵长类动物。
① Apoe敲除小鼠喂食高脂饲料后,能加快动脉粥样硬化的进程,一般需8-12周,可形成明显斑块。如需缩短造模周期,可复合颈动脉结扎,周期可缩短至4周左右。
② 兔一般选择球囊损伤+高脂饲养的方式造模,周期大概6周左右。
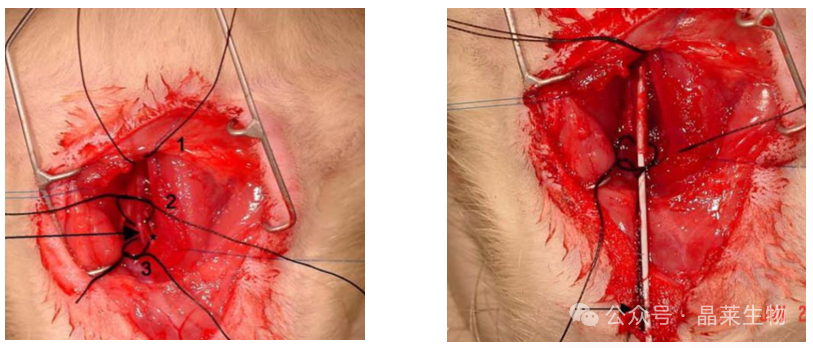
颈部腹侧手术部位照片和球囊损伤期间大鼠左颈动脉血管系统的照片。
图中显示了插入颈外动脉动脉切开术切口上的球囊导管的远端,一段缝线缠绕在导管上,箭头指示导管上球囊尖端的第一黑色带。在损伤和移除球囊导管后结扎。
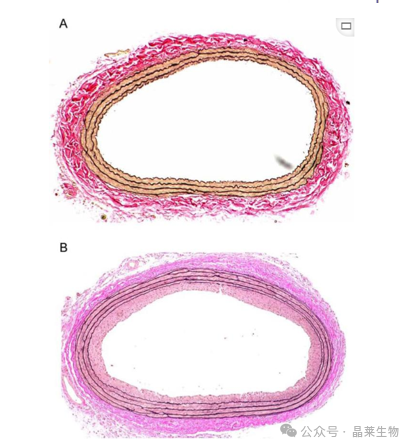
大鼠未损伤(A)或球囊损伤(B)颈动脉的截面光镜照片经Verhoeff的弹性蛋白染色和Van Gieson复染处理。损伤的动脉在损伤后2周显示新内膜增生,管腔狭窄。
模型评价
3. 肾静脉血栓模型
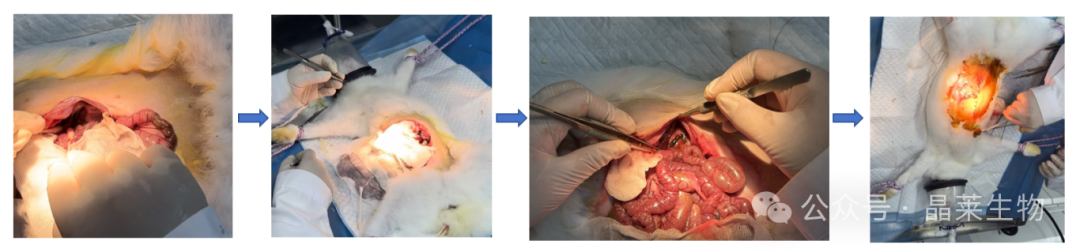
① 麻醉兔子后,剃毛除腹部毛发。
② 沿腹白线切开,沿腹部正中线切开进入腹腔,将肠等组织用生理盐水纱布包裹保护后推置右侧,暴露左肾静脉。
③ 于左肾静脉下方用粗丝线结扎肾静脉,再将吸有 9%三氯化铁溶液的棉球包裹在此段肾静脉上计时3分钟取下。
④ 继续结扎肾静脉血管30分钟,观察血栓是否形成,形成后去除粗丝线。
⑤ 将肠等组织放回腹部,然后进行缝合。
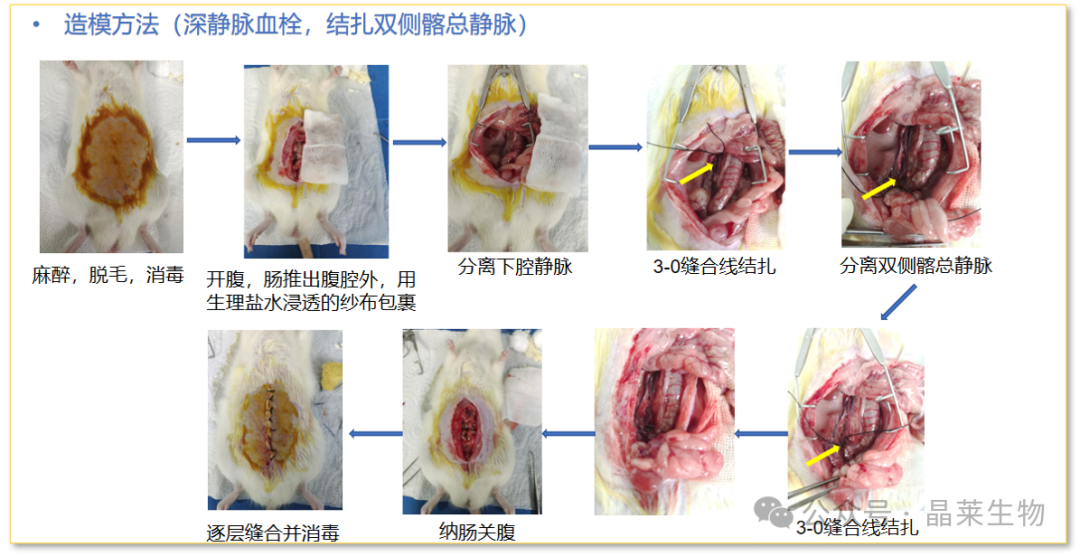
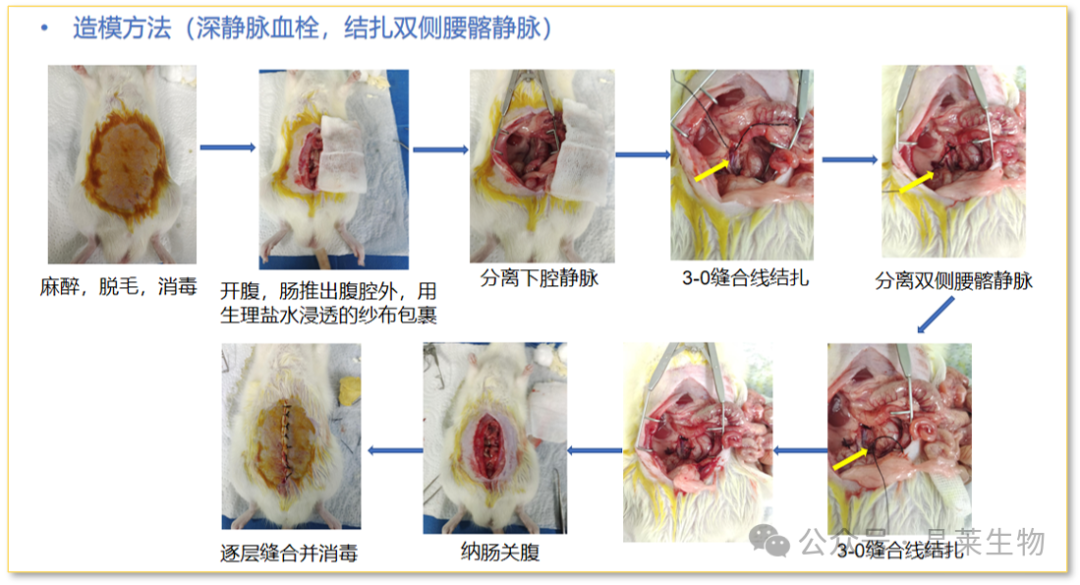
评价指标

① 大体观察:术后动物下肢情况、日常生活能力以及精神状态。
② 血栓:血栓形态、大小、干重及湿重测定。
③ 凝血四项检测:动脉血APTT、TT、PT、FIB测定。
④ 组织因子:下腔静脉组织组织因子(TF)的表达。
⑤ 影像学:彩色多普勒超声、CT静脉成像、核磁静脉成像等。
⑥ 病理切片:血栓血管的HE染色。
其他应用:
1. 生物材料:开发新的生物材料用于心脏修复,如用于支架、瓣膜置换和心肌组织再生的材料。
2. 组织工程:通过组织工程方法培养人工心脏组织,以解决心脏瓣膜疾病、心肌梗死和先天性心脏病等问题。
3. 基因编辑:利用CRISPR-Cas9等基因编辑技术治疗遗传性心血管疾病,包括镰状细胞贫血、家族性肥,厚型心肌病等。
4. 人工智能和机器学习:应用人工智能算法来分析大量的医疗数据,包括影像学基因组学和临床数据,以预测疾病风险、个性化治疗方案和监测治疗效果。
参考文献:
1.Weinheimer CJ, Lai L, Kelly DP, Kovacs A. Novel mouse model of left ventricular pressure overload and infarction causing predictable ventricular remodelling and progression to heart failure. Clin Exp Pharmacol Physiol. 2015 Jan;42(1):33-40. doi: 10.1111/1440-1681.12318. PMID: 25311547; PMCID: PMC4524882.
2.Kumar M, Kasala ER, Bodduluru LN, Dahiya V, Sharma D, Kumar V, Lahkar M. Animal models of myocardial infarction: Mainstay in clinical translation. Regul Toxicol Pharmacol. 2016 Apr;76:221-30. doi: 10.1016/j.yrtph.2016.03.005. Epub 2016 Mar 14. PMID: 26988997.
3.Zhao CZ, Zhao XM, Yang J, Mou Y, Chen B, Wu HD, Dai DP, Ding J, Hu SJ. Inhibition of farnesyl pyrophosphate synthase improves pressure overload induced chronic cardiac remodeling. Sci Rep. 2016 Dec 23;6:39186. doi: 10.1038/srep39186. PMID: 28008986; PMCID: PMC5180215.
4.Zhang D, Wang B, Ma M, Yu K, Zhang Q, Zhang X. lncRNA HOTAIR Protects Myocardial Infarction Rat by Sponging miR-519d-3p. J Cardiovasc Transl Res. 2019 Jun;12(3):171-183. doi: 10.1007/s12265-018-9839-4. Epub 2019 Jan 3. PMID: 30607799.
5.Zhang X, Qu H, Yang T, Liu Q, Zhou H. Astragaloside IV attenuate MI-induced myocardial fibrosis and cardiac remodeling by inhibiting ROS/caspase-1/GSDMD signaling pathway. Cell Cycle. 2022 Nov;21(21):2309-2322. doi: 10.1080/15384101.2022.2093598. Epub 2022 Jun 30. PMID: 35770948; PMCID: PMC9586672.
6.Gao X, Liang X, Liu B, Hong Y, He H, Shen Y, Chen J, Huang X, Hu B, Li W, Li X, Zhang Y. Downregulation of ALKBH5 rejuvenates aged human mesenchymal stem cells and enhances their therapeutic efficacy in myocardial infarction. FASEB J. 2023 Dec;37(12):e23294. doi: 10.1096/fj.202301292R. PMID: 37966425.
7.Li Y, Chen J, Yang Y, Wang Y, Zhang Y, Zhou Y, Bao Y, Zhang Z, Lu Y. Necroptosis Plays a Crucial Role in Vascular Injury during DVT and Is Enhanced by IL-17B. J Immunol Res. 2022 Aug 19;2022:6909764. doi: 10.1155/2022/6909764. PMID: 36046722; PMCID: PMC9424031.
8.Min SK, Han SM, Kim HT, Kwon OC, Lee S, Kim JK. Algal fucoidan, unlike heparin, has thrombolytic activity in a murine arterial thrombosis model. Blood Coagul Fibrinolysis. 2012 Jul;23(5):359-66. doi: 10.1097/MBC.0b013e3283518815. PMID: 22576287.
9.Zhu J, Liu B, Wang Z, Wang D, Ni H, Zhang L, Wang Y. Exosomes from nicotine-stimulated macrophages accelerate atherosclerosis through miR-21-3p/PTEN-mediated VSMC migration and proliferation. Theranostics 2019; 9(23):6901-6919. doi:10.7150/thno.37357.
10.Eckly A, Hechler B, Freund M, Zerr M, Cazenave JP, Lanza F, Mangin PH, Gachet C. Mechanisms underlying FeCl3-induced arterial thrombosis. J Thromb Haemost. 2011 Apr;9(4):779-89. doi: 10.1111/j.1538-7836.2011.04218.x. PMID: 21261806.
11.Joshi S, Smith AN, Prakhya KS, Alfar HR, Lykins J, Zhang M, Pokrovskaya I, Aronova M, Leapman RD, Storrie B, Whiteheart SW. Ferric Chloride-Induced Arterial Thrombosis and Sample Collection for 3D Electron Microscopy Analysis. J Vis Exp. 2023 Mar 17;(193):10.3791/64985. doi: 10.3791/64985. PMID: 37010311; PMCID: PMC11042049.
12.Tulis DA. Rat carotid artery balloon injury model. Methods Mol Med. 2007;139:1-30. doi: 10.1007/978-1-59745-571-8_1. PMID: 18287662; PMCID: PMC2819386.














