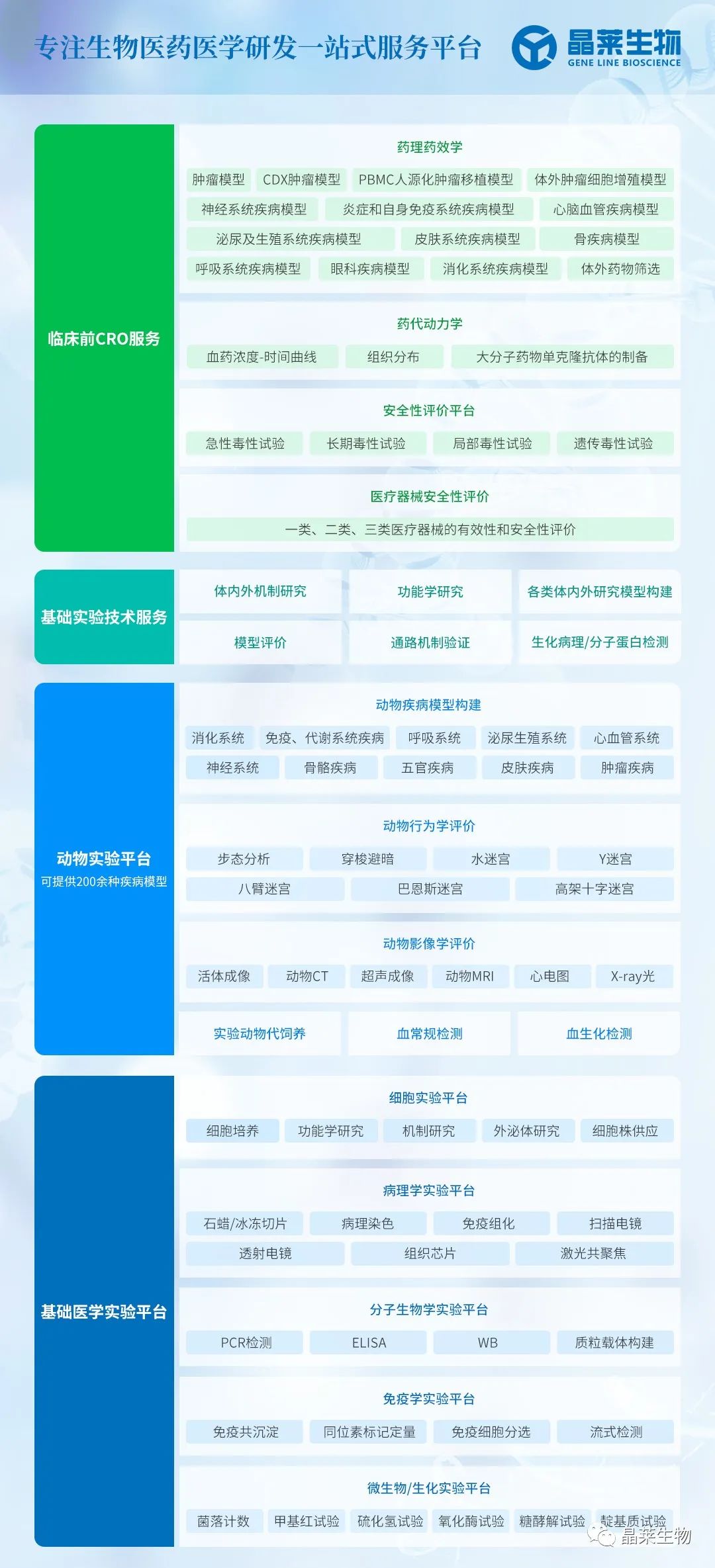
【五分钟讲实验】心肌肥厚动物模型构建详解!
时间:2024-03-25 阅读:1307心肌肥厚:是一种产生较缓慢但较有效的代偿功能,主要发生在长期压力负荷过重的情况下,心肌总 量增加,收缩力加强,使心脏得以维持正常的血循环,同时有相当的储备力。但这种代偿功能也有其 不利之处,主要因为肥大的心肌需氧增加,而冠状动脉的供血量往往不能予以满足,造成心肌缺血, 这将最后导致心肌收缩力的减退。
1. 心肌肥厚动物模型的造模方法主要分为3类:
①压力超负荷法: 采取主动脉缩窄的方法,心脏后负荷增加,导致心脏做功与耗氧量增加,左心室重 构而最终导致心肌肥厚(最常用的方式为TAC,AAC)
②容量超负荷法: 如动静脉造瘘法引起动静脉短路(AVF),增加右心室前负荷,形成右心室肥厚。
③激素诱导法: 目前主要有去甲肾上腺素和甲状腺素等(ISO)。
2. 优劣势对比
研究表明只有接近临床肥厚患者实际患病过程的模型,才有更高的研究价值。
① ISO法不能完全地模拟生理分泌肾上腺素的过程,且剂量过大可能导致动物的死亡,剂量过小则不能成功地建立肥厚模型;
② AVF法实验操作相对复杂;
③ AAC/TAC法主要是经过缓慢的病理变化模拟心肌肥厚,更接近肥厚疾病的真实病理进程。如在此基础上能深入地研究心肌肥厚疾病的发生发展机制,可最终为减少和改善 心肌肥厚及相关治疗药物的研发和应用奠定科学的理论基础。
AAC/TAC、AVF和ISO 组小鼠心肌可以见到室壁增厚,心室腔狭窄,但AAC/TAC组变化明显。
1. 模型介绍
小鼠横主动脉收缩(TAC)是压力过载诱导的心肌肥厚和心力衰竭的常用实验模型。TAC最初导致心脏的代偿性肥厚,这通常与心脏收缩力的暂时性增强有关。然而,随着时间的推移,对慢性血流动力学 超负荷的反应变得不适应,导致心脏扩张和心力衰竭。
小鼠TAC模型已被广泛用作一种有价值的工具,以模拟人类心血管疾病和阐明涉及心脏肥厚反应和心力衰竭发展的基本 信号过程。与其他心力衰竭实验模型相比,如左前降支(LAD)完全闭塞,TAC提供了一个更可重复的 心肌肥厚模型和心力衰竭发展的更渐进的时间过程。在这里,我们描述了一个一步一步的程序,以进 行手术TAC在小鼠。TAC是诱导小鼠左心室肥厚和心力衰竭的有效技术。
① 用刀片在颈部做纵向中线切口,从胸骨上至胸部中部切开10 mm以上切口,露出胸骨。 用显微外科钳将气管前肌分开,露出气管。
② 钝性解剖和胸骨后面的肌肉来移开胸膜。 做一个3 - 4 mm的胸骨上切口。胸骨向下部分小切口稍微向左。
③ 用7 – 0缝合线从两侧的第二肋间自内到外拉开肋-胸骨角,避免损伤肋间胸腔内血管或胸膜。
④ 轻轻移开气管前肌肉、纵隔脂肪和胸腺,在解剖镜下用弯镊观察主动脉弓。特别注意不要触摸或损伤顶胸膜,以防止气胸的发生。
⑤ 用血管钳将主动脉弓下的软组织暴露出来,然后轻轻展开钳口钝性分离组织。
⑥ 用6 – 0缝合线线穿过结扎辅助器。 将27G针头放置在主动脉弓旁作为缩窄直径标尺,在右侧无名动脉和左侧颈总动脉之间的 主动脉结扎,确保所有结都是平的。
⑦ 结扎后,快速并轻柔地取出针,以获得直径为0.4mm的狭窄,主动脉保持65 - 70 %的收缩。
⑧ 检查主动脉弓周围软组织、胸骨边缘和气管前肌肉的止血情况。去除用于展开胸骨边缘 的缝合线。
⑨ 从左第二肋外侧到内侧用6 -0缝合线缝合,保持靠近肋-胸骨角,避免损伤肋间胸腔内血管或胸膜。依次缝合胸骨肌肉和皮肤。
① 小鼠在含2%异氟烷的诱导室中麻醉。
② 在动物的前牙上放置一根橡皮筋,以延长脖子。用一只手用弯曲的钳子, 轻轻地操纵舌头到一边。另一方面,气管插管采用PE 90管进行。然后将气管 内管连接到小动物呼吸机,循环速度为125-150次/分钟,潮气量为0.1-0.3ml 在手术过程中,麻醉维持在1.5-2%异氟醚,0.5 - 1.0L/min 100% O2.通过在 小鼠甲床上
③ 在手术显微镜下对第二根肋骨进行部分开胸,用胸腔牵开器缩回胸骨。
④ 使用细尖45°角钳轻轻分离胸腺和脂肪组织与主动脉弓。
⑤ 在识别横主动脉后,在无名颈动脉和左颈动脉之间放置一小块6.0丝状缝线。两个松散在横主脉周围打结,一小块27½计钝针平行于横向放置主动脉第一个 结迅速绑在针上,然后是第二个结,迅速取出针,以产生直径0.4毫米的收缩。在假手术对照组小鼠中,除了主动脉结扎外,整个过程都是相同的。
⑥ 取下胸部牵开器,挤压呼吸机的流出物2秒,使肺部重新充气, 胸腔采用 6.0丙烯缝合线,间断缝合。使用6.0丙烯线连续缝合方式缝合皮肤。
⑦ 术后镇痛,小鼠注射丁丙诺啡(0.1 mg/kg)。
① TAC模拟人类主动脉瓣狭窄,是诱导小鼠心肌肥厚和心力衰竭的常见方法。主动脉收缩的替代部位包括升 主动脉和腹主动脉。升主动脉收缩为左心室(LV)提供了一个极端和更快速的超负荷。相反,腹主动脉 收缩使更大部分的循环完整,作为一种可能的补偿手段。因此,TAC通常是首选的模型,因为它提供了足 够的左室过载,更容易进行研究。这一方法在技术上具有挑战性,熟练情况下80-90%的存活率。
② 横主动脉收缩的紧密性决定了肥厚发展的程度和心力衰竭和扩张发展的时间框架。此外,小鼠的年龄还 影响了心力衰竭发展的恢复率和动力学。颈动脉对TAC的适应性反应需要更长的时间,并且可能比年轻小 鼠(3-4个月大)更容易发展为扩张型心肌病。小鼠的无创插管需要一些练习。
③ 用钝的剪刀做一个小的颈椎中线切口,用弯曲的镊子将气管周围的组织分开,以暴露气管。
④ 在前牙周围放置一条缝合线,轻轻地从动物的身体上拉开,以伸展颈部。
⑤ 用一只手用弯曲的钳子,轻轻地操纵舌头到一边。
⑥ 另一方面,气管插管采用边缘斜面的PE90管,便于进入。然后将气管内管连接到哈佛容积循环的啮齿 动物呼吸机,循环速度为125-150次呼吸/分钟,潮气量为0.1-0.3ml。
1. AAC法
① 小鼠术前禁食 12 h,4%水合氯醛麻醉,于小鼠剑突下沿腹中线切开皮肤及肌肉约1.5 cm。随后见腹主动脉和下腔静脉。
② 在肾动脉上方约 0.3 cm 处的腹主动脉,用 5 mL注射器针头(0.6 mm)紧贴腹主 动脉,平行放置,用 4号手术丝线结扎,抽出针头缝合创口。
③ 术后4周,处死小鼠,取材检测。
2. AVF法:
① 使用4%水合氯醛生理盐水溶液,麻醉小鼠。
② 于腹正中切口,将连有1 mL注射器的4号静脉注射针弯折成 135°角,斜向上刺穿腹主动脉,继续进针,刺穿动静脉联合壁,可见有鲜红色动脉血进入下腔静脉, 迅速在腹主动脉针眼处,均匀涂抹医用胶,封住针眼,松开血管夹,可见下腔静脉明显变红,触之有 震颤感,证明造瘘成功。
③ 于术后2周末,处死小鼠,取材检测。
1. 心肌肥厚过程伴随着复杂的基因表达水平变化,与心肌肥厚表型的发生、发展互为因果,其中ANP、BNP和β-MHC基因在心肌肥厚过程的再表达已经得到公认。
2. ANP主要由心房肌细胞分泌,ANP基因的表达是所有 哺乳动物心肌肥厚的特征,也是临床上判断疾病严重程度的预测指标。
3. BNP主要在心室合成和分泌,研究 表明,血浆中BNP浓度与心室射血分数具有相关性,心室射血分数不足时,大量的血液聚集在心室内,导致心室压力增大,心室腔扩张,从而引起BNP 合成和释放。
4. 心肌肌球蛋白是心肌肌原纤维的主要成分和收 缩蛋白,主要由一对重链(即α-MHC 和β-MHC)和两对轻链组成,通过研究各种因素引起的心肌肥厚发现, 在早期常伴有MHC同型异构体转换,当发生心肌肥厚时,β-MHC mRNA表达则明显增强,心肌α-MHC向βMHC发生转化,所以β-MHC是心肌肥厚的一个重要的标志性基因。
5. 同时检测ANP、BNP和β-MHC基因 的表达,对心肌肥厚的判定和预后将有重要的意义。
晶莱生物
以上部分数据与结果图来源于网络和文献,如有侵权请联系客服删除。
参考文献:
[1]Manning E P, Tardiff J C, Schwartz S D, et al. Molecular effects of familial hypertrophic cardiomyopathy-related mutations in the TNT1 domain of cTnT[J]. J Mol Biol, 2012, 421(1):54-66.
[2]Marin T M, Keith K, Davies B, et al. Rapamycin reverses hypertrophic cardiomyopathy in a mouse model of LEOPARD syndrome-associated PTPN11 mutation[J]. J Clin Invest, 2011, 121(3):1026-43.
[3]Li P, Li J L, Feng X H, et al. Comparison of changes in left ventricular gene expression profiles from different cardiac hypertrophy models in rats[J]. Acta Physiol Sin,
2004,56(2):210-28.
[4]Si W W, Kan H W, Yin Y Y, et al. Construction of the arteriovenous fistula model in mice and the intervention of compound SP[J]. Anhui Med Pharm J, 2014,18(9):1634-7.
[5]Mathiyalagan P, Chang L, Du X J, et al. Cardiac ventricular chambers are epigenetically distinguishable[J]. Cell Cycle, 2010, 9(3):612-7.
[6]Nobata S, Ventura A, Kaiya H, et al. Diversified cardiovascular actions of six homologous natriuretic peptides (ANP, BNP, VNP, CNP1, CNP3, and CNP4)in conscious eels[J]. Am J Physiol Regul Integr Comp Physiol, 2010,298(6):R1549-59.
[7]Liang F, Wu J, Garami M, et al. Mechanical strain increases expression of the brain natriuretic peptide gene in rat cardiac myocytes[J]. J Biol Chem, 1997, 272(44):28050-6.
[8]Cai H, Guo J H,Shang W, et al. Expressions of myocardial-MHC and -MHC mRNA in rats with pressure overload[J]. J Med Postgrad, 2009,22(10):1032-5.
[9]Berry J M, Naseem R H, Beverly A, et al. Models of cardiac hypertrophy and transition to heart failure[J]. Drug Discov Today Dis Models, 2007,4(4):197-206.
[10]Jiang Y, Han S Y. Effects of total flavones of buckwheat flower and leaf on protein kinase C content and activity in cardiac hypertrophy rats[J]. Chin Pharmacol Bull, 2008,24(12):1674-6.
[11]Zhao W L, Li D L. Advances in cardiac hypertrophy model approach[J]. China Pharm, 2014, 25(5):473-5.
[12]Li X M,Ma Y T, Yang Y N, et al. Comparison of heart function changes by transverse aortic coarctation in different strain mice[J]. Lab Anim Comp Med, 2008,28(4):209-13.
[13]Manning E P, Tardiff J C, Schwartz S D, et al. Molecular effects of familial hypertrophic cardiomyopathy-relatedmutations in the TNT1 domain of cTnT[J]. J Mol Biol, 2012, 421(1)
关于晶莱
关注公众号,了解更多!