肝损伤动物模型构建
时间:2023-01-09 阅读:2326肝脏是人体内最大的实质性器官,它承载着包括物质的合成分解代谢、生物转化和内外分泌在内的多种功能,血液供应丰富,易受到体内外各种致病因素和刺激因子的侵袭,引起肝脏的炎症反应,进而产生损伤。肝脏疾病作为临床上较为常见的疾病,一直是医学与药学重点研究的对象之一。
为了更深入地了解肝脏疾病的发生发展机制,国内外研究者利用各种肝损伤动物模型来进行实验,相继建立了一系列用于模拟急性肝损伤的动物模型。
1.四氯化碳性肝损伤
CCl4诱导的急性肝损伤模型是目前国际最常用药学研究的模型之一。
CCl4作为一种亲肝的细胞毒性物质,能迅速被肝和脑吸收,目前对CCl4的肝脏毒性作用机制研究有很多,最得到公认的机制主要是自由基的形成及引发的链式过氧化反应。
CCl4在体内可经肝微粒体细胞色素P450代谢激活生成两个活性自由基(CCl3O2和Cl)及一系列氧活性物可与肝细胞质膜或亚细胞结构的膜脂质发生过氧化反应膜磷脂大量降解从而破坏细胞膜结构完整性引起膜通透性增加最终导致肝细胞死亡。
四氯化碳(CCl4)溶于精致植物油配制0.1%浓度按10m/lkg小鼠腹腔注射12~24h后处死动物。
评价指标:测定血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红质(TB)、总蛋白(TP)、白蛋白(A)、肝匀浆脂质过氧化物(LPD)或丙二醛(MDA)、超氧化物歧化酶(SOD)谷胱甘肽过氧化物酶(GSH-Px)或还原性谷胱甘肽(GSH)等反映肝功能及脂质过氧化的指标并进行组织病理学检查。
2. α-萘基异硫氰酸酯
(α-Naphthylisothiocyanate ANIT)
ANIT是一种间接肝毒剂,其主要损害是通过膜脂质过氧化反应致使肝细胞变性、坏死、胞内血清谷丙转氨酶(ALT)大量溢入血流,同时还导致胆管上皮细胞肿胀坏死,引起毛细胆管增生及小叶间胆管周围产生炎症,从而造成胆
管阻塞,形成明显的胆汁淤积,并伴随以点状坏死为主的肝实质细胞损害,产生梗阻性黄疸,出现高胆红素血症和胆汁分泌减少。
ANIT对动物机体氧化自由基反应系统的影响对抗氧化型保肝药物的研究具有重要意义,是退黄药物研究的理想模型。可用于筛选和研究新型保肝药及利胆药。
3. 二甲基亚硝胺(Dimethylnitrosamine DMN)
DMN是常见的致肝癌剂,它通过微粒体代谢,其中间产物与细胞核酸、蛋白质等结合可造成细胞内大分子损伤。诱发大鼠肝窦壁肝星状细胞的活化,导致过多增多和沉积,引起肝纤维化形成;同时促进窦内皮细胞形成肝窦毛细血管化,加重肝损伤,促进肝纤维化的发展。
DMN肝损伤动物模型可分急性肝损伤动物模型和肝纤维化动物模型。
主要用于肝硬化形成的形态学改变、机理、生化指标的异常改变和门脉高压机制的研究及肝硬化向肝癌转化机制的研究。
4. D-氨基半乳糖性肝损伤
D-GaLN在肝细胞内代谢首先与尿苷酸(UDP)结合成尿苷二磷酸半乳糖(LIDP[1]GalN)并在肝细胞内聚集,由于这种结合的速度大大超过尿苷酸的生物合成速度致使尿苷酸耗竭进而导致依赖其进行生物合成的核酸、糖蛋白和糖脂等物质减少限制了细胞器的再生及酶的生成和补充使细胞器受损肝细胞的结构和功能均出现异常甚至死亡。
用生理盐水配制成100g/L的D-氨基半乳糖(D-galactosanineD-GalN)溶液大鼠或小鼠腹腔注射600~900mg/kg造成急性肝损伤模型染毒24-48h后处死动物。
评价指标:检查肝功能、病理及脂质过氧化指标。
D-Galn形成的急性肝功能衰竭模型是研究病毒性肝炎的发病机制及有效治疗药物理想的实验动物模型。
5. 硫代乙酰胺( thioacetamide TAA)
TAA 具有直接肝毒性作用,摄入后可经肝细胞内细胞色素 P450混合功能氧化酶代谢为TAA 硫氧化物,干扰细胞核内RNA 转移,影响蛋白质合成和酶活力,增加肝细胞核内 DNA 合成及有丝分裂,促进肝硬化发展,同时激活肝细胞磷脂酶A2破坏肝细胞膜,形成肠源性内毒素血症,导致大面积肝细胞破坏,并可使 ALT 、AST 明显增高。TAA小剂量诱发肝细胞凋亡。
TAA 常用于制作急性肝损伤、肝纤维化和肝性脑病模型。皮下注射 TAA 600mg/kg 制作大鼠急性肝损伤动物模型。
1. 对乙酰氨基酚肝损伤
对乙酰氨基酚(acetaminophenPA-PA)又名扑热息痛、醋氨酚。PAPA为常用的解热镇痛药。
PAPA经体内P450代谢可生成活性代谢产物(NAPQI)需GSH参与其灭活当NAPQI生成过多或GSH下降时NAPQI和肝细胞内大分子发生共价结合形成加合物NAPQI
诱发氧应激反应造成过氧化损伤与线粒体结合干扰细胞内的能量代谢及使生物膜系统发生脂质过氧化最终导致肝细胞变性坏死。
PAPA诱导肝细胞损伤程度与IL-10的表达水平呈负相关与巨噬细胞移动限制因子呈正相关提示肝损伤涉及炎症因子与抗炎因子失衡。
每日25mg治疗剂量下较安全过量则使肝脏不同程度损害。对乙酰氨基酚加热下溶于生理盐水给小鼠300~500mg/kg一次性腹腔注射。也可配成质量浓度为2.5%混悬液经口灌胃制成肝损伤模型。染毒24h后处死动物。
评价指标:检测肝功能、病理及脂质过氧化指标。
2. 其他
①相关研究应用四环素(T etracycline)10倍剂量(2250mg/kg)灌胃18h 成功制得急性肝损伤模型。目前四环素导致肝损伤的机制仍未明。
②抗结核药物异烟肼具有肝毒性,应用2倍剂量(180mg/kg)异烟肼灌胃后18h成功诱导急性肝损伤模型。异烟肼引起肝损伤动物模型多用于药物性肝炎的研究。
1. 刀豆蛋白A诱导法
刀豆蛋白A(ConA)是一种植物凝集素它是一类可与多种细胞表面的糖分子残基结合的蛋白质分子。
其生物学功能主要包括:使细菌、植物、以及哺乳动物的细胞凝集促进T细胞分裂此作用与其促进淋巴因子类的生物活性多肽的释放有关。
在ConA诱导的肝损伤模型中,淋巴细胞或者单核细胞以及肝脏中的kuppffercells通过炎症反应参与了损伤过程,它们进一步激活肿瘤坏死因子TNF-α继而通过调亡机制毁损实质细胞。
小鼠直接一次性尾静脉注射刀豆蛋白A(concanalinA ConA)20mg/kg制成急性免疫性肝损伤模型。
评价指标:2~8h后取样测定肝功能、病理及脂质过氧化指标。
ConA 肝损伤动物模型对于治疗自身免疫性肝炎的药物筛选具有重要意义。
2.卡介苗(BCG)加脂多糖(LPS)诱导法
其损伤机制为BCG首先激活致敏T淋巴细胞尤其是致敏肝内枯否氏细胞和巨噬细胞并大量聚集于肝脏当注射LPS后进一步激活处于致敏状态的巨噬细胞使其释放大量细胞毒性因子。如:一氧化氮(NO)、肿瘤坏死因子(TNF-α)、白细胞介素、自由基、白三烯等造成肝细胞损伤。
给小鼠尾静脉注射卡介苗浆液0.2m/l只(含5×10个菌以上)致敏后10d,再尾静脉注射脂多糖7.5μg/只,16h后测定肝功能、病理、脂质过氧化指标。
BCG 和 LPS 肝损伤动物模型可用于对病毒性爆发性肝炎的研究。
3.异种血清
异种血清诱导的免疫性肝纤维化其发生机制尚未明确。
异种血清腹腔注射法可选用猪、牛、羊等血清,其中以猪血清最为常用。猪血清每次0.5mL 腹腔注射SD 或 Wistar 大鼠,每周2次,12周后肝内广泛纤维组织增生,假小叶形成,有典型肝硬化表现。
1. 急性酒精性肝损伤
小鼠或大鼠以50~60度白酒或体积分数为50%~60%的乙醇一次性经口灌胃4.0~6.0g/kg,4~24h内处死动物,检查肝功能、病理、脂质过氧化指标。
2. 慢性酒精性肝损伤
大白鼠以50~60度白酒或50%~60%的乙醇经口灌胃2.4~5.0g/kg,每日1次,连续2个月。每天同时喂饲造模饲料,即营养不良饲料(面粉∶次粉∶草粉∶豆粉按2∶1∶1∶1比例配方,另加少量豆油及食盐)。正常对照组喂饲常规饲料,末次染毒后24h 取样测定有关指标。
慢性酒精性肝损伤的诊断主要靠病理学检查。
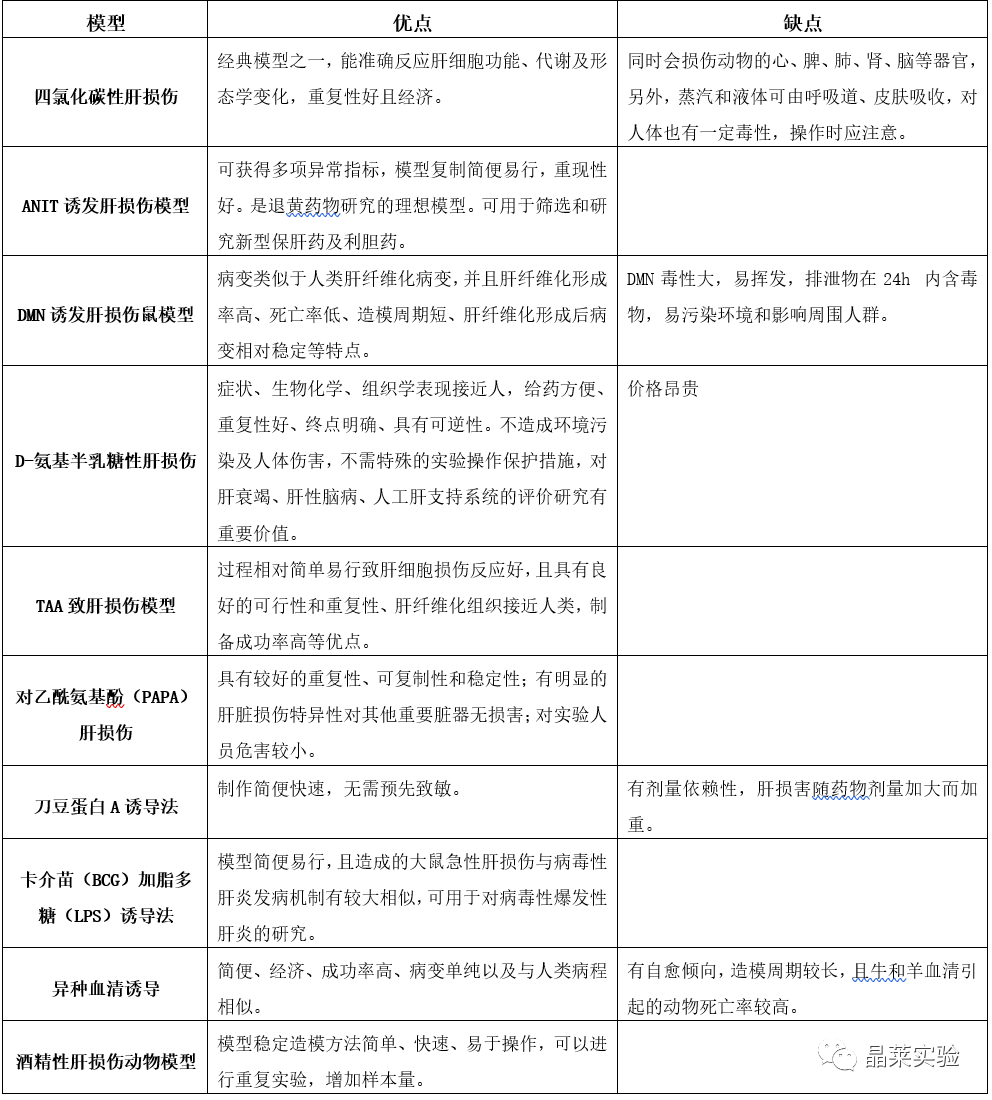
不同模型优缺点对比
参考文献:













