动物模型 | 肺癌模型及其应用
时间:2022-10-24 阅读:2061肺癌作为全球肿瘤发病率和死亡率最高的癌种,一直备受医疗界研究者们的广泛关注。
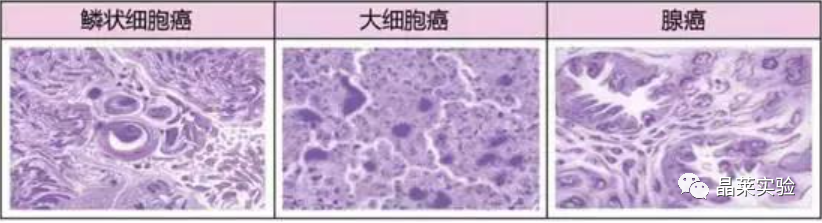
肺癌主要分为非小细胞肺癌(non small cell lung cancer, NSCLC)和小细胞肺癌(small celllung cancer, SCLC),前者主要包括腺癌、鳞状细胞癌、大细胞癌;其中非小细胞肺癌约占肺癌的80~85%,其中肺癌动物模型已逐渐成为其机制研究及药物研发必不可少的工具。
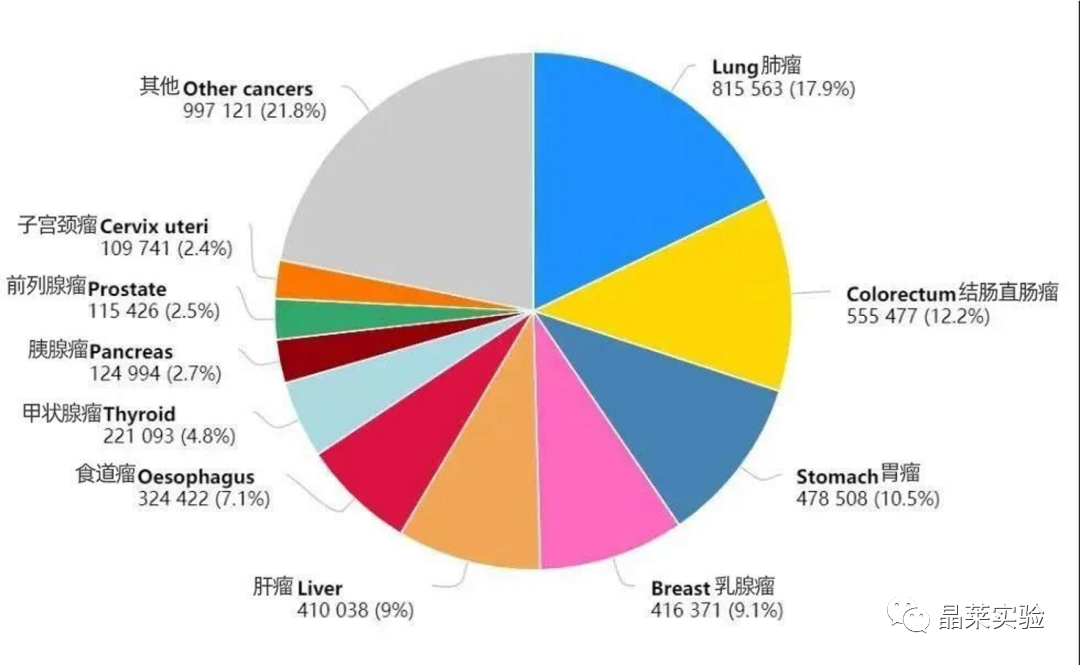
表1:2020年中国癌症新发病例数前十的癌症类型

表2:肺癌类型
肺癌模型主要分为CDTX肺癌细胞移植模型(皮下移植模型和原位移植模型),PDTX(人源肿瘤组织异种移植模型)和基因修饰的肺癌模型,下面依次介绍。
一. CDTX(肺癌细胞移植模型)
肺癌模型中,根据接种部位主要分为皮下和原位移植模型,在这类模型中需要选择正确的肺癌细胞株,可以参考上表中肺癌细胞分类,并根据实验目的选择正确的荷瘤模型,如皮下荷瘤主要用于单独研究肿瘤生长情况。
1、 皮下荷瘤
定义:根据研究的肺癌类型及基因突变情况,选取状态好的肿瘤细胞移植于小鼠皮下。例如,我们研究KRAS突变的肺癌,通常选取KRAS突变的A549细胞,细胞量为1×106-3×106/只。
2、原位荷瘤
定义:将肿瘤细胞通过注射等方式移植到模式动物肺部构建的动物模型。
模型优点:与皮下荷瘤模型相比,能更好反映肿瘤在人体内的一个发生发展及转移过程。
实验操作方法:
① 细胞系选择及准备工作
为了便于观察肺癌细胞在体内生长情况,选用带荧光素酶(Luciferase)标签的A549细胞,取对数生长期的A549-Luc(106/只)用胰酶消化收集,1×PBS洗两次,用PBS重悬后与生长因子减少的Matrigel基质胶按1:1的比例混合,每只老鼠注射100µl含1×106个细胞的混合悬液;
② 小鼠的准备工作
选取6-8周龄的Balb/c无胸腺裸鼠,置于超净工作台中麻醉,裸鼠由兴奋状态转为麻醉状态后将其以右侧卧位固定,胸腔表面用酒精消毒。
③ 切口位置的选取,确定肺部位置
确定位置:位于小鼠左侧肋弓下缘以上约1cm处(第四、五肋弓之间),这一部位有两条纵向较粗的血管,肺部位于这两条血管之间(视频中用黑色marker笔标注位置)。
露出肺部:先将表皮剪一约5mm的小口,沿此小口逐步剪开下层皮下及肌肉组织,隔着胸膜可以看到粉色的肺部,肺部会随着小鼠的呼吸收缩和扩张。
④ 肿瘤细胞注射
取混匀的100µl的细胞悬液,沿着切口对准小鼠的左肺缓慢注射,进针深度约为3mm,注射结束后停针5s,左右旋转慢速出针。
⑤ 小鼠伤口缝合
将剪开的小鼠表皮进行缝合,将小鼠以右侧卧位(使伤口朝上)置于37℃恒温加热板上直至小鼠苏醒,放回原笼中继续饲养,4-6天伤口即可愈合。
注意事项:
① 为什么使用Matrigel?
如果肿瘤细胞仅用PBS重悬便注射到小鼠肺部,细胞可能随肺部气管快速扩散,造成气管堵塞导致小鼠死亡,使用Matrigel与细胞混合后进行实验便可降低小鼠死亡风险。
② 如何避免出血?
操作过程中要避开较粗的血管,以免流血影响后续实验操作以及肺部的观察;并且最好选用胰岛素注射器,由于注射器针头扎入肺部有可能损伤肺部大血管,很容易造成小鼠的死亡,因此注射器最好选用针头较细的胰岛素注射器。
③ 注意整个操作过程及手术器械要保持无菌,以免小鼠感染。
④ 后续分组和试验分析
分组时间:一般原位注射一周后,裸鼠肺癌原位模型建成,进行分组(n=10);
如何分组:依据裸鼠体重腹腔注射相应剂量的D-luciferin (Xenogen) 荧光底物(150 mg/kg),将裸鼠放置于麻醉箱中通以2.5%异氟烷/氧,待裸鼠麻醉后转入IVIS厢室中,使其腹面朝下并持续通以麻醉气体,注射底物10min后,进行荧光成像,测量各裸鼠肺部初始荧光值,依据荧光值的大小平均分组。随后可进行给药等实验,定期进行荧光检测。
伦理:动物伦理学规定,小鼠肿瘤重量不可超过小鼠体重10%,平均肿瘤直径不超过20mm,并且如果出现溃烂,并且严重转移,造成感染或坏死时,应该中止实验且对动物施行安乐死。
二. PDTX(人源肿瘤组织异种移植模型)
定义:将病人肺癌组织移植到小鼠皮下等部位,主要用于抑制肿瘤生长(细胞增殖)的药物的筛选检测,在近年该模型越来越受重视。
模型优点:因为取自病人的肿瘤组织,在组织形态和遗传特征等方面均与人类肿瘤相同,故这种模型可以更贴近人类肿瘤的生物学特性。
实验操作方法:
① 处理新鲜肺癌组织:在无菌条件下的冰上对新鲜离体的肺癌肿瘤组织,剔除包膜及坏死组织,切成约15mm3(2mm×2mm×3mm)的小块;
② 首次接种小鼠:将切好的组织碎片用镊子填入定制的套管针尖端内,注射到5-6周NOD/SCID重症联合免疫缺陷小鼠背部皮下,每只老鼠背部可以接种1-2个位点,每例肿瘤接种2-3只小鼠,此接种过程须在肿瘤标本离体后2h之内完成,为提高成瘤率肿瘤块也可混合10% Matrigel进行荷瘤;
③ 再次传代:当裸鼠皮下肿瘤生长至1000 mm3左右,表示移植成功,对其处于对数增长期的原代(F1代)皮下移植小鼠模型进行传代。
④ 剥离皮下肿瘤,部分组织速冻至液氮备用或经4%多聚甲醛固定后石蜡包埋;另一部分组织按照上述接种步骤,移植到4-5只裸鼠皮下,建立第二代移植小鼠模型(F2代)。按照此流程,在裸鼠体内连续传代3代后,移植瘤的生长速度开始稳定,可进行体内动物模型实验。
定义:主要是利用基因编辑技术如CRISPR/Cas9进行敲除或插入特定基因,从而诱发动物产生肿瘤的模型。肺癌基因修饰模型主要是KRAS突变诱导肺癌等产生,KRAS突变同时P53缺失会加速肿瘤的发生发展。
模型优点:主要用于肿瘤发生发展过程及作用机制的研究;同时原癌基因的频发突变是肿瘤产生的重要原因之一,因此靶向这部分原癌基因的抗肿瘤药物筛选是一个重要方向。
构建方法:
可以参考基因编辑小鼠构建过程(包括KO,KI,CKO小鼠的构建等)
一. 非小细胞肺癌模型
非小细胞肺癌主要包含腺癌、鳞状细胞癌和大细胞肺癌,还包含不太常见的类型例如腺鳞癌和肉瘤样癌。在非小细胞肺癌中,发现很多驱动突变,常见的驱动突变包括Kras突变、EGFR突变、FGFR1扩增、ALK重排、HER2突变、MET扩增、BRAF突变等。
研究人员对肺癌的多个突变进行探究,将肺癌中发现的突变进入引入到小鼠中,从而获得多种用于研究肺癌发生与转移机制、筛选和评价抗肿瘤药物的肺癌模型。

表3:非小细胞肺癌中基因突变频率和类型
1. Kras突变肺癌模型
野生型Kras激活/失活效应是受控的,而突变型Kras蛋白功能异常,持续处于激活状态,导致肿瘤细胞的持续增殖。Kras突变的肿瘤细胞比其他肿瘤细胞更容易存活,因此Kras突变的肺癌治疗也一直是医学界的一个难题。
目前国际上应用最广泛的肺癌动物模型就是Kras-LSL-G12D小鼠模型,可以通过与肺上皮细胞特异性的Cre转基因小鼠杂交来实现Kras突变体的激活,从而导致肺癌的发生。有研究表明,通过SPC-Cre小鼠与Kras-LSL-G12D小鼠杂交,从而获得了从肺部炎性反应到肺腺瘤进展时程较长的慢性自发肺部肿瘤小鼠模型。Kras-G12D诱导的肺癌模型为肺癌病因的研究提供了更长的窗口期,也为Kras突变的肺癌治疗提供了更有力的研究工具。
Kras-LSL-G12D还经常和其它癌症驱动基因联用,用来满足更多的肺癌研究需求。
在人类NSCLC中经常发现Kras-G12D突变和Lkb1缺失同时出现,而小鼠中Kras- G12D突变伴随Lkb1缺失会加速肺肿瘤发展,恶性程度也会更高,出现多样的表型特征,包括鳞状细胞癌和大细胞癌。Kras-G12D突变并发激活Wnt /β-Catenin信号会增加侵袭性和远端组织感染。Kras-G12D突变伴随p53失活导致侵袭性增加,也发生转移现象,这可能是p53的缺失导致基因组的不稳定,从而导致肿瘤恶性化。
2. EGFR突变肺癌模型
表皮生长因子受体(epidermal growth factor receptor,EGFR)在细胞增殖和分化中起到重要作用,是目前最重要的靶向治疗靶点之一。
突变后导致蛋白功能异常,持续处于激活状态,导致肿瘤细胞的持续增殖。针对其敏感突变的EGFR酪氨酸激酶抑制剂(TKI),是治疗NSCLC最常用的靶向药物,EGFR-TKI疗效好和副作用少,为很多肺癌患者带来希望,是肺癌治疗中的突破性进展。
但是靶向治疗也有其自身的弊端,几乎所有的EGFR-TKI治疗患者最终均产生获得性耐药:第一代和第二代靶向药治疗后出现T790M耐药性突变,第三代靶向药治疗后出现C797S耐药性突变。由此催生了多种携带耐药性突变的EGFR肺癌模型,可用于新药的研发和肿瘤耐药性的研究因此目前也有很多EGFR突变的肺癌肿瘤,用于新药的研发以及肿瘤耐药性研究。
和Kras-G12D突变引起的局灶性肿瘤不同,EGFR-L858R突变引起的是类似于支气管肺泡的弥漫性肿瘤,EGFR外显子19的缺失引起多灶性腺癌。
并且研究发现,EGFR-T790M突变小鼠以及EGFR-L858R+T790M突变小鼠比EGFR-L858R突变小鼠的肿瘤潜伏期要更长,适用于耐药性机制研究。
3. ALK基因重排肺癌模型
ALK编码酪氨酸受体,在正常肺中不表达,但是在约5%的非小细胞肺癌患者中会表达EML4-ALK,EML4-ALK是由于染色体倒位形成EML4基因与ALK 基因的重排,EML4-ALK的表达促使肺癌发生和恶化,是目前的靶向治疗的热门靶点之一。EML4-ALK融合常见于年轻患者以及轻度吸烟或不吸烟者,并且EML4-ALK与Kras以及EGFR突变相互排斥,基本不同时出现。
研究表明,肺特异性表达EML4-ALK的小鼠出生后不久发生多发性肺腺癌,为研究ALK靶向抑制剂(ALK-TKI)的敏感性以及耐药性提供合适模型,并且也为ALK-TKI的临床前药物筛选提供有力工具。
4. 其它肺癌模型
除了以上3类小鼠模型,还有其他基于驱动突变导致的肺癌研究模型,如PIK3CA-H1047R突变小鼠可发生具有支气管肺泡特征的腺癌,Braf-V600E突变小鼠可发生腺瘤(很少进展为腺癌)。
二. 小细胞肺癌模型
小细胞肺癌是一种侵袭性强、难以治疗的癌症类型,约占全部肺癌病例的13-15%。具有转移速度快、恶性程度高、预后情况差等特征,属于恶性程度极高内分泌肿瘤。
在小细胞肺癌中,最常出现的驱动突变是Rb和p53的基因功能缺失,因此SCLC动物模型中通常使用Rbflox小鼠,p53 flox小鼠和肺部特异性Cre小鼠进行交配获得。
Rb和p53的同时特异性敲除后,SCLC的肿瘤发生率很高,并且肿瘤和人类肿瘤相似度很高,也能转移到特定的组织,但是整个周期比较长,大约9个月。因此通常会加入一些其他突变基因加速肿瘤发生,例如Rb,p53和Ppten同时的组织敲除,Rb,p53和p130同时敲除,Rb和p53敲除同时过表Lmyc和Nfib,均可加速肿瘤发生。
1. 基于T细胞的免疫调节
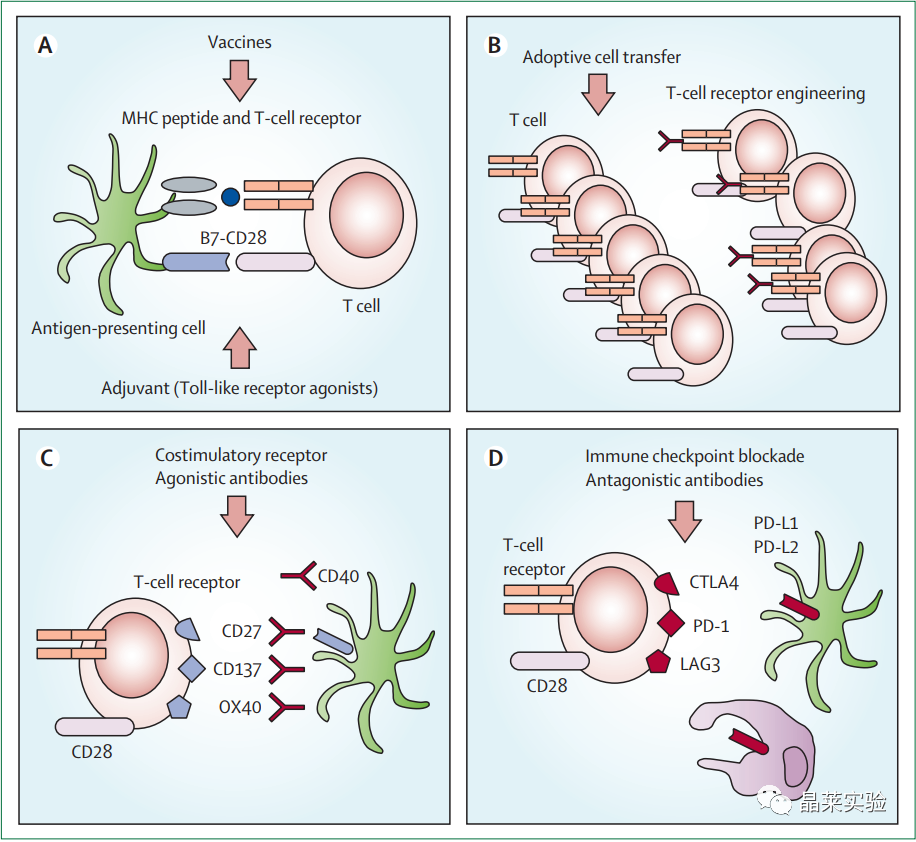
(A)与佐剂混合的疫苗可以利用MHC I类和II类肽复合物和共刺激信号,模仿专业抗原呈递细胞与幼型T淋巴细胞之间的自然相互作用。
(B)被动免疫疗法涉及转移具有高亲和力的离体扩增的T细胞,具有特定特异性的T细胞受体,或经过基因修饰以过表达嵌合抗原受体。
(C)单克隆抗体可与共刺激受体发生接触或激动。
(D)钝化或拮抗抑制性受体,导致T淋巴细胞过度刺激。
2. 影响癌症免疫治疗中的微环境
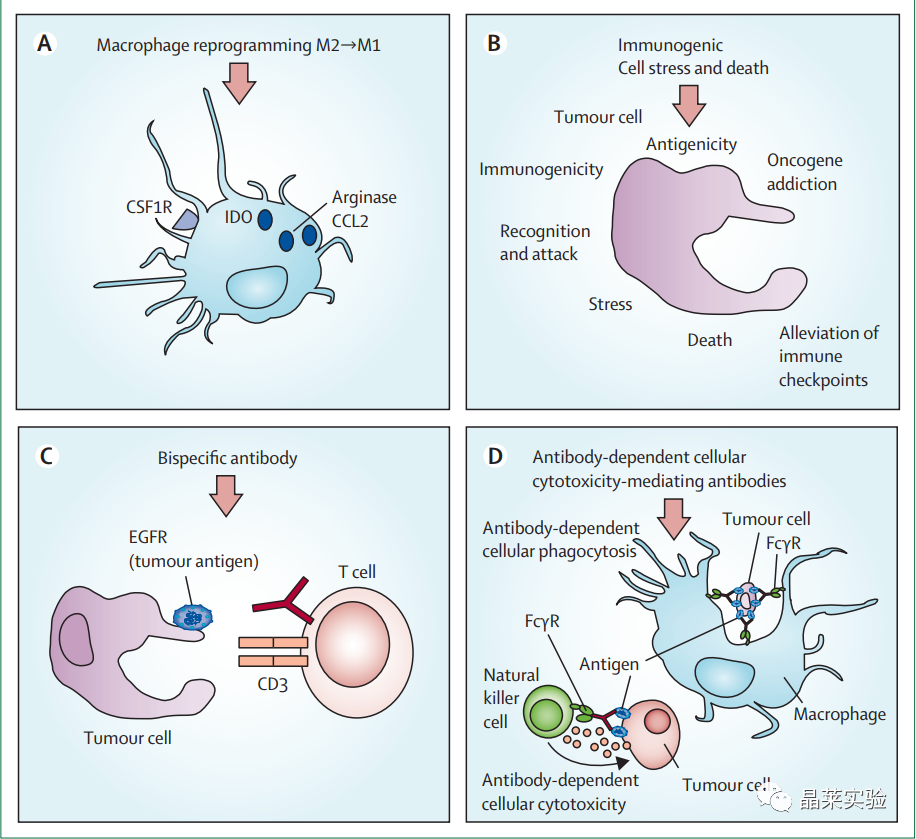
(A)重编程M2样巨噬细胞包括驱动骨髓细胞成为使Th1淋巴细胞极化的杀伤细胞或抗原呈递细胞。
(B)通过使用细胞毒性药物可以诱导肿瘤细胞变得更具有免疫原性,这些细胞毒性药物可增强肿瘤细胞对T细胞和自然杀伤细胞攻击的敏感性,触发内质网应激反应或自噬反应(促进T细胞启动),或减少免疫抑制分子的表达或分泌。
(C)在淋巴瘤和白血病中,正在被动施用抗体,这些抗体桥接肿瘤细胞和T淋巴细胞并促进T细胞的逆转录和活化,导致肿瘤细胞死亡。
(D)抗体依赖性细胞毒性介导的抗体可以增强自然杀伤细胞,中性粒细胞和巨噬细胞的功能,有利于肿瘤细胞的死亡和免疫成分的激活。IDO=吲哚胺2,3-二加氧酶。
3. 非小细胞肺癌的免疫逃生和逃避机制
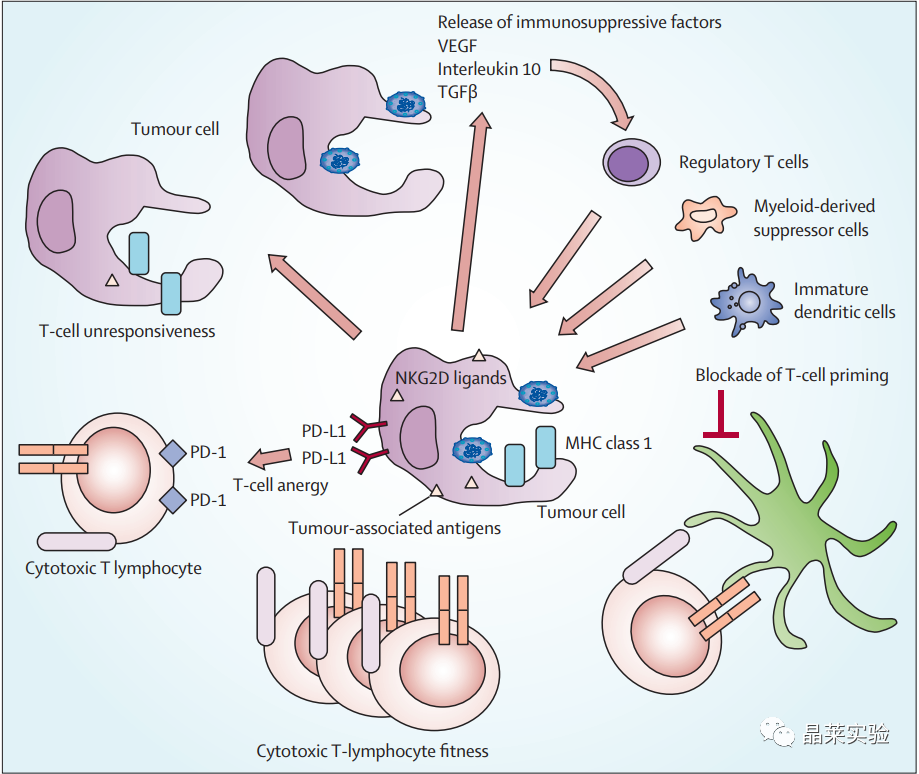
肿瘤细胞最终失去MHC I类或I类分子(如NKG2D配体)和肿瘤相关抗原,使其对细胞毒性T淋巴细胞攻击具有抗性。同时,它们分泌免疫抑制细胞因子或趋化因子,通过招募免疫抑制剂(例如调节性T细胞,骨髓来源的抑制细胞和未成熟的树突状细胞)来防止T细胞启动。由于癌基因成瘾或适应性免疫抵抗,它们还表达PD-L1和PD-L2抑制分子,促进T细胞无能或疲惫。
4. 非小细胞肺癌的推定组合免疫治疗和化疗方案
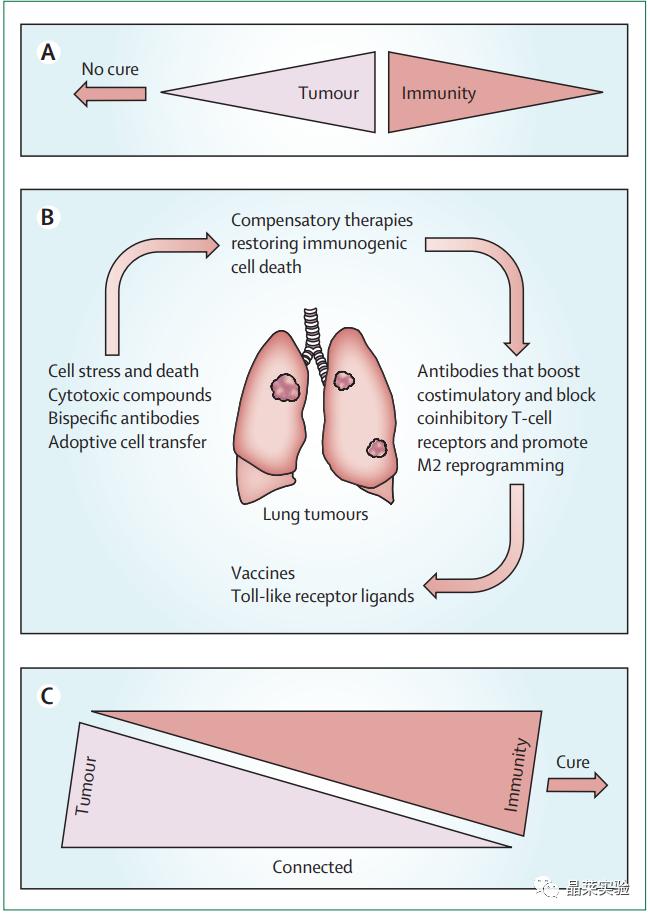
(A)大多数NSCLC疗法并非旨在引起免疫系统对肿瘤杀伤活动的贡献,从而排除了保护性记忆,抗癌T细胞免疫的可能性。
(B)将这些方面结合到癌症治疗中应考虑以下几点:诱导免疫原性细胞死亡过程,添加代偿性疗法(例如在缺乏HMGB1的肿瘤中使用TLR4或MYD88激动剂,使用基于顺铂的疗法的内质网状应激源,或在缺乏自噬的肿瘤中使用外胚层ATP酶抑制剂),恢复免疫抑制(通过使用作用于免疫检查点的单克隆抗体或M2的重编程), 并在疾病得到控制时使用佐剂疫苗提高记忆T细胞反应或创建更广泛的T细胞库。
(C)这种组合方案应以协同方式将肿瘤和宿主反应联系起来。













