类器官应用
时间:2022-10-31 阅读:2381类器官是一种三维(three-dimensional,3D)细胞结构,可来源于胚胎干细胞(embryonicstemcells,ESCs)、多能诱导干细胞(inducedpiuripotentstemcells,iPSCs)、成体干细胞(somaticstemcells,SSCs)和肿瘤细胞。
类器官技术是近年来生物医学领域最具突破性的前沿技术之一。作为组织干细胞在体外三维培养所形成的微型器官,类器官在组织结构、细胞类型和功能等方面与来源组织高度一致,为生物医学基础研究、药物研发以及临床精准医疗提供了理想模型,并在再生医学中展现出重要潜在价值。
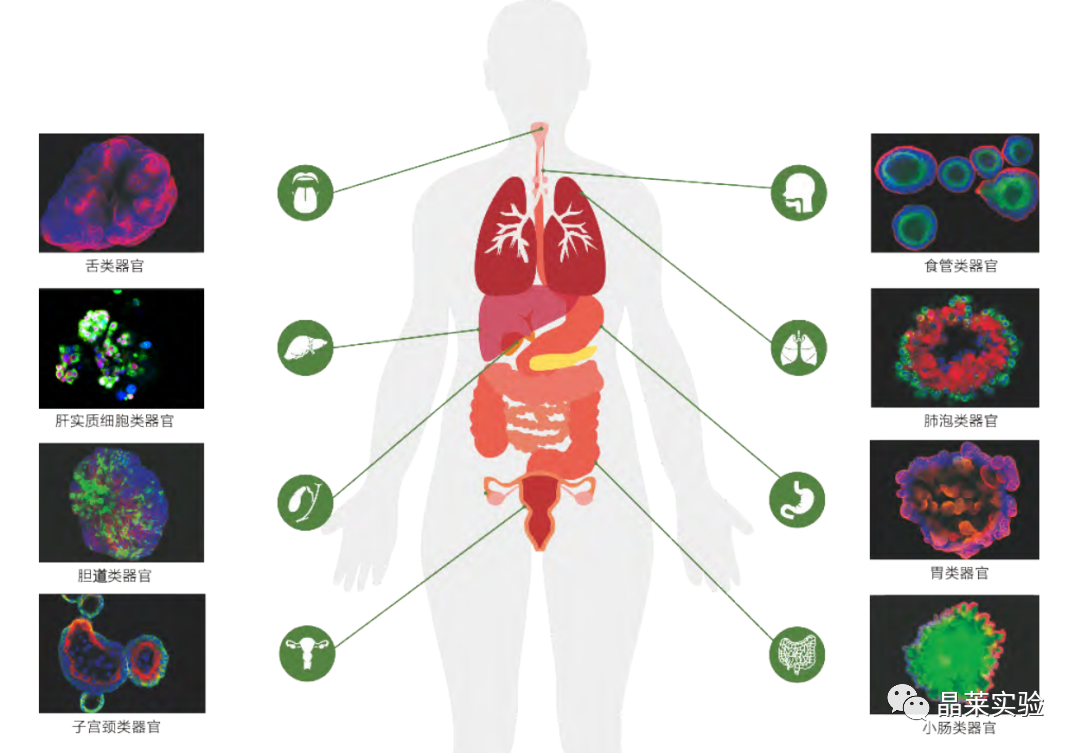
不同正常组织来源的类器官
2009 年,肠道类器官培养技术的出现是器官发育领域的一项重大进步。荷兰科学家以小鼠小肠隐窝底部快速增殖的、Lgr5 标记的成体组织干细胞为种子,使用基质胶和多种生长因子营造了模拟体内微环境的体外三维培养体系,最终构建出与体内小肠上皮“绒毛 - 陷窝”结构高度一致、包含所有细胞类型的“迷你肠道”。
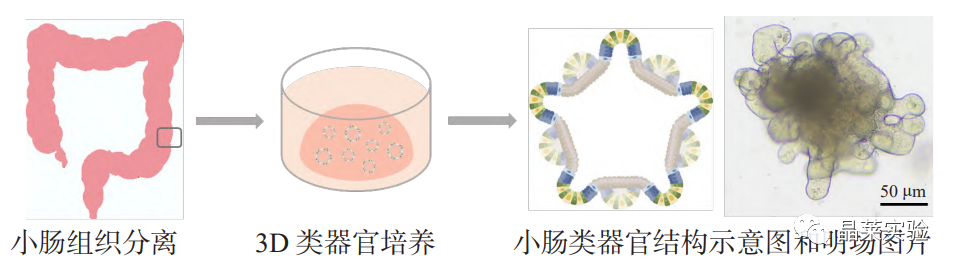
类器官可从成体组织干细胞培养得到,还可从胚胎干细胞或诱导多能干细胞定向分化得到,它们都利用了干细胞在合适组织微环境中无限扩增的潜力。
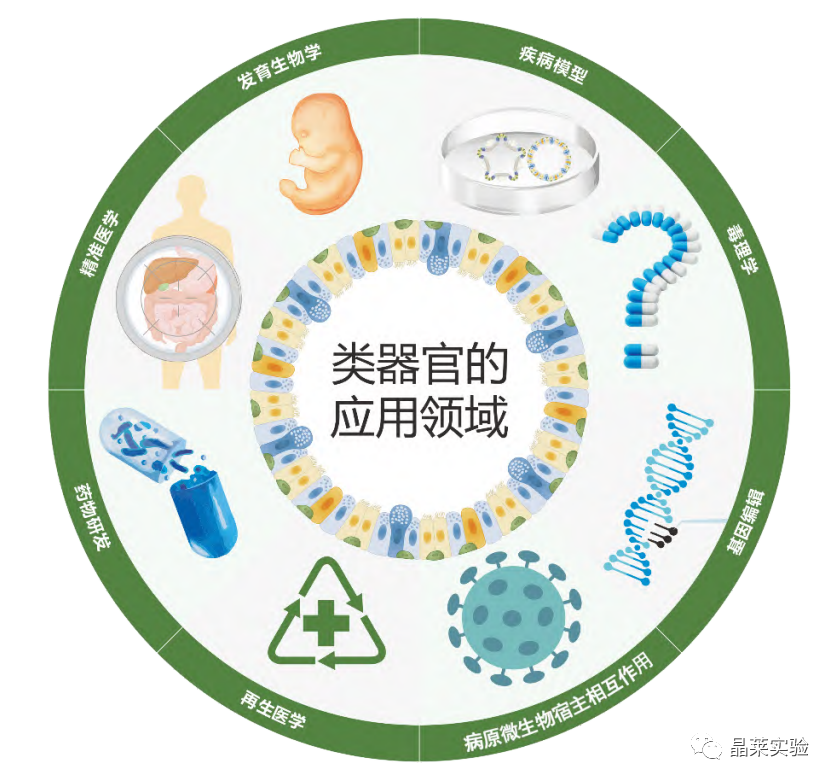
类器官技术的发展促进了对疾病模型、药物研发、精准医学、发育生物学、病原微生物宿主相互作用、毒理学、基因编辑、肿瘤研究以及再生医学的深入研究。
1. 疾病模型:
类器官非常适合用于传染病研究,特别是局限于人类并且依赖于特定细胞类型的病原体的研究。
常用疾病模型 | 构建方法 | 优点 | 局限性 |
整体动物模型 | 实验室购买实验动物 | 能从整体水平(神经⁃体液⁃器官/组织⁃分子)较全面地体现临床疾病的特征。是 最能体现人类疾病特征地实验模型。 | ① 干扰因素复杂,实验条件难以控制,个体之 间地实验数据差异较大; ② 由于人类与动物在结构、功能和代谢以及语 言和思维等方面的差异,结果只能供临床参考 和借鉴,还需临床检验才能用于人类疾病防治。 ③ 猿猴等高等动物的实验周期长,价格昂贵。 ④ 动物实验需要遵循相关动物管理和实验条 例。 ⑤ 存在伦理道德的相关问题。 |
原代细胞模型 | 从动物或人体组织直接分离的细 胞,在含有相关营养成分的培养 基培养。 | 在功能和代谢以及形态方面具有与动物 或人体细胞十分类似的特点。 | ① 难以同步化处理,所有细胞的均一性差。 ② 一些分化程度较高的细胞增殖能力低,体外 培养的时间受限,且不能传代。 ③ 原代培养细胞转染效率低。 |
细胞株模型 | 将某些原代细胞长期培养、筛选 后,其功能、代谢、形态趋于均一 化,并获得无限增殖和永生化的 特征。 | 可以克服原代细胞的一些缺点,干扰因 素少、便于同步化、实验条件更易控制且 便于进行基因操控。 | ① 与整体的差别大。 ② 经过选择的永生化细胞株可能部分或者完 全丧失原代细胞的特性。 ③ 细胞株在长期传代过程中可能发生变异。 |
类器官 | 胚胎干细胞或诱导多能干细胞一 定条件下在体外培养形成 | ① 能够很好地模拟多细胞环境、组织结 构和靶器官功能的复杂性。 ② 具有较高的可塑性。 ③ 培养时间相对较短且不存在伦理道 德问题。 | ① 缺乏先天免疫细胞的参与。 ② 不能模拟类器官的内分泌和神经调节以及类器官与肠道微生态条件之间的相互作用。 ③ 技术仍不成熟,培养时间、培养条件没有一 个统一的标准。 |
常见疾病模型比较
2. 药物开发
肠道、肝脏、肾脏等器官对药物或环境改变较为敏感,易受到药物毒性作用发生应激和损伤。培养成体组织干细胞或者多能干细胞来源的肠道、
肝脏、肾脏等类器官,能够为新药进入临床前的毒性评价提供体外人源化模型。
尤其对于因患者数量少而无法进行大规模临床试验的罕见遗传疾病,类器官技术可为药物开发提供解决方案。
3. 精准医疗
类器官技术能够在体外快速地测试特定患病组织对不同药物的反应。
利用类器官培养技术,可以从患者来源的肿瘤组织样本中建立肿瘤类器官,并在体外测试肿瘤对于放射治疗或者化学药物治疗、靶向药物治疗、免疫细胞治疗等的有效性。
另外,建立肿瘤类器官样本库,通过基因组测序联合药物敏感性测试的大数据分析,可使得将肿瘤的遗传背景与药物反应联系在一起成为可能。
研究表明研究人员构建了结肠癌患者不同位置肿瘤的类器官,发现各个区位肿瘤所突变都不同,且转录组和甲基化水平也存在差异,而肿瘤类器官可以很好地保留这些肿瘤异质性。
4. 再生医学
类器官在再生医学领域中的应用是将成体组织干细胞培养得到的类器官移植回体内,修复受损组织。
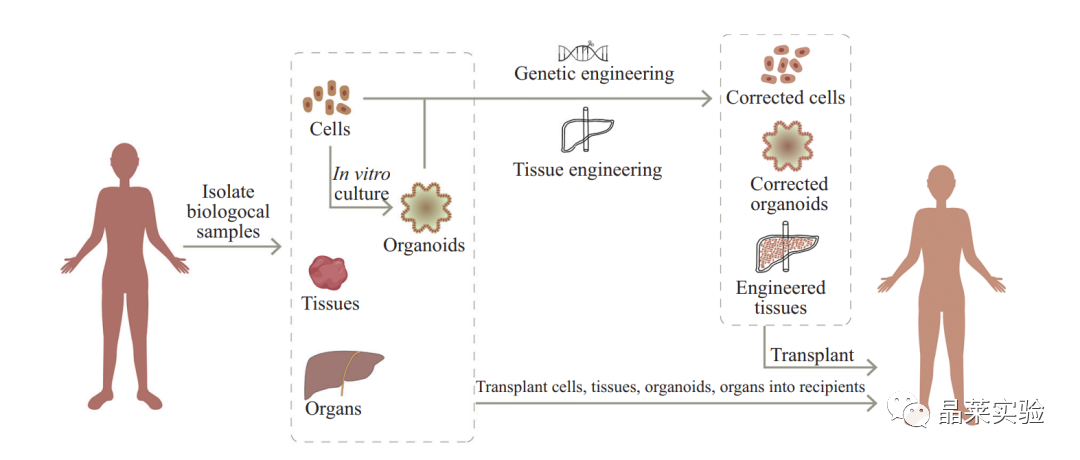
细胞、类器官及器官移植物等在再生医学中的应用
(在再生移植物中, 细胞、组织和器官可以直接从供体分离获得, 类器官可以通过细胞的体外培养获得。细胞、类器官、组织和器官都可作为 移植物用于再生医学。同时, 通过与基因编辑和生物工程技术相结合改造后的细胞和类器官也可用于再生移植。)
通过丰富与完善类器官模型, 提高 类器官模型的复杂程度, 寻找最优化的移植体系, 研究移植物与宿主环境之间相互作用的机制, 明确适 于进行移植的人群范围以及寻找最优的移植部位, 这些将会有助于我们提高移植的成功率, 促进移植 物在宿主体内再现正常的生理功能, 切实改善与恢 复目标组织器官的功能。
多种类器官模 型的建立为再生医学提供了新的移植物来源, 目前 已有肠道、肝脏、视网膜、胰腺、皮肤、肾脏等多 种类器官模型被应用于再生医学领域。
多种多样的类器官模型的建立为再生移植 时移植物的选取提供了新的选择。
5. 肿瘤研究
常见的肿瘤类器官来源有二,一是肿瘤组织直接培养(肿瘤干细胞属于成体干细胞);二是来源于经基因编辑技术处理的诱导多能干细胞(induced pluripotent stem cell,iPSC)培养成的肿瘤类器官模型。
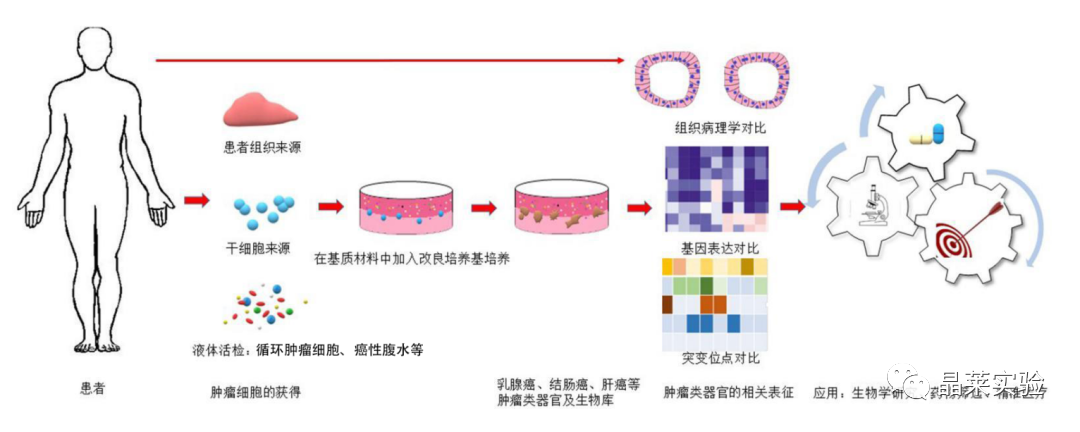
研究表明从肿瘤组织中建立类器官的方法,具体流程为:获取手术切除组织后,首先去除癌组织中的脂肪及肌肉组织,其次根据组织特点选用胰蛋白酶(和)或胶原酶对组织进行消化,细胞悬液过细胞筛网后用基质胶重悬,最后点注到培养板上并添加相应培养基进行后续培养。
培养基的成分根据不同癌种特点而有所差异,通常都以 DMEM/F12为基础,同时包含以下4类因子:Wnt信号通路激剂、酪氨酸受体激酶的配体、TGF-β信号通路抑制剂和 ROCK 抑制剂。在类器官研究过程中,可以通过传代整个培养皿、使用较早代的类器官和减少传代次数等方式来避免发生克隆漂移。
iPSC 的肿瘤类器官模型的产生效率取决于肿瘤类型以及该肿瘤是否存在特定的致癌突变,且大概率会导致选择性的肿瘤亚克隆生长和肿瘤遗传异质性的丧失,通常只用于研究特定基因突变在肿瘤发生、发展中的作用。
而直接由肿瘤组织培养形成的肿瘤类器官可保留肿瘤异质性,比涉及基因编辑的 iPSC 类器官培养似乎更为实用,来源于肿瘤组织的类器官保持了亲本肿瘤的遗传特性,在肿瘤研究中更有个体代表性。
肿瘤研究应用
① 机制靶向研究:类器官为肿瘤发生的研究提供了平台。感染性病原体,如幽门螺旋杆菌、肠炎沙门氏菌、肝炎病毒和人乳头瘤病毒(humanpapillomavirus,HPV)等,被公认为相应肿瘤发生的高危因,然而其致癌机制尚不明确。利用类器官与病原体共培养可模拟从感染到肿瘤形成和发展的过程,可能有助于揭示致病机制,寻找潜在的抗肿瘤靶点。
② 临床前药物评价:目前药物疗效的研究多在2D肿瘤模型、PDTX中进行,由于缺乏肿瘤异质性以及存在物种差异,大多数药物在体内和体外,甚至不同体外模型中表现出不同的药物敏感性。肿瘤类器官在预测患者治疗反应方面具有较高的准确性。
多种肿瘤类器官在临床药物筛选中表现出巨大的潜力,肿瘤类器官与患者的药物反应一致,可用于预测患者治疗反应,填补了传统临床前模型在明确药物疗效方面的缺陷。随着类器官芯片技术的发展,已经出现包含肝脏、心脏和肺类器官的集成系统,该类系统能够同时对多个3D组织类器官的药物代谢效率和毒性进行评估。
③ 建立活体肿瘤类器官生物样本库(Biobank):利用肿瘤类器官生物样本库可建立更全面的肿瘤发生发展谱。与 PDX 模型比较,类器官培养周期短,体外培养可长期扩展、冻存复苏,且可进行高通量的检测(药物筛选),建立肿瘤类器官生物样本库,可灵活取用分析其中多样的肿瘤类器官,更有利于进行肿瘤分子学背景与肿瘤生物学行为(如临床病理特征、药物反应或耐药关系等)模式分析,促进肿瘤精准治疗发展。
类器官具有在体外模拟真实器官三维结构、细胞组成和功能的特性,使其在生物医学和再生医学领域 拥有广阔的应用前景。作为突破性前沿技术,类器官在器官移植领域的应用仍处于初步的、待研究开发的状态,虽已有诸多类器官移植的积极数据,但距离大规模临床应用仍较远,需要整个领域的不断努力探索。













