动物模型 | 急性肺损伤模型构建及评价
时间:2022-10-24 阅读:2958急性肺损伤( ALI) 是以急性进行性呼吸衰竭为特征的一种常见且死亡率高的临床综合征。
图片来源于网络
ALI时,急性全身性炎症反应可引起微血管损伤,使肺血管和上皮的通透性增加,蛋白质和富含炎性细胞的液体流入肺泡腔,导致非心源性肺水肿,气体交换肺泡‒毛细血管减少,进而导致低氧性呼吸衰竭及 ARDS。
临床上表现为胸闷气促、呼吸困难、进行性低氧血症,影像学上可表现为肺渗出性改变。目前 ALI 的病死率仍相当高,为29%~42%。
ALI的动物模型建立,可依据其病因分为内毒素诱导的 ALI模型、输血模型、物理撞击模型、呼吸机模型,以及缺血再灌注模型,此外还有缺氧模型、免疫反应模型等。
所用动物最常用的为小鼠、大鼠、白兔等小动物模型,也有狗、羊、猪等大动物模型。
1. LPS诱导的ALI
该模型主要用于模拟临床中由于革兰阴性杆菌引起的肺损伤,如各种脓毒血症等,在脓毒血症患者中 ALI 的发病率和病死率分别高达40.2%和30%~85%。也常用于临床上感染性休克所致肺损伤的研究。内毒素( lipopolysaccha-rides,LPS) 感染居肺损伤危险因素的首位。
模型构建举例:
实验动物 | 动物周龄/体重 | 实验方法 |
小鼠 | 7周龄的雄性小鼠,在小鼠8周龄时对其进行处理 | 将小鼠吸入异氟醚进行麻醉,实验组小鼠经气管注入 20 μg LPS及 50 μL无菌生理盐水的混合溶液,对照组小鼠只注射50 mL无菌生理盐水,观察比较2组的肺损伤程度。 |
小鼠 | 8~10周龄、体质量 20~23 g 的小鼠 | 小鼠腹腔注射氯胺酮+甲苯噻嗪进行麻醉,实验组和对照组分别用10 μg LPS及无菌磷酸盐缓冲液滴鼻,比较2组肺损伤程度。 |
犬 | 13.75~14.65 kg的雄性犬 | 对照组静脉输注 0.9% 的生理盐水,肺损伤组先静脉输注0.9% 的生理盐水,30 min 后静脉注射 LPS (1 mg/kg),10 min后再静脉输注0.9%的生理盐水。 |
羊 | 37~48 kg的 3岁非孕母羊 | 麻醉后在 4 h内静脉注射剂量递增的LPS来诱导ALI。 |
2. 输血所致急性肺损伤动物模型
输血所致急性肺损伤(transfusion-related acute lunginjury,TRALI)十分常见。当输血后 6 h内急性发作,及OI<300 mmHg,胸部X线摄片可见肺部双侧浸润改变,无体液性肺水肿迹象,且无其他 ALI 危险因素时,即可以高度怀疑TRALI。
模型构建举例:
① 供体鼠选择250 g雄性大鼠,麻醉后使用含有柠檬酸盐‒磷酸‒葡萄糖的注射器收集血液,离心分离出血小板以供输注,在 30 min内向受体鼠输注供体血液。
② 研究表明,单克隆抗体(monoclonal antibody,mAb)可诱导 TRALI类似症状,实验选用 6~12周的雄性小鼠,通过尾静脉注射不同浓度混有mAb的磷酸缓冲盐溶液(phosphate buffer saline,PBS)模拟小鼠TRALI模型。
3. 钝性撞击下的ALI动物模型
临床上创伤导致的 ALI 又称肺挫伤。尽管其严重程度并不高,但其发病率相当高,且患者往往合并肋骨骨折、全身多处骨折、胸腔积液、肺不张等合并症。
肺挫伤对患者的呼吸功能有一定影响。因此,在ALI动物模型的建立中,钝性撞击的模拟非常重要。
模型构建举例:
钝性胸部创伤(blunt chest trauma,BCT)的小鼠 ALI 模型。将 250~300 g 的大鼠外周注射苯巴比妥钠麻醉,取其仰卧位固定于平板上,四肢用胶带固定,将一圆柱状金属分别从不同高度自由坠落至大鼠右胸侧 (防止心肌损伤)。
4. 机械通气导致ALI动物模型
机械通气造成的肺损伤,是。由于机械通气后肺泡成分反复关闭、复张甚至肺泡张力过高导致肺组织易于受到 机械压力或张力的影响而受到损伤。尽管机械通气监护提示气道压力和相关通气 机械参数尚在正常范围内,其中有些肺泡受到物理牵拉力量已经超过肺泡的弹力。
从而通过破坏肺泡和血管内皮细胞和上皮细胞使其通透性增加引起蛋白质和水 分的渗漏导致肺水肿,参与通气的肺组织减少,从而引起低氧血症,我们称之为 呼吸机诱导的肺损伤(Ventilator-induced lung injury,VILI)。
模型构建举例:
腹腔注射 3% 的戊巴比妥钠 40 mg /kg 麻醉小鼠,采取仰卧位固定后,在颈部正中切口使气管暴露,切开气管,将 24 G 留置针缓缓置入并固定,接小动物呼吸机行机械通气( 通气 频率 80 次/min,VT 40 ml /kg,FiO2 21% ,I ∶ E = 1 ∶ 2) ,持续机械通气 4 h 后处死小鼠,收集样本检测。
通过”ELISA“进行检测炎症因子含量。
各组小鼠炎症因子( BALF 中 TNF-α、IL-1β 和 IL-18 )含量比较
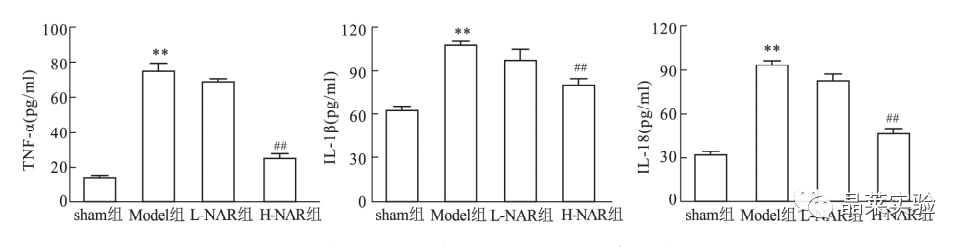
假手术组 ( sham 组) 、机械通气模型组( Model 组)
低剂量组( L-NAR 组)、高剂量组( H-NAR 组)
与 sham 组比较: ** P < 0. 01; 与 Model 组比较: ##P < 0. 01。
5. 缺血‒再灌注所致ALI动物模型
在肺移植、休克、肺栓塞、肺袖状切除术后等情况下,ALI的发病率非常高,而其发病机制主要为肺的缺血‒再灌注 (ischemia reperfusion,IR),因此动物实验中缺血‒再灌注模型是使用较多的一种方法。
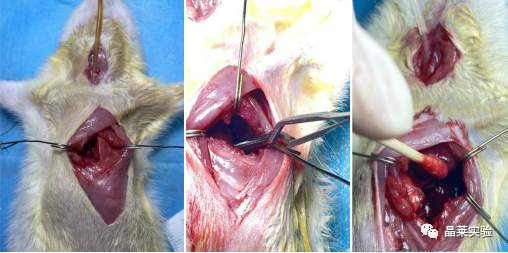
模型构建举例:
① 鼠模型:选用210~250 g的大鼠,通过外周注射戊巴比妥钠麻醉,实验组对大鼠行开胸手术后将小鼠左侧肺门夹紧1 h,再松开1 h,并观察左肺的膨胀不张的程度,确保肺缺血再灌注的充分进行;对照组只接受开胸手术并不进行肺门夹闭。
② 兔模型:动物模型选取3~5 kg 的新西兰家兔,麻醉后行右心室切开术,在肺主动脉处插入一根输入导管,在左心房处插入一根输出导管,然后结扎上下腔静脉和主动脉,使心肌缺血,将兔进行肝素化处理后经右心室导管灌注 300 mL自体血,左心房插管用于监测血压。
6. 化学因素致ALI动物模型
盐酸制造 ALI 小鼠模型:
鼠模型:选用 10~12 周龄 25~30 g 的小鼠,腹腔麻醉后气管内注射等渗盐酸溶液,再进行肺损伤评估。
兔模型:选用2.7~3.2 kg的成年雄性家兔,静脉注射戊巴比妥钠进行麻醉,实验组气管内注射 pH=1.5 的盐酸溶液诱导 ALI,对照组只注射同等剂量的无菌生理盐水。
7. 肺泡灌洗型
ALI 常伴随肺泡表面活性物质( pulmonary surfactant,PS) 减少,PS减少引起肺损伤发生机制主要为肺泡萎陷、肺不张、肺水肿,造成严重的肺内分流,并使肺的顺应性下降。
用等渗盐水反复灌注肺同样可引起 PS 减少。该模型主要用于 PS 替代治疗以及肺表面活性物质缺乏的 ALI 中的研究,PS在维持肺泡功能方面起重要作用,PS主要由Ⅱ型肺泡上皮细胞分泌产生,它一直被认为是在肺泡清除液体中起关键的作用。
灌洗液经常使用 37 ~ 39 ℃的等渗盐水,有时候会加用低浓度的清洁剂,进一步使肺泡的表面活性剂失活,操作时一般使动物呈仰卧位,但为了在整个肺中能获得统一均匀的肺损伤水平,也有一些研究者们把动物从仰卧位变换为俯卧位或两肺轮流灌洗。在个别案例中,为了能够在个体中达到参考对照,肺损伤只在单侧肺中被诱导。
8. 油酸模型
油酸模型常用来复制临床中脂质栓塞引起的肺损伤,尤其是临床中常见的长骨干骨折引起的脂肪栓塞,油酸引起的 ALI 是目前制备动物 ALI 较为成功的模型,与临床急性呼吸窘迫综合征(ARDS) 患者最为类似,因此成为目前国内外公认的 ARDS 动物模型。
油酸直接损伤肺泡毛细血管内皮细胞膜可能是最主要发生机制,其次还可进而通过氧化应激反应、促凝血活性增高以及内皮素等促进肺损伤反应。
研究表明,油酸既可通过增加内皮细胞的通透性,也可阻断钠通道从而促进肺泡内和肺泡间隙液体的积聚,这 2 种因素都对 ARDS 的发生起促进作用。
在动物模型中,油酸模型可分别通过股静脉导管或肺动脉导管注入油酸至中心静脉或右心房而诱导,大鼠或小鼠通常通过腹腔静脉注入,也有的实验是通过颈内静脉,家兔通常为耳缘静脉注入,为确保肺内压不会突然升的过高常用缓慢滴注法,因此油酸注射时应用自动定时的注射器或间隔几秒的时间注射。
除了等渗盐水外,无水或高浓度乙醇和新鲜动脉血浆也可被用来作为油酸的溶液。
9. 其他因素致ALI动物模型
缺氧诱导 ALI模型:利用氯气制造缺氧致ALI小鼠模型。利用还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶 (NOX) 缺陷的小鼠制造缺氧性 ALI 模型。
此外还有使用博来霉素制造小鼠药物致ALI模型的案例。
活菌致肺损伤模型:制备活菌致肺损伤实验动物模型常使用雾化吸入或直接将活菌灌入鼻腔、气管或支气管等方法。
评估肺损伤程度可使用组织病理学、肺泡灌洗液及血液中炎性介质浓度、微 CT成像、血气分析、肺干/湿比、肺泡液体清除率等方法。
① 肺损伤组的肺组织病理学表现为肺泡间质性水肿、肺泡壁厚度增加、中性粒细胞数量增多、肺组织斑块状出血。其病理学表现随损伤程度加重而更加明显。
② 研究表明,在 ALI 时中性粒细胞及巨噬细胞募集增多,在伤后 48 h最为敏感;各种炎症因子如 IL-1β、NLRP3、NF-κB、IF-1α、TNF-α等均有不同程度的升高,其中尤以 IL-1β最为敏感;而肺泡细胞相关蛋白质浓度也可以作为评估肺损伤程度的指标。
③ 研究表示,微CT扫描显示急性肺损伤动物肺密度较对照组明显增加,肺三维重建图像可以生动地显示出肺损伤的区域和程度,可以看出 ALI 动物的肺容量明显减少。
④ 肺水肿是肺损伤时的重要表现之一,肺伤组的肺干/湿比显著降低,且肺损伤程度越高,肺干/湿比越低。
⑤ 在肺损伤时,动脉血氧分压可有不同程度下降。但其结果受影响因素较多,因此只能作为参考而不是诊断的指标。
⑥ 当肺泡损伤时,AFC 可下降。研究表明,AFC在伤后前2 d呈显著下降趋势,在伤后第二天到达最低点,而后可缓慢升高。
在疾病动物模型的研究中,应明确研究目的,结合适用性和实用性两个方面进行考虑,谨慎选择相应模型。













