国自然热点细胞自噬研究之 “MicroRNA-34c-5p引发异丙肾上腺素- 通过调节诱导心肌肥厚 通过靶向ATG4B进行自噬”
时间:2022-08-15 阅读:2426MicroRNA-34c-5p provokes isoprenalineinduced cardiac hypertrophy by modulating autophagy via targeting ATG4B
MicroRNA-34c-5p引发异丙肾上腺素- 通过调节诱导心肌肥厚 通过靶向ATG4B进行自噬
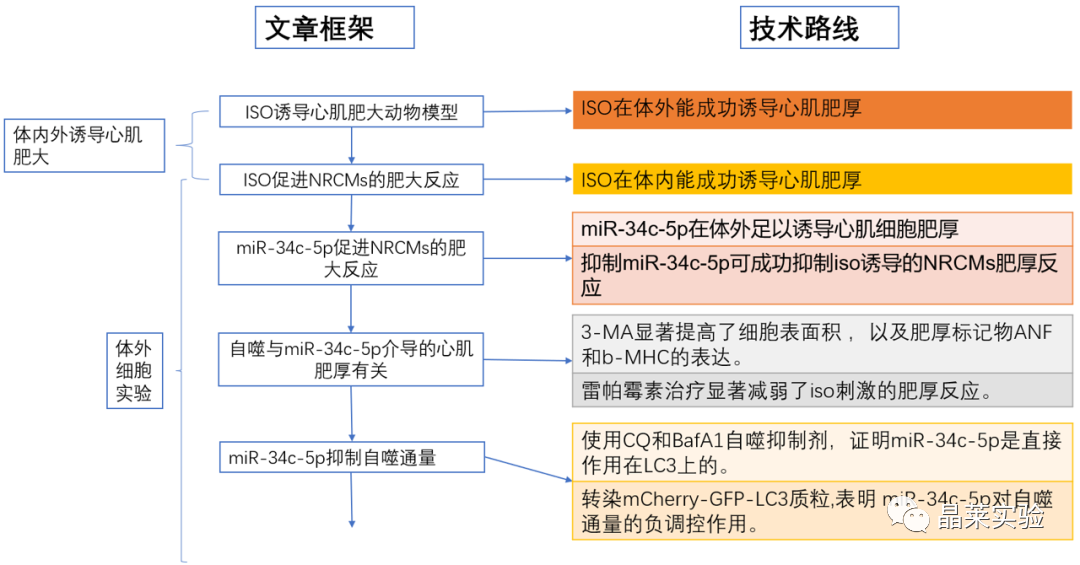
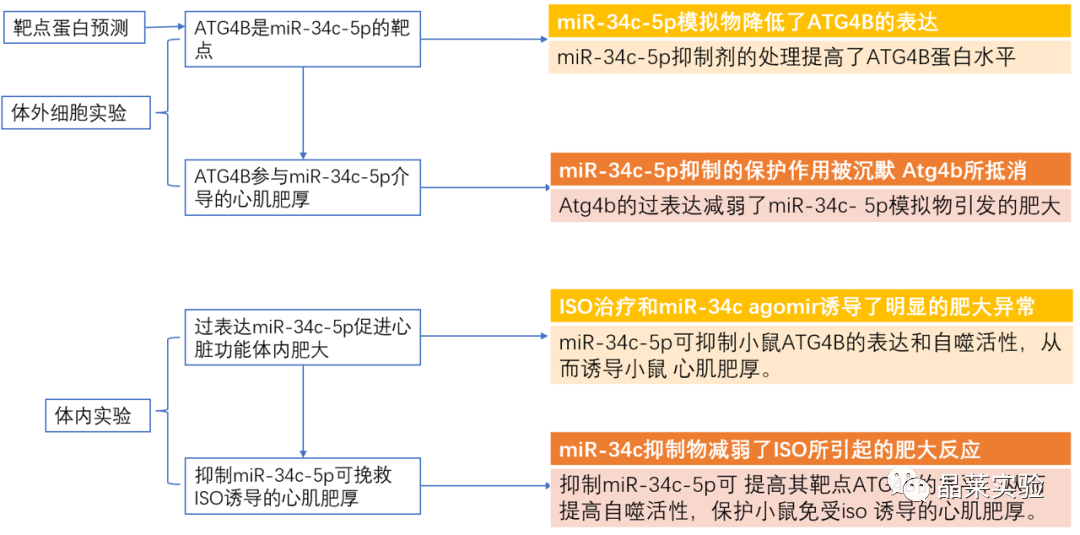
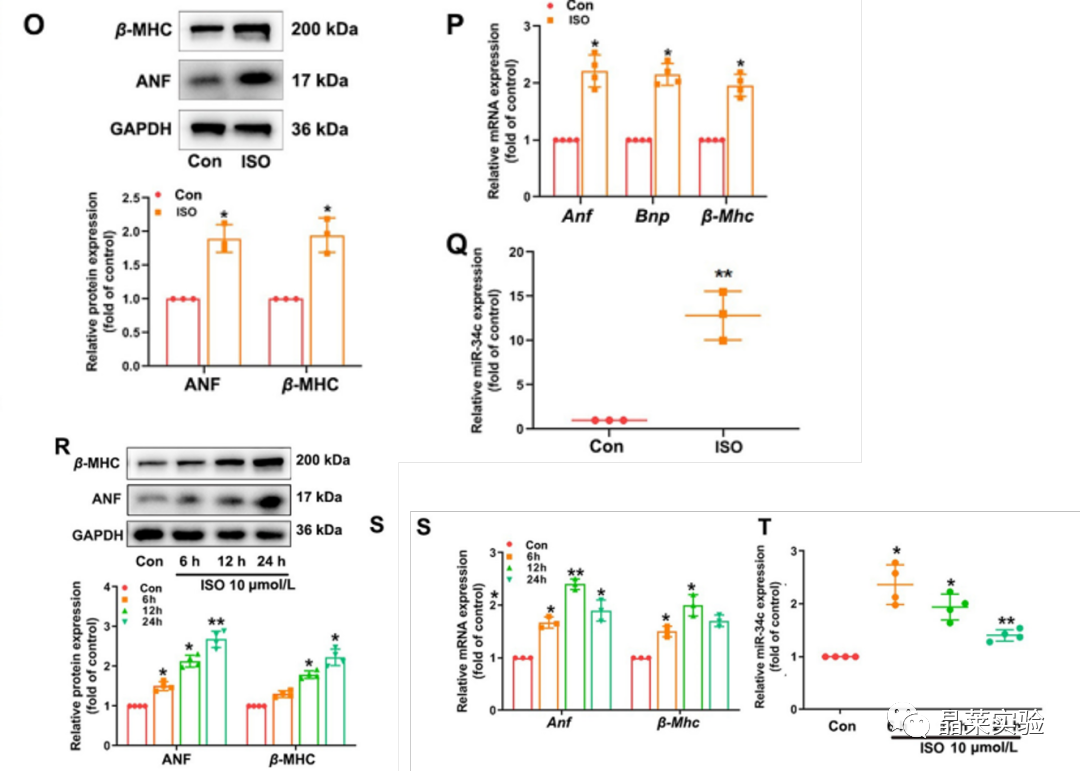
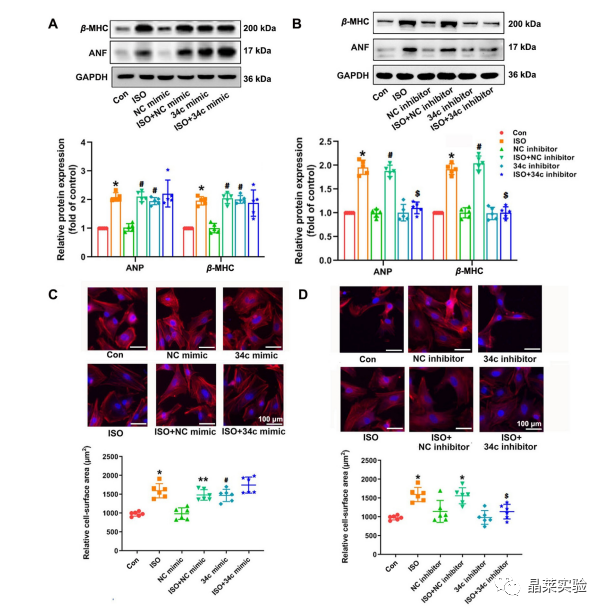
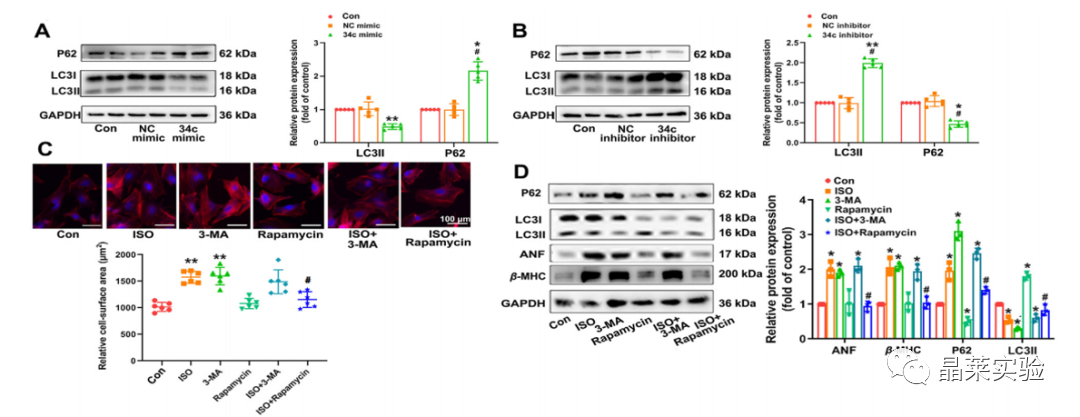
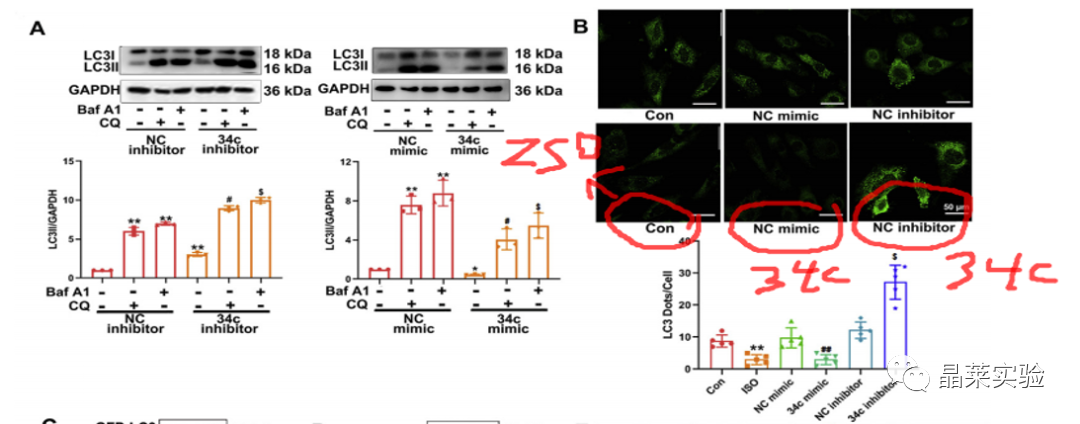
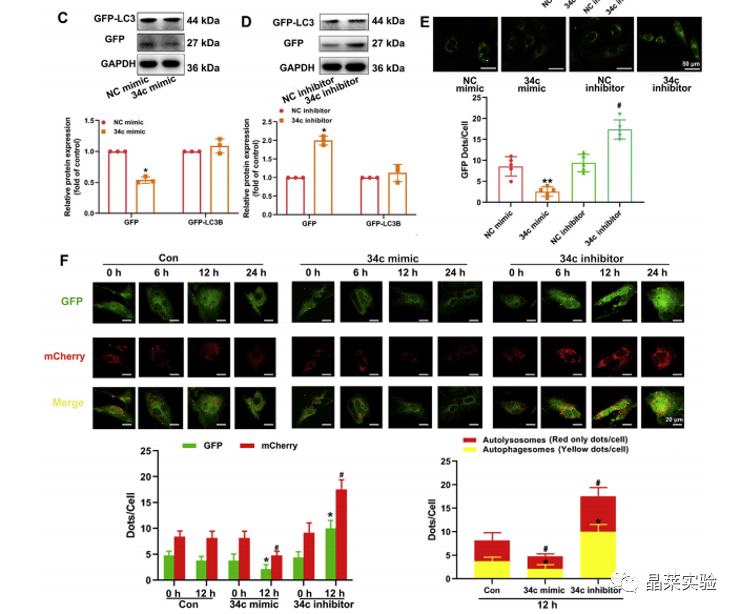
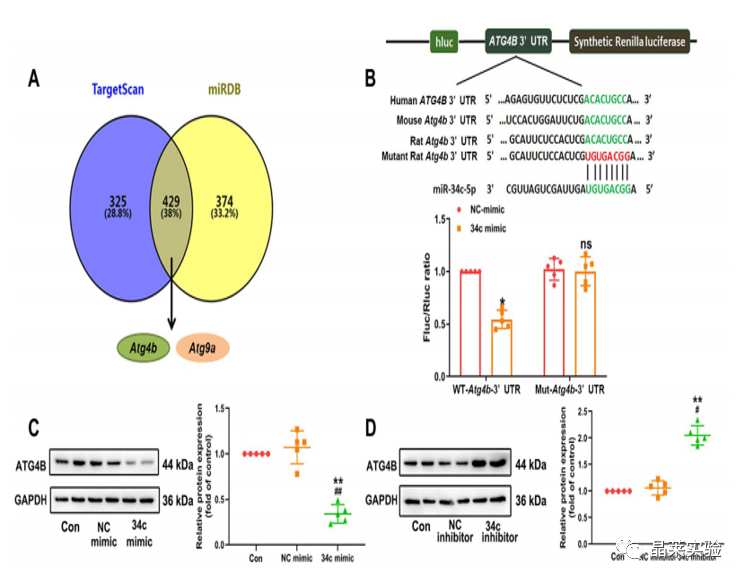
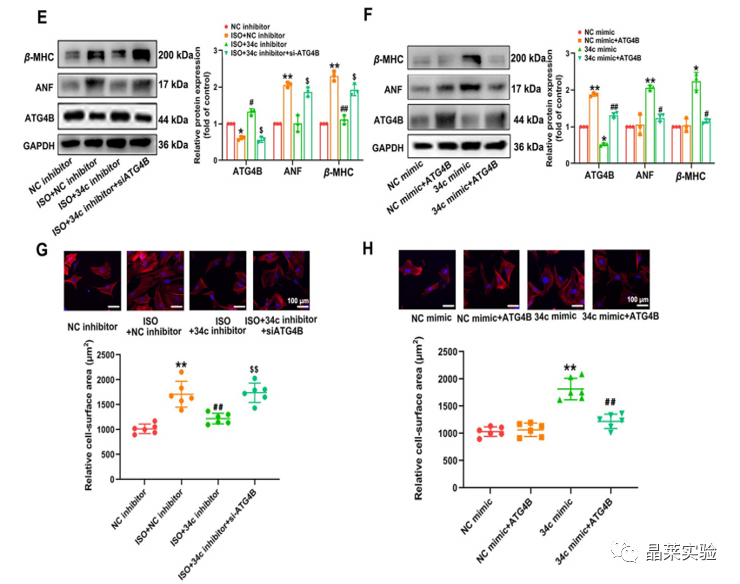
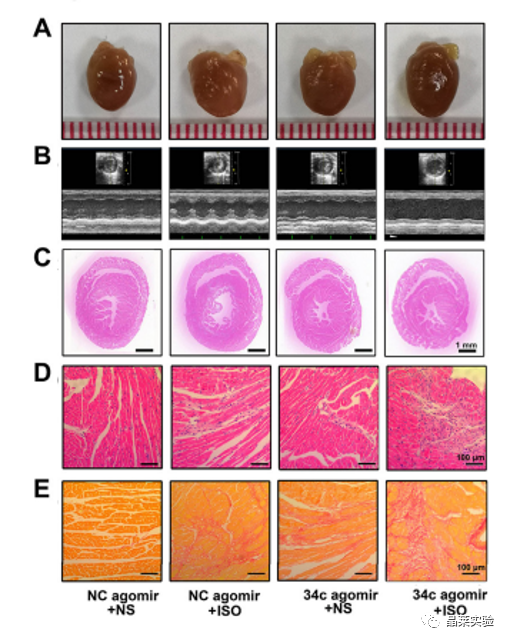
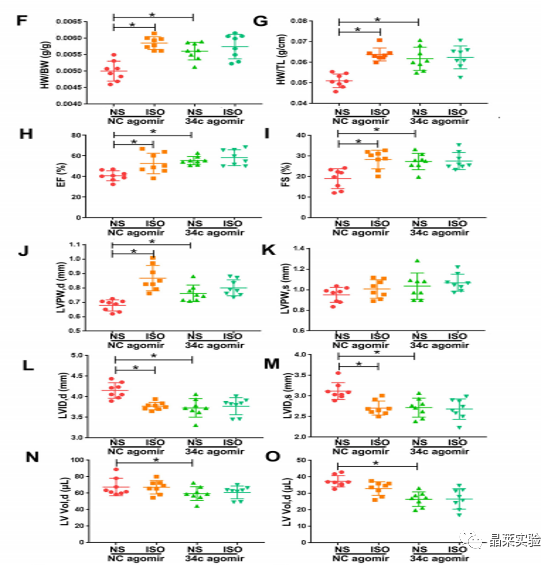
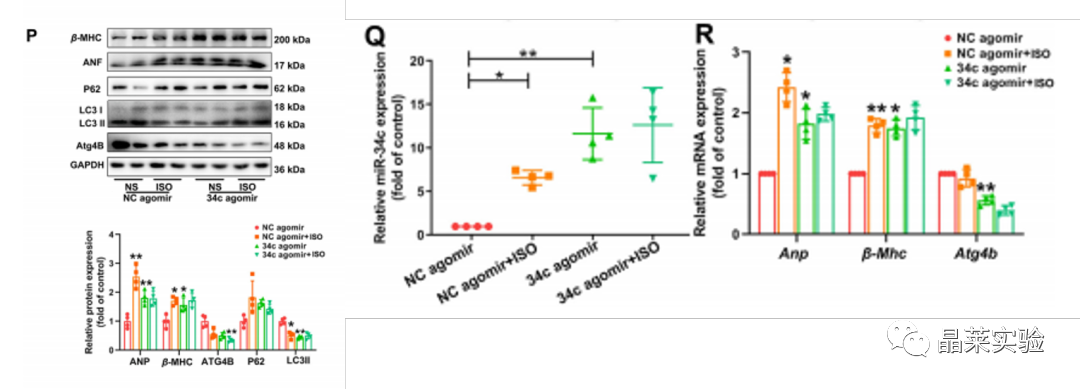
期刊名称 Acta Pharmaceutica Sinica B 期刊简称 APSB 最新影响因子 14.9 研究背景 病理性心肌肥厚( cardiac hypertrophy)是以心肌细胞增大、细胞骨架重组、胎儿型基因表达增加为特征,是心脏应对心肌应激的适应性过程。心肌肥厚持续性发展会成为心肌衰竭,导致死亡和残疾率非常高。近年来,越来越多的证据证实心肌细胞自噬在调节心血管疾病中起着关键作用。自噬失衡已被证明参与了心血管疾病的进展。越来越多的研究表明,自噬在心肌细胞中起着有益的作用,而抑制自噬会引起心肌肥厚。自噬的适度激活可以保护心脏免受最初的心肌肥厚进展,而过度自噬对心脏稳态的恶化影响也有报道。 MicroRNA (miRNA)是一种小的非编码RNA(长度≈22个核苷酸),通过阻断mRNA翻译或诱导mRNA不稳定和随后的降解参与RNA沉默。心力衰竭患者显示出独特的 miRNA谱,一些miRNA的表达可能作为心血管疾病的生物标志物。此外,一些研究表明,miRNAs参与介导心肌肥厚和心力衰竭的过程,循环miRNAs被认为是心力衰竭的潜在诊断和预后生物标志物。最近,我们进行了Illumina深度测序,异丙肾上腺素(ISO)治疗的大鼠心脏中miR-34家族成员miR-34b/c显著升高。对miRNA靶点的计算预测表明,miR-34c-5p与自噬相关基因4B(Atg4b)的mRNA之间可能存在一个互补的种子区域,这是自噬过程的关键调控因子。 本研究表明,miR-34c-5p为在培养的心肌细胞和接受ISO治疗的小鼠心脏中显著增加,并伴有肥厚反应。 此外,miR-34c-5p可以通过靶向ATG4B抑制自噬活性,刺激iso诱导的心肌肥厚,这可能为自噬和miR-34c-5p在心 肌肥厚和心力衰竭发病机制中的参与增加新的认识。 研究科学问题 miRNA-34c-5通过靶向ATG4B调节自噬参与了ISO诱导的心肌肥厚。 主要研究内容 1.ISO诱导的心肌肥厚增加了miRNA-34c-5p的表达 2.miR-34c-5p促进NRCMs的肥大反应 3.自噬与miR-34c-5p介导的心肌肥厚有关 4.miR-34c-5p抑制自噬通量 5.ATG4B是miR-34c-5p的靶点 6.ATG4B参与miR-34c-5p介导的心肌肥厚 7.过表达miR-34c-5p促进心脏功能体内肥大 8.抑制miR-34c-5p可挽救ISO诱导的心肌肥厚 文献框架&技术路线 文献框架&技术路线 1.ISO诱导的心肌肥厚增加了miRNA-34c-5p的表达 ① 大体形态学检查、PSR染色、HE染色 、WGA染色和代表性超声心动图显示为典型的肥厚性改变,包括 心肌细胞外基质胶原沉积和炎症细胞浸润。 ② 使用 ISO治疗还增加了心脏重量与体重(HW/BW)和心脏重量与胫骨长(HW/TL)的比值。并通过升高EF、FS、LVPW和IVS而诱发心脏结构和功能异常。 ③ ISO灌注小鼠心肌组织中肥大标志物ANF和b-MHC的蛋白和mRNA水平显著升高。 ④ 在培养的NRCMs中,ISO刺激(10mmol/L24小时)也导致ANF和b-MHC表达显著升高。 这些结果表明,ISO在体内和体外均能成功诱导心肌肥厚。 2.miR-34c-5p促进NRCMs的肥大反应 与NC模拟组相比,miR-34c-5p模拟转染的NRCMs中心肌肥厚标志物ANF和b- MHC水平显著升高。 综上所述,miR-34c-5p在体外足以诱导心肌细胞肥厚,而抑制miR-34c-5p可成功抑制iso诱导的NRCMs肥厚反应。 3.自噬与miR-34c-5p介导的心肌肥厚有关 在miR-34c-5p模拟物刺激后,P62表达升高,LC3-II表达被抑制,而miR-34c-5p抑制剂则表现出相反的作用,表明miR-34c-5p可以调节自噬活性。 3-MA,一种自噬的高选择性抑制因子。显著提高了细胞表面积 ,以及肥厚标记物ANF和b-MHC的表达。 Rapamycin,一种雷帕霉素,用于诱导自噬。雷帕霉素治疗显著减弱了iso刺激的肥厚反应。 4.miR-34c-5p抑制自噬通量 CQ处理导致LC3-II的积累,在miR-34c-5p模拟物存在时 ,LC3-II的减弱。当使用BafA1时,也发现了类似的结果。这些数据表明,miR-34c-5pmimic抑制了LC3-II的形成,从而在溶酶体抑制阻断自噬通量时,LC3-II聚集减少。相反,在CQ或BafA1处理的细胞中,与NC抑制剂相比,miR-34c-5p抑制剂仍能促进 LC3-II水平,这表明miR-34c-5p抑制通过促进LC3-II的形成来促进自噬。 在转染了GFP-LC3质粒的NRCMs中,我们发现miR-34c-5p模拟物有效地降低了GFP-LC3斑点和解离性GFP蛋白的表达。相比之下,miR-34c-5p抑制剂则明显诱导 了GFP-lc3斑点和解离性GFP蛋白的表达。 5.ATG4B是miR-34c-5p的靶点 由TargetScan和miRDB预测的具有保守的miR-34c-5p结合位点的转录本的数量。 miR-34c-5p的预测结合位点和突变结合位点的示意图Atg4b的UTR。 在NRCMs中,miR-34c-5p模拟物降低了ATG4B的表达,而 miR-34c-5p抑制剂的处理提高了ATG4B蛋白水平。 这些结果证实了ATG4B是miR -34c-5p的直接靶点。 6.ATG4B参与miR-34c-5p介导的心肌肥厚 ISO治疗引起心肌细胞肥大,而miR-34c-5p抑制剂可挽救心肌细胞肥大。然而,miR-34c-5p抑制的保护作用被沉默 Atg4b所抵消。 Atg4b的过表达减弱了miR-34c- 5p模拟物引发的肥大标志物表达和细胞表面积的增加。 这些发现共同提示ATG4B参与了mir-34c-5p介导的心肌细胞肥 大。 7.过表达miR-34c-5p促进心脏功能体内肥大 ISO治疗和miR-34c agomir诱导了明显的肥大异常,包括心脏大小增大,心肌结构紊乱,细胞间空间减少,通过HE和PSR染色检测到显著的胶原沉积。 8.抑制miR-34c-5p可挽救ISO诱导的心肌肥厚 形态学和组织学分析显示,miR-34c抑制物减弱了ISO所引起的肥大反应和相关的病理变化。 在ISO输注后,miR- 34c-5p抑制物抑制心肌组织中ATG4B和LC3-II的含量增加,而P62和肥大标志物的水平降低。 这些结果表明,抑制miR-34c-5p可 提高其靶点ATG4B的水平,从而提高自噬活性,保护小鼠免受iso 诱导的心肌肥厚。 文献结论 在本研究中,miRNA-34c-5通过靶向ATG4B调节自噬在ISO诱导的心肌肥厚发挥重要作用,且miR-34c-5p的调节可能是治疗心肌肥厚的潜在策略。 文献总结 创新点: 1.进行了生物信息学分析,并预测ATG4B为miR-34c-5p的下游效应因子。 2.通过分离自噬过程精准定位到miR-34c-5p抑制自噬通量整体变化。 不足: 1.如果心肌肥厚是由ISO以外的其他刺激引起的,如血管紧张素II或压力过载,是否也能得到类似的结果尚不清楚。 2.单个 miRNA可能调节广泛的转录本。我们仍然不能排除除ATG4B外的其他靶点可能参与miR-34c-5p的促肥厚作用。 可延伸点: 可以增加心脏特异性ATG4B过表达或缺失的动物来观察心肌肥大现象可以进一步验证实验结果 文献涉及实验技术 关于晶莱 晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。

与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。














