
时间:2026-01-30浏览次数:157
在过去的几个世纪里,肿瘤的概念已经从一个异常增殖细胞的简单聚集演变成一个高度组织的“器官”。构成肿瘤的各种成分被称为肿瘤微环境,在肿瘤发生发展过程中,包括但不限于巨噬细胞、DC、中性粒细胞、B细胞、T细胞、CAF等多种细胞被招募到肿瘤细胞周围的微环境中,与ECM等元素共同构成TIME。
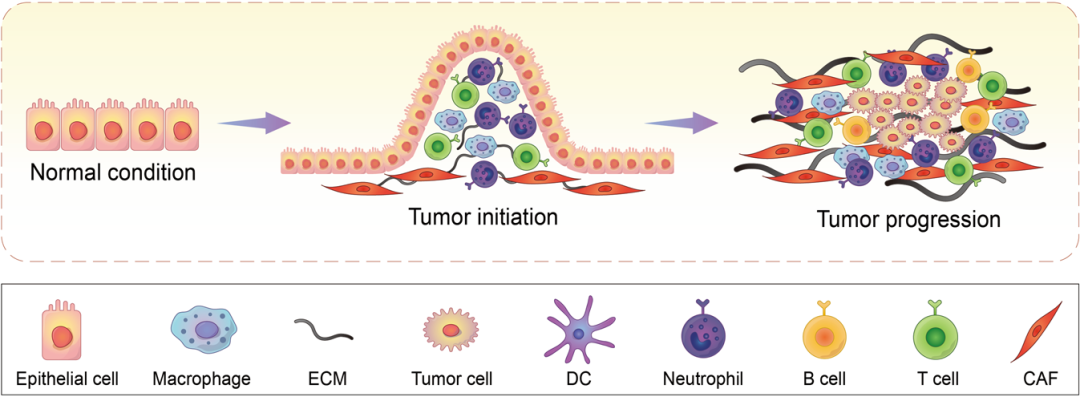
肿瘤免疫微环境的分类
TIME可根据细胞毒性T淋巴细胞(CTL)浸润程度分为三种类型:
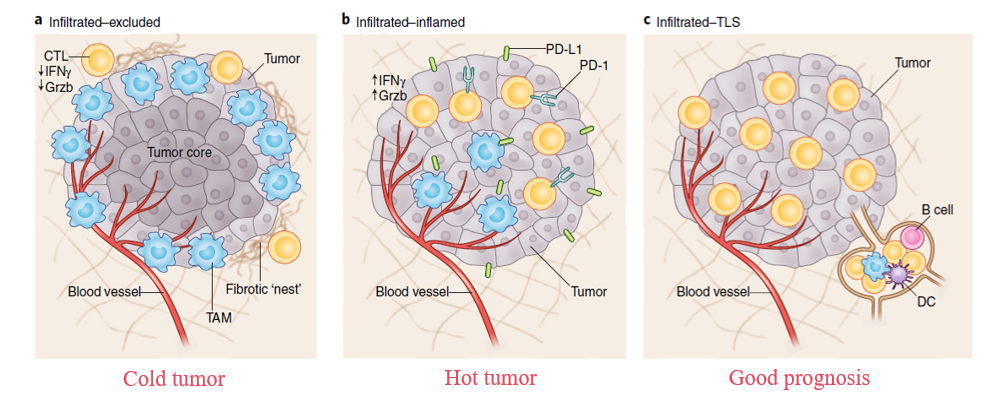
Cold tumor:I-E TIMEs 免疫细胞数量丰富,但细胞毒性T淋巴细胞(CTL)无法有效进入肿瘤核心区域,主要集中在肿瘤边缘或被困于纤维化巢状结构中
Hot tumor:I-I TIMEs的肿瘤内部大量浸润活跃的CTL,且伴有免疫抑制性分子(PD-L1)高表达,表明它们曾经被激活但已进入“疲劳”状态,肿瘤细胞通过PD-L1抑制T细胞功能
Good prognosis:TLS-TIMEs具有明显的三级淋巴结构(TLS),这些结构功能类似于淋巴结,包含丰富的免疫细胞群体。TLS的存在通常与良好预后相关,反映了局部免疫活化和抗肿瘤反应的潜力。
肿瘤免疫微环境的特征
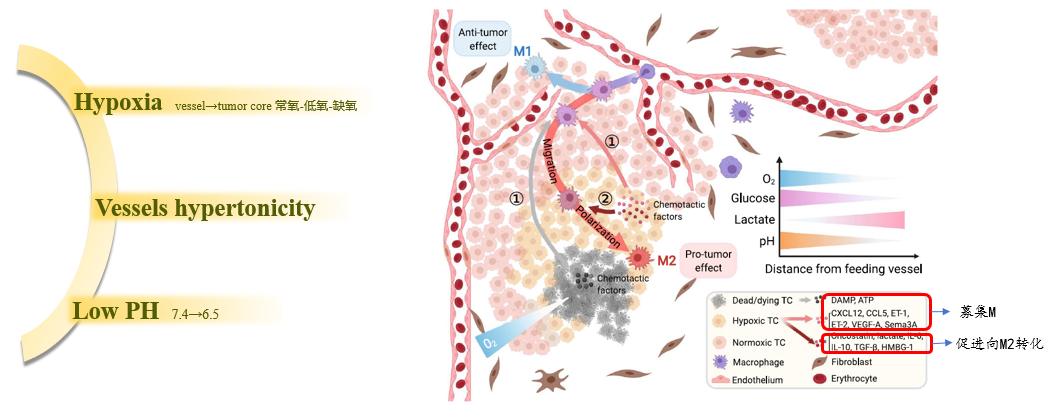
细胞呼吸是细胞代谢和生存的基础,氧气在细胞呼吸过程中具有长期不可替代的作用。氧梯度是距离血管长远的理想标志,并与其他胞外非特异性物质通过代谢直接或间接地密切相关。此外,氧合的改变及其后续结果被深入纳入肿瘤的生物转化,如血管生成、进展和坏死。肿瘤细胞的快速增殖超过了氧气和营养供应,随后导致血管生成。新生血管的特征是血管壁结构异常,分布不平衡,功能不成熟,导致供氧不足和不平衡。
免疫抑制肿瘤微环境的特征
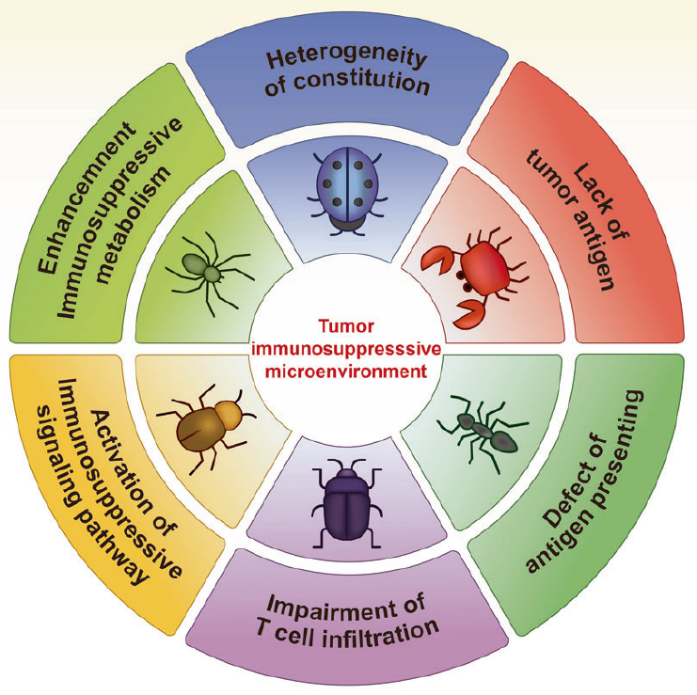
除了ICPs, TIME在很大程度上决定了癌症免疫治疗的疗效。免疫抑制肿瘤微环境的几个特征及其对当前癌症免疫治疗的影响可以总结如下:
1. 机体的异质性(TIME中细胞浸润不同,ICB响应不同)
2. 肿瘤抗原的缺乏(减少最具免疫原性抗原的表达)
3. 抗原提呈细胞的缺陷(抑制DC渗透,因子如IL6负调控)
4. T细胞浸润的损(T细胞的转运可能受到肿瘤区新生血管灌注和氧水平异质性的影响,CAFs使基质浓度变硬抑制T细胞浸润)
5. 免疫抑制信号通路的激活(FAK, Hedgehog signaling 可引起T细胞功能紊乱)
6. 免疫抑制代谢的增强(乳酸引起T cell功能紊乱)
TIME中各细胞群在癌症进展中发挥不同作用
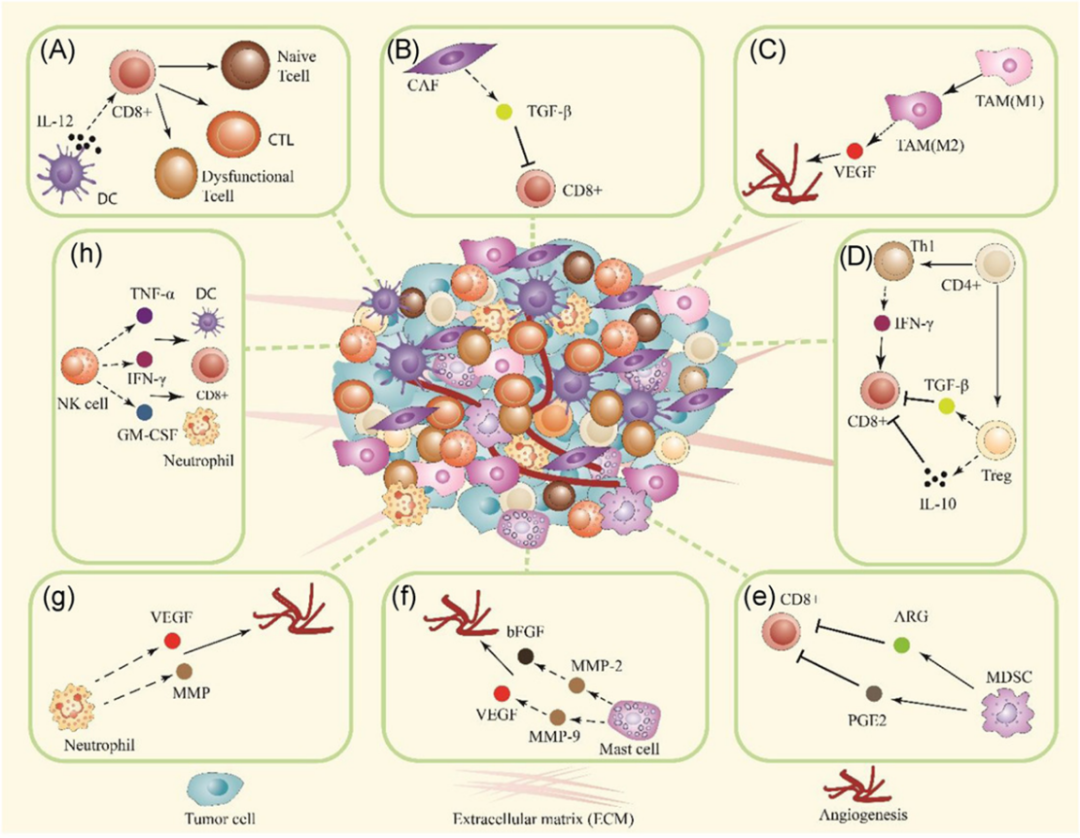
1. DC通过分泌IL‐12支持T细胞效应功能和分化信号。
2. CAF分泌TGF‐β可抑制CD8+ T细胞浸润。
3. 在TME内,TAM主要由M2巨噬细胞组成,这是致瘤性的。TAM (M2)通过分泌VEGF促进血管生成。
4. CD4+ T细胞可分别通过分化为Th1和Treg发挥免疫激活或免疫抑制作用。Th1释放如IFN‐γ诱导CD8+ T;而Treg释放IL‐10和TGF‐β抑制CD8+ T功能的发挥免疫抑制活性。
5. 髓源性抑制细胞(MDSC)通过增加前列腺素E2 (PGE2)和精氨酸酶(ARG)的水平来抑制CD8+ T反应。
6. 肥大细胞可以通过分泌某些蛋白酶(如基质金属蛋白酶2 (MMP‐2)和MMP‐9)以及从ECM释放VEGF和成纤维细胞生长因子(bFGF)来促进血管生成发展,从而促进肿瘤进展。
7. 中性粒细胞也能够通过分泌VEGF和MMPs促进血管生成。
8. NK细胞可以通过分泌促炎细胞因子,包括IFN - γ、肿瘤坏死因子- α (TNF - α)和粒细胞/单核细胞集落刺激因子(GM - CSF),诱导先天和适应性免疫反应。
嵌合抗原受体 T 细胞(CAR-T)免疫疗法作为肿瘤治疗领域的颠覆性技术,在血液系统恶性肿瘤中已展现出突破性疗效,但其向实体瘤的拓展仍受限于肿瘤微环境复杂性、靶点特异性不足等挑战。CAR-T 疗法的开发涉及 T 细胞分选、激活扩增、基因修饰及功能评估等多环节,对免疫表型、细胞因子谱及信号通路的精准解析是优化治疗方案的核心。Luminex 悬浮液相芯片技术凭借高通量多参数检测能力,为 CAR-T 研究中的复杂生物学指标分析提供了高效解决方案,成为连接基础研究与临床转化的关键工具。
Luminex 技术的原理与核心优势
(一)技术原理
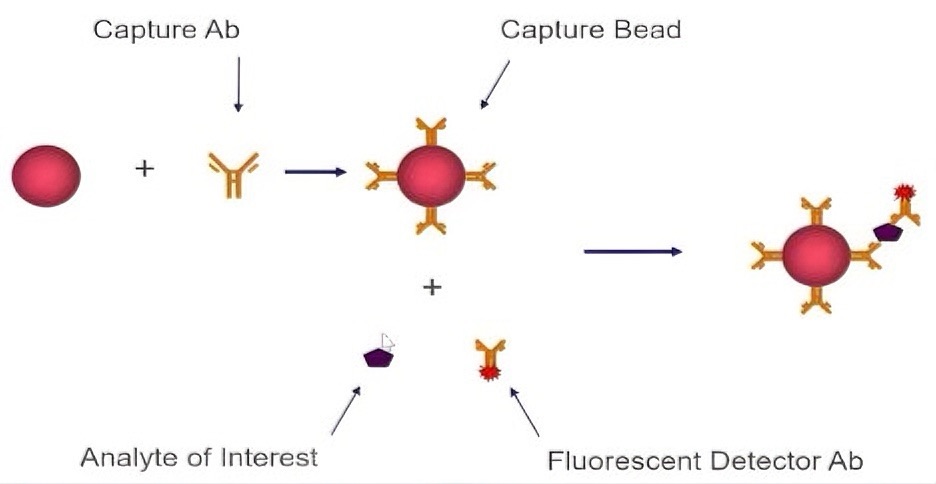
悬浮液相芯片 Luminex 技术原理:基于荧光编码微球在液体中与目标分子结合,实现多重检测。
Luminex 技术基于荧光编码微球与流式检测的整合,核心机制包括:
荧光编码微球:采用两种荧光染料按比例混合形成 100 种独特编码微球,每种微球包被特异性抗体,可识别特定靶分子;
三明治免疫反应:样本与微球孵育后,靶分子与抗体结合,再加入荧光标记的检测抗体形成复合物(如图);
双激光检测:一束激光识别微球编码(确定检测指标),另一束激光定量荧光信号(反映靶分子浓度),实现单一样本中多指标同步分析。
(二)技术优势
高通量多参数分析:单一样本(25-50μL)可同时检测 100 种分析物,满足 CAR-T 研究中细胞因子、表面标志物等多指标联合分析需求;
高灵敏度与宽动态范围:检测下限达 pg 级,动态范围覆盖 4-5 个数量级,可同时量化高低丰度分子;
样本兼容性强:适用于细胞培养液、血清等多种样本类型,尤其适合体外扩增中少量样本的检测;
良好重复性:自动化流程确保批内 / 批间变异系数 < 10%,结果可靠性高。
在 CAR-T 细胞制备过程中的应用
(一)T 细胞分选的质量控制
T 细胞分选后的纯度与表型直接影响后续制备效率。Luminex 可同步检测 CD3、CD4、CD8 等表面标志物,快速验证:
分选后 T 细胞纯度(通常需 > 85%);
记忆性 T 细胞亚群(如 CD45RA⁺CD62L⁺中央记忆 T 细胞)比例,这类细胞因增殖能力强、持久性好,是 CAR-T 的理想来源。
通过多参数分析可优化分选方案,为后续基因修饰提供优质细胞原料。
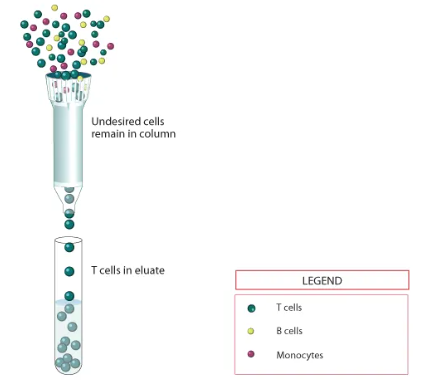
T细胞富集柱
(二)激活与扩增的动态监测
CAR-T 细胞的体外激活(如 CD3/CD28 抗体刺激)与扩增需通过细胞因子谱评估激活状态。Luminex 可同步检测:
促增殖因子(IL-2、IL-7、IL-15):反映 T 细胞增殖潜力;
效应因子(IFN-γ、TNF-α):指示细胞毒性功能;
免疫调节因子(IL-10、TGF-β):预警过度抑制或耗竭。
动态监测这些因子的浓度变化,可优化激活剂组合与培养时间,避免 T 细胞功能异常。
(三)基因修饰效率的评估
基因修饰(如慢病毒转导、CRISPR 编辑)效率是 CAR-T 功能的核心影响因素。Luminex 可通过检测:
CAR 蛋白表达水平(针对胞外标签的特异性抗体);
编辑相关标志物(如脱靶效应导致的炎症因子异常分泌),评估修饰的特异性与安全性。
对靶向敲除 PD-1 等免疫检查点的 CAR-T 细胞,可同步验证编辑效果。
在信号通路解析与实体瘤研究中的价值
(一)CAR 与 TCR 信号通路的差异分析
CAR 受体与 TCR 信号的差异是优化 CAR 设计的关键。Luminex 通过检测下游信号分子(磷酸化 ERK、AKT)及细胞因子谱,可对比:
CAR 与 TCR 激活后细胞因子分泌的异同(如 IL-2、IFN-γ 的分泌动力学);
共刺激结构域(4-1BB vs CD28)对信号通路的影响,为 CAR 结构优化提供依据。
(二)肿瘤微环境的复杂性解析
实体瘤的免疫抑制微环境是 CAR-T 疗效的主要障碍。Luminex 可多参数分析微环境样本:
免疫抑制因子(TGF-β、IL-10、VEGF)浓度;
免疫检查点分子(PD-L1、CTLA-4)表达水平;
基质细胞分泌的趋化因子(IL-6、CXCL12),揭示其对 CAR-T 浸润、存活的抑制机制。
这些数据为开发联合疗法(如 CAR-T 与 PD-1 抑制剂联用)提供靶点依据。
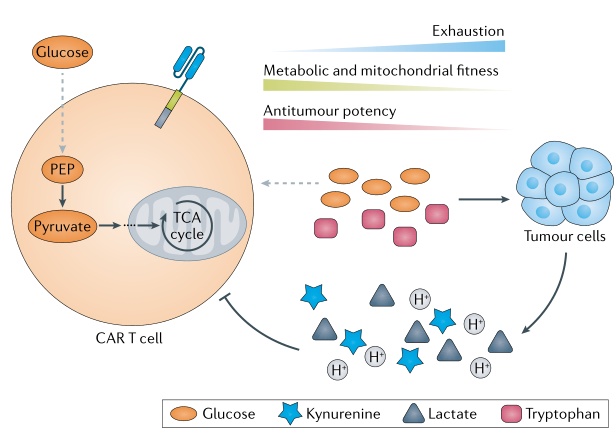
CAR-T细胞在肿瘤微环境中面临内源性和外源性代谢挑战
Luminex 悬浮液相芯片技术以其高通量、多参数、高灵敏度的特性,在 CAR-T 疗法研发中发挥着不可替代的作用。从细胞制备的质量控制到信号机制解析,再到实体瘤微环境研究,该技术为全面解析 CAR-T 细胞的生物学特性提供了全景视角,加速了从基础研究到临床转化的进程。未来,随着技术的持续优化,Luminex 将进一步推动 CAR-T 疗法的精准化发展,为攻克实体瘤等治疗难题提供关键支撑。
