
时间:2026-01-28浏览次数:116
细胞免疫荧光(Immunofluorescence, IF)是一种常用的技术,用于检测细胞内特定蛋白质或其他分子的分布和表达情况。分析细胞免疫荧光的结果涉及多个步骤,包括图像采集、图像处理、定量分析和数据解释。
细胞免疫荧光(IF)技术的核心的是抗原 - 抗体的特异性结合反应 —— 用荧光素标记的抗体作为 “探针”,精准识别细胞内目标抗原,再通过荧光信号可视化呈现抗原的定位、分布及表达水平。该技术兼具高特异性与空间分辨率,是蛋白定位研究、疾病标志物检测的核心手段。
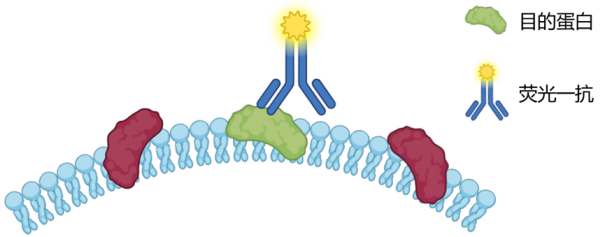
将荧光素直接标记在特异性一抗(即识别目标抗原的抗体)上。实验时,用这种标记好的一抗直接与样本中的目标抗原结合,洗涤后即可在显微镜下观察荧光信号。其优点是流程简单快捷、背景干扰低;而缺点则是灵敏度相对较低、灵活性差、抗体选择有限。
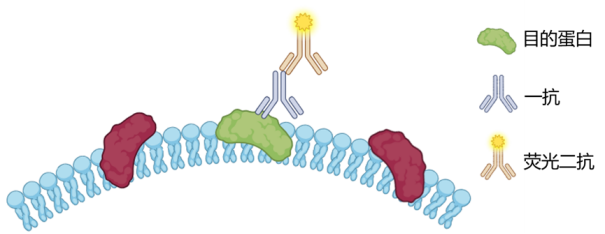
02.间接法
使用未标记的特异性一抗先与抗原结合,再用荧光素标记的二抗去识别并结合一抗,二抗是针对一抗物种来源(如兔、鼠)的抗体,最终通过二抗上的荧光素产生信号。其优点是灵敏度高、抗体选择范围广,缺点是流程较长、背景风险较高。
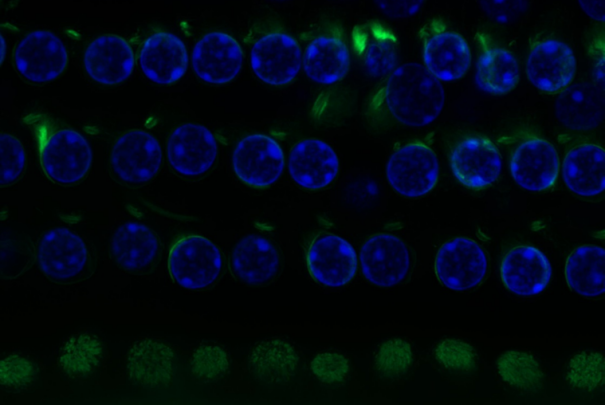
1、细胞准备 ◆ 将细胞接种在含爬片的培养板中,培养至 70% 融合度。(也可用玻璃培养皿进行样品制备;(尽量避免使用塑料培养器皿进行样品制备,而导致成像扭曲、像差和背景杂光,无法获得高分辨率、高清晰度的图像)。 2、清洗及固定(防止目标蛋白在后续步骤中扩散、流失或降解) ◆ 去除培养基,沿器皿侧壁加入PBS润洗细胞2-3次,请勿用PBS直冲细胞,以免造成细胞脱落; ◆ 加入 4% PFA 固定液,室温固定 10-20 分钟; ◆ 固定好的样片用PBS清洗3次,每次5分钟。 3、通透(抗体能够进入细胞内部) ◆ 用 0.1%-0.5% TritonX-100 溶液透化细胞,室温孵育 10 分钟。通透时间通常为5 ~ 20 min。(该步骤可选;通透步骤会破坏细胞膜,细胞膜表面抗原不适合选择通透实验)。 ◆ 通透后的样本用PBS清洗3次,每次5分钟; 4、封闭(减少一抗/二抗与非特异性抗原位点的结合,减少背景染色) ◆ 加入1%-5% 的 BSA(牛血清白蛋白)溶液,室温孵育 60 分钟; ◆ 封闭结束可直接孵育一抗,无需再用PBS洗涤,目的是维持封闭环境,防止非特异性结合位点重新暴露。 5、一抗孵育(识别目的蛋白) ◆ 弃封闭液,加入含1% BSA的PBS配制的一抗,24孔板每孔可加入200-250ul,室温孵育2h,或4℃保湿过夜孵育; ◆ 孵育结束后,用 PBS 洗涤 3 次,每次 5 分钟。 注:孵育的一抗可以重复利用,收集到干净的离心管,低温避光保存即可。 6、荧光二抗孵育(识别一抗,二抗上带有荧光团用于后续的荧光显微镜观察) ◆ 采用抗体工作液稀释荧光标记的二抗,细胞加入二抗溶液,室温避光孵育1小时; ◆ 孵育后,用PBST(0.1%Tween)清洗样片,清洗3次,每次5分钟;(PBST是使用可以更好的去除未结合的二抗,可以降低背景信号)。 7、细胞核染色(为目的蛋白做定位参照及反应细胞状态) ◆ 10ml PBS加入1ul DPAI原液,室温孵育 5-10 分钟,避光操作; ◆ 用 PBS 再次洗涤 2-3 次,每次 5 分钟。 8、封片(防止荧光淬灭) ◆ 在载玻片上滴加适量封片剂,采用弯头尖镊将细胞爬片倒扣在载玻片上,使细胞接触到封片剂; ◆ 小心覆盖盖玻片,避免形成气泡; ◆ 封片后,样本可以在避光低温条件下保存,建议尽快进行显微镜观察。 9、荧光显微镜观察(目的蛋白可视化) ◆根据不同的荧光染料,选择不同波段的激发光,DAPI为蓝色,488通道为绿色。
注意事项
◆ 信号弱或无:一抗失效/稀释过度;固定过度(PFA固定时间太长);通透不足;二抗不匹配(一抗是鼠源,二抗则需要是抗鼠的)。
◆ 背景太高:封闭不充分;一抗浓度过高或非特异性结合;洗涤不彻底;二抗浓度过高;样本干燥等。
◆ 非特异性斑点:固定时产生沉淀;抗体聚集(使用前离心);细胞状态差,有死细胞。
◆ 定位不对:固定不当导致抗原移位(膜蛋白不需要固定步骤);错误使用甲醇固定膜蛋白。
◆ 荧光淬灭快:未使用防淬灭封片剂;曝光时间过长;封片时有气泡。
下一篇:免疫细胞迁移\浸润分析
