
时间:2026-01-07浏览次数:282
iPS细胞(诱导多能干细胞)是通过对成熟体细胞进行基因重编程,使其重新获得类似胚胎干细胞的分化能力的细胞技术。这项技术由日本科学家山中伸弥团队于2006年首次实现,因避免胚胎干细胞伦理争议且具有多能性和自体来源优势,成为再生医学、疾病模型研究和药物开发的重要工具。
一、iPS细胞的核心原理
iPS细胞的核心技术是通过向成熟细胞(如皮肤细胞或血液细胞)导入特定转录因子(如Oct4、Sox2、Klf4、c-Myc等),重新激活其多能性基因网络,使细胞“返老还童”至类似胚胎干细胞的状态。这一过程称为重编程。重编程后的细胞可在体外分化为人体几乎所有类型的细胞(如神经元、心肌细胞、肝细胞等)。
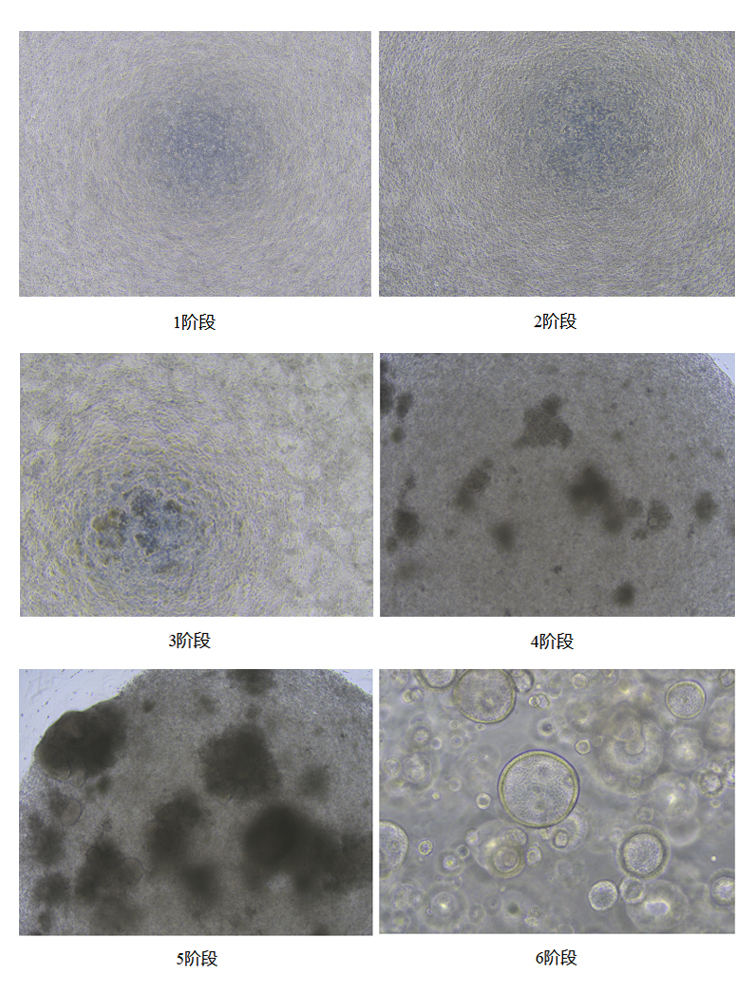
二、培养方法
1、hPSC分化为内胚层细胞(DE) (按6孔板1孔算)
(1)基质胶在4℃下解冻,与DMEM/F12均匀混合,铺板,备用。
(2)当hiPSC的汇合度达到75%-85%,吸去培养基,用2mL 1x室温PBS(不含Ca2+/Mg2+)清洗hiPSC,吸去PBS。
(3)加入1mL含Y-27632(10 μM)的室温Accutase,转移到37℃ 5% CO2细胞培养箱中20 min,使其解离成单细胞。
(4)20 min后,将hESC/iPSC 完全培养基以等体积直接加入Accutase中,并使用P-1000吸头轻轻上下吹打细胞,制成单细胞悬液,将细胞单悬液收集到15mL离心管中,室温下300 g离心5 min。
(5)从基质胶包被的板中小心地抽吸包被液而不损坏基质胶涂层表面。
(6)离心结束,充分去除上清,将1 mL预热的Advance 人多能干细胞完全培养基(含10μM Y-27632)重悬细胞,轻轻地上下移液以确保单细胞溶液均匀。
(7)使用自动细胞计数器计数细胞,使用台盼蓝排除死亡细胞,将密度为2.0 *105个细胞/mL的细胞接种到步骤1制备的6孔基质胶包被的板上,在6孔板中每孔最终体积为2 mL,将孔板转移到37℃、5%CO2细胞培养箱中孵育24h。
(8)24h后(第1天)吸去培养基,并加入1.97mL基础培养基1+10μL补充剂A+20μL补充剂B。
(9)在第2天和第3天,吸去培养基,加入1.98mL基础培养基1+20μL补充剂B,开始分化为内胚层细胞。
2、DE诱导分化为前肠内胚层细胞(AFE)
(1)第4天,从培养物中抽吸培养基,在6孔板中每孔用2 mL1x室温PBS(不含Ca2+/Mg2+)清洗培养物,然后从孔中移除PBS,每孔加入2 mL基础培养基2。
(2)将培养板放入37℃ 5%CO2培养箱中培养,每24h更换一次培养基,连续培养3天。
3、AFE诱导分化为肺祖细胞(LPC)(以12孔板4个孔为例)
(1)29.92mL基础培养基3+80μL补充剂C配成LPC诱导培养基
(2)第7天,从培养物中抽吸培养基,在6孔板中每孔用2 mL1x室温PBS(不含Ca2+/Mg2+)清洗培养物,吸去PBS。
(3)每孔加入1mL含Y-27632(10 μM)的室温Accutase,将培养物置于37℃ 5%CO2细胞培养箱中孵育10 min。
(4)10 min后每孔加入1mL DMEM/F12(含10μM Y-27632),轻轻吹打细胞,使细胞脱离孔底。
(5)将细胞悬液收集到15 mL离心管中,室温下300 g离心5 min。
(6)仔细抽吸上清液,不干扰细胞,用1mL恢复室温的LPC诱导培养基(含10μM Y-27632)重悬细胞,轻轻地上下移液以确保单细胞溶液均匀。
(7)使用自动细胞计数器计数细胞,使用台盼蓝排除死亡细胞,将密度为2.0 x105个细胞/mL的细胞接种到提前制备的12孔基质胶包被的板上,在12孔板中每孔培养基最终体积为1 mL。
(8)第二天,更换为不含Y-27632的LPC诱导培养基。每隔一天更换培养基,持续11天。
4、LPC诱导分化为3D肺类器官(以24孔板6个孔为例)
(1)第18天,14.965mL基础培养基4+35μL补充剂D配制成3D类器官诱导培养基
(2)在冰上解冻基质胶,并将移液器吸头提前置于-20℃冰箱中。
(3)吸出LPC诱导培养基,用1 mL1xPBS(不含Ca2+/Mg2+)洗涤1次。
(4)加入含10μM Y-27632的室温Accutase(0.5 mL/12孔)并在37℃、5% CO2培养箱中孵育10 min;10 min后每孔加入1mL恢复室温的DMEM/F12(含10μM Y-27632),轻轻吹打细胞,使细胞脱离孔底。
(5)将细胞悬液收集到15 mL离心管中,室温下300 g离心5 min。
(6)仔细抽吸上清液,不干扰细胞,用1mL 3D类器官诱导培养基重悬细胞,轻轻地上下移液以确保单细胞溶液均匀。
(7)使用自动细胞计数器计数细胞,使用台盼蓝排除死亡细胞。
注意:每个细胞系必须优化细胞数量;在分化的18天内,细胞不应变得过度融合。
(8)室温下以300 g离心5 min,吸出培养基并将细胞重悬于冷基质胶中,对于ESC,每孔4.0*104个细胞添加200μL基质胶,对于iPSC,每孔 8.0*104个细胞,添加200 μL基质胶,将基质胶与细胞一起置于冰上。
(9)将200μL基质胶/细胞混合物按每孔30μL接种到24孔板中。
(10)将板置于37℃、5%CO2培养箱中20-30分钟使基质胶凝固。
(11)每孔加入700μL 3D类器官诱导培养基,并每隔一天更换培养基,持续6天。
(12)在第23天,14.96mL基础培养基5+40μL补充剂E配制成3D类器官分化培养基,将孔里的培养基更换为700μL恢复室温的3D类器官分化培养基,每隔一天更换培养基,持续6天。
(13)在第29天,199.48mL基础培养基6+520μL补充剂F配制成3D类器官成熟培养基,将孔里的培养基更换为700μL恢复室温的3D类器官成熟培养基,每隔一天更换培养基,进行长期培养。
5、3D肺类器官传代
(1)取出冷冻的基质胶置于4℃解冻,并提前将枪头放置在-20℃预冷1h;
(2)吸除培养基,加入1mL预冷的类器官传代消化液,静置1min;
(3)使用1mL移液枪,吹打孔中混合物40-50次,注意:不要产生气泡;
(4)每孔加入1mL预冷的PBS,将混合物转移到15mL离心管中;
(5)用1mL预冷的PBS清洗培养板,并将该清洗液加入上一步的离心管中,并补充预冷的PBS,使离心管中的终体积为12mL;300g离心5min,去上清;
(6)用预冷枪头按每孔30μL的量在离心管中加入适量的基质胶,吹打5-8次,均匀混合单细胞-基质胶,注意吹打过程中避免产生气泡;
(7)将提前放在培养箱中的24孔板取出,在孔中心位置加入30μL胶滴,缓慢打入混合液时,逐渐向上移动枪头,使细胞均匀分布在胶中;
(8)将培养板放在培养箱中,20-30min,使胶滴凝固;
(9)小心沿孔壁加入700μL恢复室温的3D类器官成熟培养基,每隔1天换液一次(可周一、周三、周五换液,周五可添加至800μL,周六、周日不换液),注意:不要碰到胶滴,将孔板放到培养箱中,继续培养。
上一篇:IPS诱导脑类器官
下一篇:IPS/ES类器官培养
