
时间:2026-01-06浏览次数:170
使用肿瘤细胞系或原代肿瘤细胞,构建一个以肿瘤细胞为核心的均质球体模型。
实验说明:
1. 模型局限性:仅模拟肿瘤细胞团块,无法反映肿瘤微环境的复杂性,可能错误评估药物效果。
2. 技术假象风险:球体中心可能因营养/氧气渗透不足而出现坏死,干扰药效评估。
3. 批间差异性:原代细胞构建的模型,其大小、密度和生长速度可能存在批次差异。
以小肠组织为例
实验材料
1、 仪器设备
CO2 培养箱、双人单面超净台、倒置显微镜、台式冷冻离心机、水浴锅、水浴摇床,医用冰箱、-80°冰箱、移液器(一套)、眼科剪、眼科镊。
2、 试剂耗材
肠癌类器官培养试剂盒,基质胶,60mm细胞培养皿,100μm滤筛,15ml离心管,1.5ml EP管若干,4度冰盒,眼科剪刀,眼科镊。
实验方法
1、原代
(1)将组织放入含有特殊组织保存液F的组织取样瓶中放入冰盒4℃,拍照并登记信息。
(2)取样瓶消毒,组织放入培养皿,结直肠癌类器官缓冲液A清洗三次后于培养皿中剪碎,大约1mm3的组织块。
(3)癌组织用organo原代酶解液C消化,37℃震荡消化10-20 min,(消化过程中随时观察消化情况)加入三倍体积organo原代酶终止液E终止消化。
(4)使用100μm孔径的筛网进行过滤,取少量滤液在镜下进行观察,可以看到明显的组织块,将滤液收集后于300g富集离心3-5min后移去上清,重新重悬离心。
(5)去除上清,使用适量基质胶(abs9495)进行重悬(24孔板为例,每孔30ul)之后进行铺板(4℃下操作)拍照追踪定位。
(6)将铺好的板子放入37℃培养箱中10-15min成胶,添加培养基B(恢复室温)进行培养。
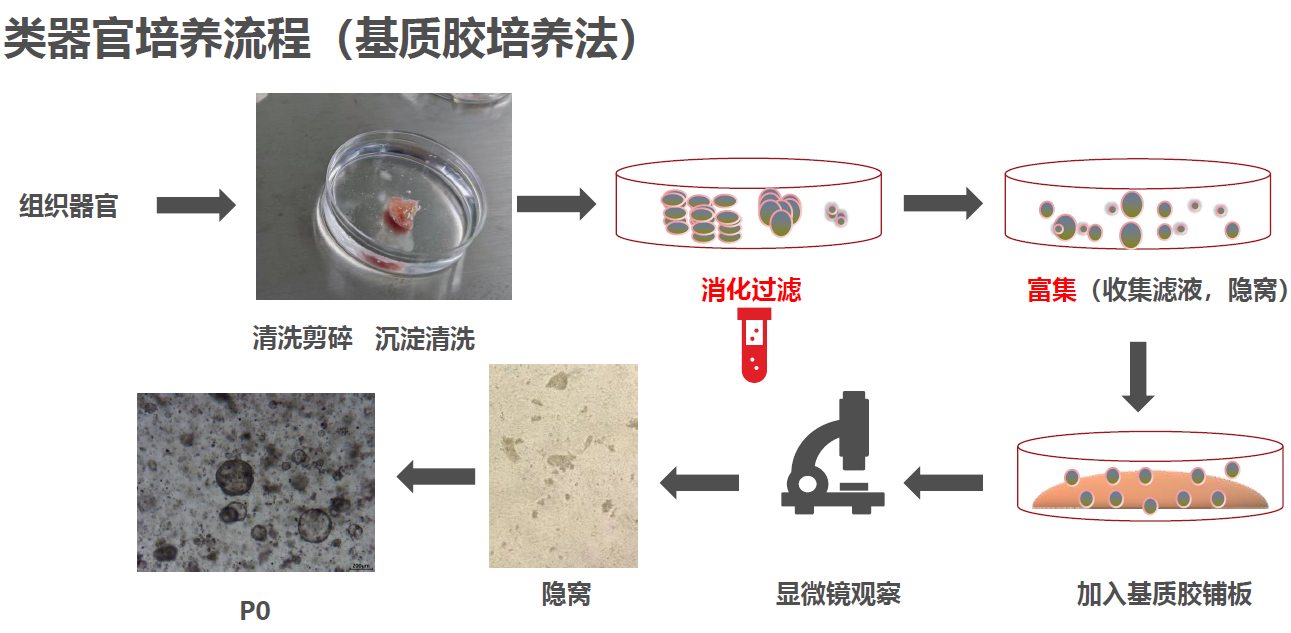
2、类器官传代培养
(1)移液器吸去培养基,添加4℃类器官缓冲液A放置一分钟。
(2)移液枪轻柔吹打基质胶,收集在15ml离心管中,4℃静置5min。(3)离心5min弃去液体,添加适量类器官缓冲液A重悬移入1.5ml离心管,300g离心5min弃去液体或(添加适量消化液D作用90-120S终止,离心5min弃去混合液)。
(4)类器官收集后,添加适量类器官冻存液G,按500个/ml密度冻存(或进行步骤5)。
(5)类器官收集后,基质胶重悬,每孔30μl基质胶铺在24孔板中,放置培养箱中10min添加500μl结直肠癌类器官培养基B。
3、冻存
(1)在传代第二步,添加冻存液
(2)500个/ml 密度冻存,温度梯度降温-80度,保存
4、类器官复苏
(1)取10ml于15ml离心管中。
(2)从液氮罐中取出冻存的肿瘤类器官细胞,快速置于 37℃水浴锅中融解。
(3)水浴融解过程中,需轻轻摇动冷冻管,以确保冻存液在 1-2 分钟内完全融解。
(4)将溶解后的类器官细胞快速转移至15ml 无菌离心管,使用移液管轻轻吹打3次,300g 离心 3分钟,然后除去上清液并收集类器官细胞沉淀。添加适量结直肠癌类器官缓冲液A重悬移入1.5ml离心管300g离心5min。
(5)基质胶重悬,每孔20μl基质胶铺在24控板中,放置培养箱中10min添加500μl结直肠癌类器官培养基B。
5、鉴定
类器官的鉴定主要有形态学观察、基因分析、标志物检测、组织学染色这几种手段。
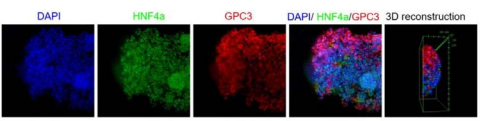
6、药敏
(1)药物准备阶段(药物种类、浓度)。
(2)在传代基础上接种到96孔板上,加药,牌照。在药物活性第5天检测细胞活性。
上一篇:乳腺类器官
下一篇:人表皮类器官模型构建
