
时间:2026-01-09浏览次数:291
结直肠癌(Colorectal Cancer,CRC)是一种起源于结肠或直肠的癌症,通常始于良性息肉,并逐渐演变为恶性肿瘤。它具有高度的遗传异质性,涉及多种基因突变(如APC、KRAS、TP53等),这些突变共同促进了肿瘤的发展和扩散。值得注意的是,CRC并不是单一类型,而是可以根据基因表达的不同模式(即基因表达谱)进一步细分为多个分子亚型。每个亚型都有其独特的基因变异和表达特征,这导致它们在生物学行为、疾病进展以及对治疗的响应方面存在显著差异。尽管目前综合性治疗可使晚期患者的中位总生存期达到30个月,但整体死亡率依旧较高。为了更好地理解各分子亚型的特点并开发更有效的治疗策略,研究人员利用从患者手术切除的原发性CRC组织构建类器官模型,以模拟体内环境,进行高通量药物筛选来识别针对特定亚型的有效疗法。
CRC是由大肠内表面上皮细胞的恶性转化引起,培养的CRC类器官实质就是癌变的肠上皮组织,与正常结肠类器官的培养方式相似。另外,针对正常结肠组织类器官的培养基只需稍加修改即可适用于CRC类器官的扩增。与正常结肠类器官不同的是,超过94%的CRC病例中WNT/β-catenin已被持续性激活,因此Wnt3A条件培养基对于CRC类器官来说不是必要的,并且WNT信号的缺失有助于抑制正常组织在CRC类器官培养基中生长。
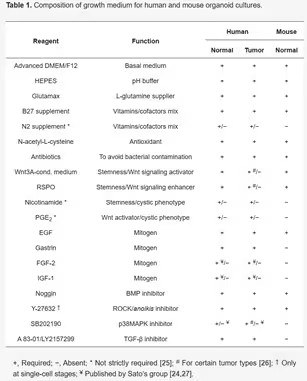
人和小鼠类器官培养基成分对比
基于文献整理的CRC类器官的构建方法:
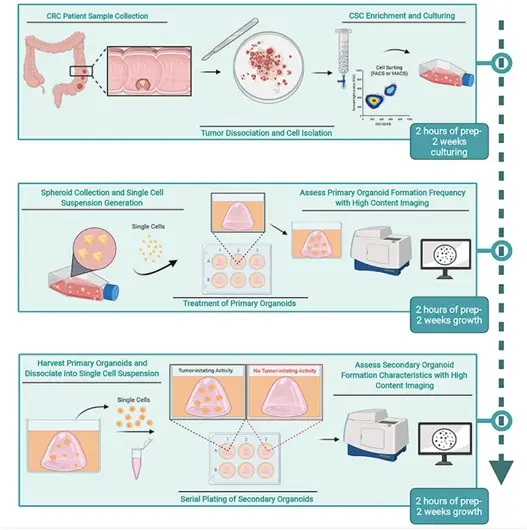
CRC类器官构建方法示意图
1. 实验前准备
主要试剂及仪器设备:生物安全柜,组织培养箱,离心机,细胞计数仪,显微镜,Matrigel,癌症干细胞(CSC)培养基,肿瘤解离液。
2. 组织获取与处理
(1)样本获取:从手术切除的未接受过治疗的CRC患者组织中获取样本,需患者知情同意及相关伦理委员会批准。将新鲜的原发性结直肠癌样本保存在预冷的PBS中,避免冷冻。
(2)清洗组织:在超净工作台中,将肿瘤组织转移至含有PBS的培养皿中,清洗2 - 3次,以去除血液和杂质。随后用CSC培养基再次清洗组织。
(3)剪碎组织:使用镊子和剪刀将肿瘤组织剪碎成约2mm大小的碎片,尽量保证碎片大小均匀,以增加细胞解离的效率。
(4)消化组织:将剪碎的肿瘤组织转移至肿瘤解离液中,于37°C孵育1h。期间每隔15min,通过振荡或无菌吸管上下吹打10-15次,以促进消化。
(5)过滤收集:消化后的组织悬液经70μm细胞筛过滤,再用1-2mL CSC培养基冲洗滤网,确保细胞充分收集。随后在4°C下450g离心5min,收集细胞沉淀。
3. 细胞分离与富集
(1)红细胞裂解:向细胞沉淀中加入5mL含0.8%(w/v)氯化铵和0.1 mM EDTA的溶液,冰上孵育10min,裂解红细胞。若红细胞裂解不完全,可适当增加氯化铵溶液体积并延长孵育时间。
(2)去除死细胞:加入等体积的CSC培养基,在4°C下450g离心5min,弃上清。通过死细胞去除试剂盒,按照制造商的方案去除死细胞,得到活细胞悬液。
(3)细胞分选与培养:可通过流式细胞分选(FACS)富集CD133+肿瘤起始细胞。将CD133+ 肿瘤细胞重悬于CSC培养基并计数,以5×10⁴ cells/mL的密度接种于非黏附培养瓶中,37°C、5% CO₂培养2周,直至出现多细胞聚集体(类器官球)。
4. 类器官培养与维持
(1)类器官球培养:类器官球培养期间,每3天更换一次CSC培养基。每周进行一次传代,若类器官球生长过快,需提前传代。传代时,可采用机械吹打或酶解的方法将类器官球解离成单细胞悬液。
(2)类器官培养:
① 单细胞悬液制备:将类器官球机械解离成单细胞悬液,进行细胞计数。若实验涉及病毒载体转导操作,需在此步骤前进行。
② Matrigel与细胞混合及铺板:以6孔板为例,将细胞稀释至合适浓度,与预冷的Matrigel按1:1比例混合均匀,快速吸取300μL混合液,滴加至6孔板的每个孔中心,小心操作避免产生气泡,使Matrigel聚合形成穹顶结构。
③ 类器官形成:向每个孔中缓慢加入3mL CSC培养基,避免冲散穹顶结构。将培养板放回培养箱继续培养,1-2周后可观察到类器官。
④ 类器官维持:定期观察类器官的生长情况,根据培养基颜色变化和类器官生长状态,每2-3天更换一次培养基。当类器官生长至合适大小或需要进行实验时,可进行后续操作,如药物处理、基因编辑等。若需长期保存类器官,可将其冻存于液氮中,冻存液为含10% DMSO、30% KnockOut Serum Replacement 和 60% CSC培养基的混合液。
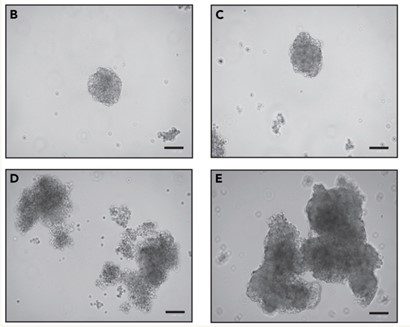
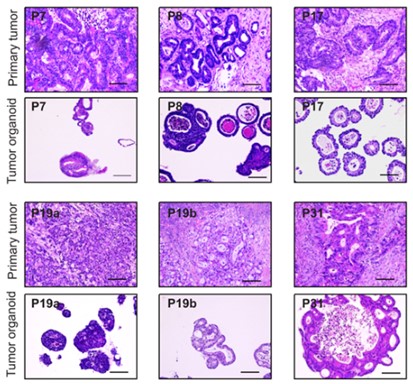
5. CRC类器官镜下形态图
参考文献
[1] Barbáchano A, Fernández-Barral A, Bustamante-Madrid P, Prieto I, Rodríguez-Salas N, Larriba MJ, Muñoz A. Organoids and Colorectal Cancer. Cancers (Basel). 2021 May 28;13(11):2657.
[2] Bergin CJ, Benoit YD. Protocol for serial organoid formation assay using primary colorectal cancer tissues to evaluate cancer stem cell activity. STAR Protoc. 2022 Mar 4;3(1):101218.
[3] van de Wetering M, Francies HE, Francis JM, Bounova G, Iorio F, Pronk A, van Houdt W, van Gorp J, Taylor-Weiner A, Kester L, McLaren-Douglas A, Blokker J, Jaksani S, Bartfeld S, Volckman R, van Sluis P, Li VS, Seepo S, Sekhar Pedamallu C, Cibulskis K, Carter SL, McKenna A, Lawrence MS, Lichtenstein L, Stewart C, Koster J, Versteeg R, van Oudenaarden A, Saez-Rodriguez J, Vries RG, Getz G, Wessels L, Stratton MR, McDermott U, Meyerson M, Garnett MJ, Clevers H. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015 May 7;161(4):933-45.
