
时间:2020-03-16浏览次数:5861
动脉粥样硬化(Atherosclerosis, AS)是一种慢性炎症性疾病,以脂质沉积、泡沫细胞形成、斑块进展及血管狭窄为特征。动物模型是研究其病理机制和药物开发的重要工具。
一、常用动物模型造模方法
1. 饮食诱导模型
方法:通过高脂、高胆固醇饮食(如西方饮食、添加胆酸盐)诱导脂代谢紊乱。
常用动物:小鼠(ApoE⁻/⁻、LDLR⁻/⁻)、兔、仓鼠。
特点:
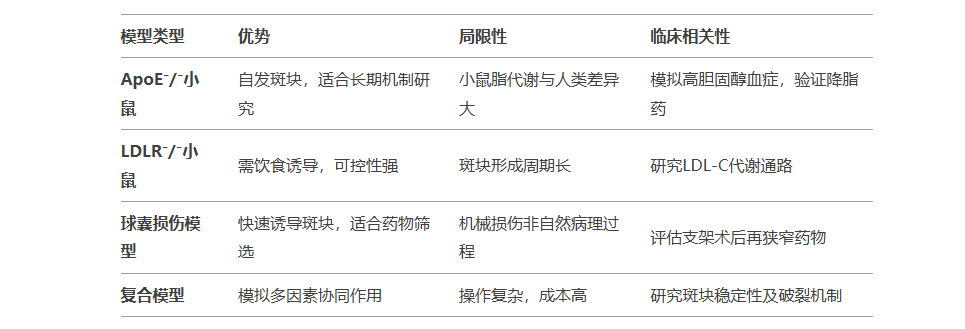
ApoE⁻/⁻小鼠:自发高胆固醇血症,3-6个月形成斑块。
LDLR⁻/⁻小鼠:需高脂饮食(如1.25%胆固醇)诱导,斑块形成较慢。
兔(如新西兰白兔):对饮食敏感,2-3个月可形成斑块。
2. 基因工程模型
方法:敲除或过表达特定基因(如ApoE、LDLR、PCSK9)。
代表性模型:
ApoE⁻/⁻小鼠:缺乏载脂蛋白E,导致乳糜微粒残留清除障碍。
LDLR⁻/⁻小鼠:低密度脂蛋白受体缺陷,血浆LDL-C升高。
PCSK9转基因小鼠:过表达前蛋白转化酶枯草溶菌素9,加速LDLR降解。
3. 机械/化学损伤诱导模型
方法:
颈动脉套管术(如小鼠):植入硅胶套管诱导血流紊乱。
球囊损伤(如大鼠、猪):内皮剥脱后高脂喂养。
特点:快速诱导内皮损伤和炎症反应,模拟斑块破裂。
4. 复合模型
方法:结合基因缺陷、饮食诱导和手术损伤(如ApoE⁻/⁻小鼠+高脂饮食+颈动脉结扎)。
优势:加速斑块形成并模拟复杂病理过程。
二、核心机制通路及关键蛋白
1. 脂质代谢紊乱
通路:LDL氧化(ox-LDL)→ 被巨噬细胞表面清道夫受体(SRs)摄取→ 泡沫细胞形成。
关键蛋白:
LDLR:低密度脂蛋白受体,调控血浆LDL-C水平。
SR-A1/CD36:清道夫受体,介导ox-LDL内吞。
LOX-1:氧化低密度脂蛋白受体1,促进内皮细胞炎症。
2. 炎症反应
通路:NF-κB激活→ 促炎因子(TNF-α、IL-6)释放→ 单核细胞募集。
关键蛋白:
NF-κB:炎症信号枢纽,调控IL-6、TNF-α表达。
NLRP3炎症小体:激活caspase-1,促进IL-1β成熟。
MCP-1/CCL2:趋化单核细胞至病变部位。
3. 内皮功能障碍
通路:eNOS活性降低→ NO减少→ 血管收缩和血小板聚集。
关键蛋白:
eNOS:内皮型一氧化氮合酶,维持血管舒张。
VCAM-1/ICAM-1:黏附分子,介导白细胞黏附。
4. 氧化应激
通路:ROS过度产生→ 氧化LDL和线粒体损伤。
关键蛋白:
NADPH氧化酶(NOX):ROS主要来源。
SOD2:超氧化物歧化酶,清除线粒体ROS。
5. 斑块稳定性
通路:基质金属蛋白酶(MMPs)分泌→ 降解纤维帽→ 斑块破裂。
关键蛋白:
MMP-9/MMP-2:降解胶原和弹性纤维。
TIMP-1:金属蛋白酶组织抑制剂,拮抗MMPs。
三、相关临床研究及转化
1. 降脂治疗
靶点:HMG-CoA还原酶(他汀类药物)、PCSK9(Alirocumab/Evolocumab)。
临床证据:
他汀类:降低LDL-C 30-50%,显著减少心血管事件(如JUPITER试验)。
PCSK9抑制剂:在他汀基础上进一步降低LDL-C 60%,降低心肌梗死风险(FOURIER试验)。
2. 抗炎治疗
靶点:IL-1β(Canakinumab)、NLRP3(MCC950)。
临床证据:
CANTOS试验:Canakinumab(抗IL-1β抗体)降低心血管事件15%。
COLCHICINE:通过抑制NLRP3,减少冠心病患者事件(COLCOT试验)。
3. 抗氧化治疗
靶点:NOX抑制剂(GKT137831)、SOD模拟物。
临床挑战:多数抗氧化剂(如维生素E)未能改善预后,可能与靶向特异性不足有关。
4. 内皮保护治疗
靶点:eNOS激活剂(如L-精氨酸)、ET-1受体拮抗剂。
临床研究:内皮素拮抗剂(如Bosentan)在肺动脉高压中有效,但对AS效果有限。
四、模型选择与临床相关性
模型未来研究方向
基因编辑技术:利用CRISPR构建更精准的AS模型(如PCSK9点突变)。
类器官/芯片:血管芯片结合3D培养,模拟人类斑块微环境。
多组学整合:结合单细胞测序和代谢组学,解析斑块异质性。
通过动物模型与临床研究的双向验证,动脉粥样硬化的机制解析和药物开发将更加精准高效。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

上一篇:高血压动物模型
