
时间:2020-03-16浏览次数:7638
高血压模型的建立可以用儿茶酚胺类或其它体液加压物质注射来形成,但是这类模型造成的高血压时间短,不适于长时间的研究。因此如果要进行长时间深入的研究则应复制慢性实验性高血压模型。除遗传性高血压动物模型较能模拟人类高血压病的自然过程外,其它各类慢性实验性高血压动物模型(如神经原型、肾型、内分泌型和饮食型等),大多要经过一定的手术、药物或其他附加因素处理,与人类高血压病的临床不完全一致,但是对于筛选有效降压药仍然是十分重要的实验手段。
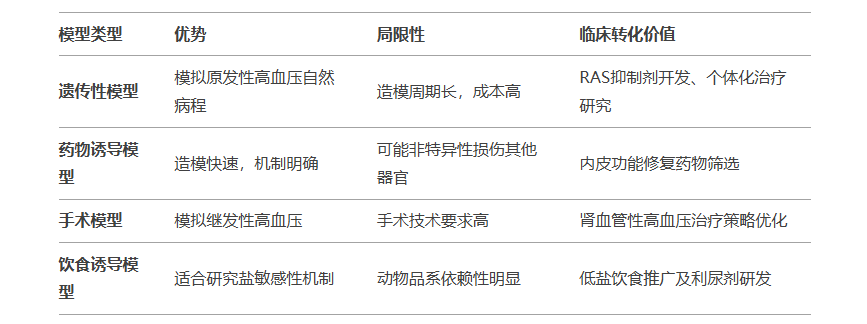
一、遗传性模型
造模方法
自发性高血压大鼠(SHR):通过选择性近交繁殖获得,血压随年龄自然升高。
转基因小鼠:如过表达人肾素或血管紧张素原基因的小鼠(如TGR(hREN))。
机制通路
肾素-血管紧张素系统(RAS)激活:Ang II通过AT1R介导血管收缩、氧化应激和炎症。
交感神经过度激活:中枢交感神经活性增强导致外周血管阻力升高。
内皮功能障碍:NO生物利用度降低,内皮素-1(ET-1)分泌增加。
关键蛋白
ACE(血管紧张素转换酶)、AT1R(血管紧张素II受体1型)、eNOS(内皮型一氧化氮合酶)、α1-肾上腺素能受体。
相关临床研究
ACE抑制剂(如卡托普利)和ARBs(如氯沙坦):临床试验证实其降压效果及器官保护作用(如LIFE研究)。
交感神经消融术:针对难治性高血压的临床探索(如SYMPLICITY HTN-3试验)。
二、药物诱导模型
造模方法
L-NAME(NO合酶抑制剂):连续给药2-4周,通过抑制eNOS减少NO生成。
糖皮质激素(如地塞米松):长期使用诱导盐敏感性高血压。
机制通路
NO-cGMP通路抑制:血管平滑肌收缩增强,内皮依赖性舒张受损。
氧化应激:NADPH氧化酶激活,ROS(如超氧阴离子)增加。
盐皮质激素受体(MR)激活:促进肾钠重吸收。
关键蛋白
eNOS、sGC(可溶性鸟苷酸环化酶)、NADPH氧化酶亚基(如NOX4)、MR(盐皮质激素受体)。
相关临床研究
硝酸酯类药物:通过提供外源性NO改善内皮功能(如ISDN试验)。
螺内酯(MR拮抗剂):用于难治性高血压(如ASPIRANT试验)。
三、手术模型(2K1C肾动脉狭窄模型)
造模方法
手术夹闭单侧肾动脉,造成肾缺血,对侧肾脏正常。
机制通路
RAS过度激活:肾缺血导致肾素释放,Ang II水平升高。
醛固酮分泌增加:促进钠水潴留和血管重塑。
炎症与纤维化:TGF-β/Smad通路激活,胶原沉积。
关键蛋白
肾素、ACE、AT1R、醛固酮合成酶(CYP11B2)、TGF-β1。
相关临床研究
肾动脉血管成形术:用于治疗肾血管性高血压(如CORAL试验)。
直接肾素抑制剂(如阿利吉仑):临床试验显示降压效果(如ALLAY研究)。
四、饮食诱导模型
造模方法
高盐饮食:给予8% NaCl饮食数周,诱导盐敏感性高血压。
DOCA-盐模型:去卵巢大鼠+醋酸去氧皮质酮(DOCA)注射+高盐饮水。
机制通路
ENaC过度激活:肾小管钠重吸收增加(如Liddle综合征相关突变)。
氧化应激与炎症:高盐激活免疫细胞,释放IL-17等促炎因子。
中枢钠离子感应异常:下丘脑室旁核(PVN)活性增强。
关键蛋白
ENaC(上皮钠通道)、SGK1(血清糖皮质激素调节激酶1)、NCC(钠氯共转运体)、IL-17。
相关临床研究
低钠饮食干预:DASH-Sodium试验证实降压效果。
ENaC抑制剂(如阿米洛利):用于Liddle综合征患者。
五、模型比较
六、未来研究方向
多因素复合模型:如高盐+高脂饮食模拟代谢性高血压。
基因编辑技术:CRISPR构建特定基因突变模型(如ACE2敲除)。
生物标志物挖掘:基于模型差异蛋白寻找高血压分型标志物。
通过深入解析动物模型的分子机制,可为靶向药物开发(如AT1R拮抗剂、sGC激动剂)和个性化治疗提供理论依据。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

上一篇:慢性心力衰竭动物模型
下一篇:动脉粥样硬化动物模型
