
时间:2020-12-23浏览次数:7066
一、心梗动物模型造模方法及特点
心梗模型的构建需模拟人类心肌缺血坏死的病理过程,不同方法各有优缺点,适用于不同研究目标:
冠状动脉结扎法(LAD结扎术)
原理:通过开胸或微创手术直接结扎左前降支(LAD),导致急性心肌缺血。
动物:大鼠、小鼠、兔、犬、猪。
优点:病理过程与人类最接近,可模拟透壁性心梗。
缺点:手术死亡率高(小鼠可达30%),需呼吸机支持(大动物)。
关键验证:心电图ST段抬高、TTC染色显示梗死区域。
缺血-再灌注模型(I/R模型)
方法:暂时阻断冠脉血流(30-60分钟)后恢复灌注。
机制:模拟临床溶栓/介入治疗后的再灌注损伤。
特征:氧化爆发导致心肌细胞凋亡加重,梗死面积扩大20-40%。
异丙肾上腺素(ISO)诱导法
剂量:大鼠85-200 mg/kg连续2天腹腔注射。
机制:β受体过度激活→冠脉痉挛+氧耗增加→内膜下缺血。
局限:梗死不均匀,纤维化为主,适合研究心肌重构。
微球栓塞法
操作:经导管注入微球至冠状动脉左主干。
优势:无需开胸,可控制梗死范围(微球数量)。
应用:犬/猪等大动物药物疗效评估。
基因工程模型
举例:ApoE-/-小鼠高脂饮食+冠脉损伤诱导斑块破裂。
价值:研究动脉粥样硬化斑块不稳定导致的心梗机制。
二、核心病理机制及关键信号通路
心肌坏死通路
关键事件:ATP耗竭→线粒体膜电位崩溃→mPTP(线粒体通透性转换孔)开放。
调控蛋白:
CypD(亲环蛋白D):mPTP的结构组分,抑制剂环孢素A可缩小梗死面积。
TNNI3(肌钙蛋白I):坏死时释放入血,临床用于心梗诊断(hs-cTn检测)。
炎症风暴级联反应
激活步骤:ROS/DAMPs→NLRP3+ASC+pro-caspase-1组装→活化caspase-1。
效应:切割pro-IL-1β/IL-18产生促炎因子。
临床关联:Canakinumab(IL-1β单抗)在CANTOS试验中降低心梗复发率15%。
氧化应激网络
NADPH氧化酶(NOX2/4):再灌注时ROS主要来源。
SOD2:线粒体抗氧化酶,过表达可减少50%梗死面积。
治疗靶点:Mitochondria-targeted antioxidant MitoQ进入II期临床试验(NCT03520794)。
程序性细胞死亡
凋亡:Bax/Bak线粒体易位→细胞色素C释放→caspase-9/3激活。
铁死亡:GPX4失活→脂质过氧化物累积,抑制剂Ferrostatin-1在猪模型减少30%梗死。
自噬:LC3-II/Beclin1上调的双向调节作用,适度过激可清除受损线粒体。
三、关键蛋白的转化医学研究
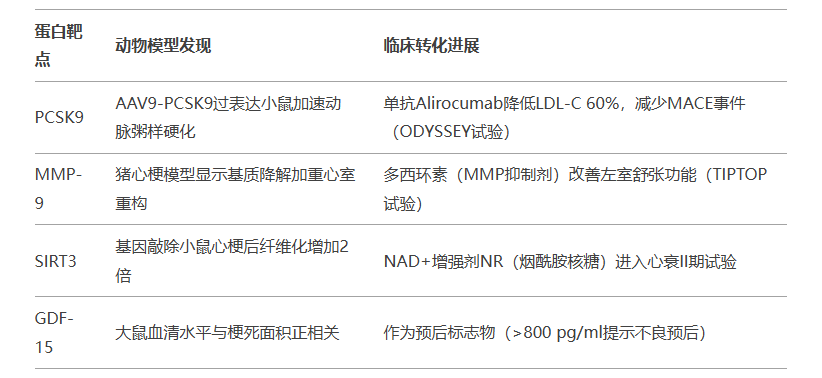
四、造模方法选择与临床相关性
基础机制研究
首选模型:小鼠LAD结扎+I/R(基因修饰便利)。
例证:利用cKO小鼠证实巨噬细胞HIF-1α缺失加重炎症(Circulation 2021)。
药物开发验证
大动物模型:猪微栓塞模型评估抗血小板药物效果(与人类冠脉解剖相似性>90%)。
案例:Ticagrelor在猪模型显示比氯吡格雷更优的血流恢复,预示PLATO试验结果。
再生医学研究
需慢性模型:大鼠ISO诱导纤维化模型评估干细胞疗效。
临床关联:CardiAMP疗法(自体骨髓细胞)基于大鼠数据进入III期试验(NCT02438306)。
模型总结与未来方向
模型局限性
啮齿类动物侧支循环少,无法模拟人类慢性缺血适应过程。
解决方案:使用叙利亚仓鼠(天然丰富侧支)研究代偿机制。
多组学整合
单细胞测序揭示巨噬细胞亚型在猪心梗不同时期的动态变化(Science 2023)。
空间代谢组学定位梗死边缘区脂质异常分布。
类器官芯片
心肌微器官与内皮共培养,模拟微栓塞导致的无复流现象(Nature Biomedical Engineering 2022)。
上一篇:心肌缺血动物模型
下一篇:阿霉素诱导大鼠心肌病模型
