-
产品分类
- 人源 (28)
- 大鼠源 (4)
- 小鼠源 (6)
- 仓鼠源 (1)
- 猪源 (0)
- 猴源 (0)
- 牛源 (0)
- 昆虫源 (0)
- 兔源 (0)
- 鸡源 (0)
- 负鼠源 (0)
- 鸭源 (0)
- 猫源 (0)
- 狗源 (0)
- 绿猴源 (0)
- 羊源 (0)
- 其他源 (3)
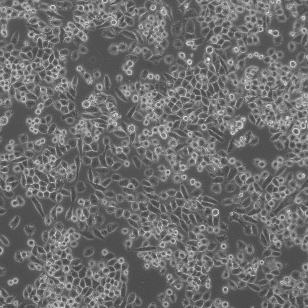
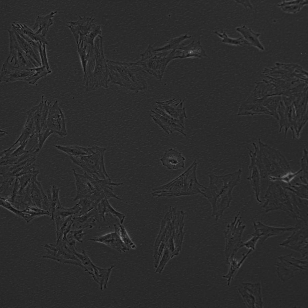
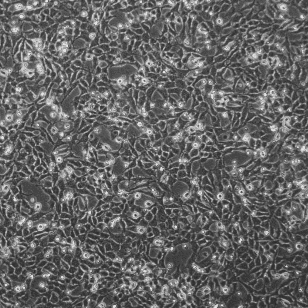
人胰腺癌细胞 MIA PaCa-2
价 格:¥询价
产品编号:GL0018
细胞数量:1*10^6
组织来源:
细胞种属:人源或者鼠源等其他物种
培养基:90%DMEM+10%FBS+1%双抗
形态特征:上皮细胞样
传代方法:1:2传代
培养条件:
细胞描述:储存条件:液氮 保存条件:4℃保存一年,-20℃长期保存
细胞冻存:90%血清+10%DMSO,现配现用
细胞运输:干冰(第二代培养末期液氮冻存)
 收藏商品
收藏商品
 分享到
分享到
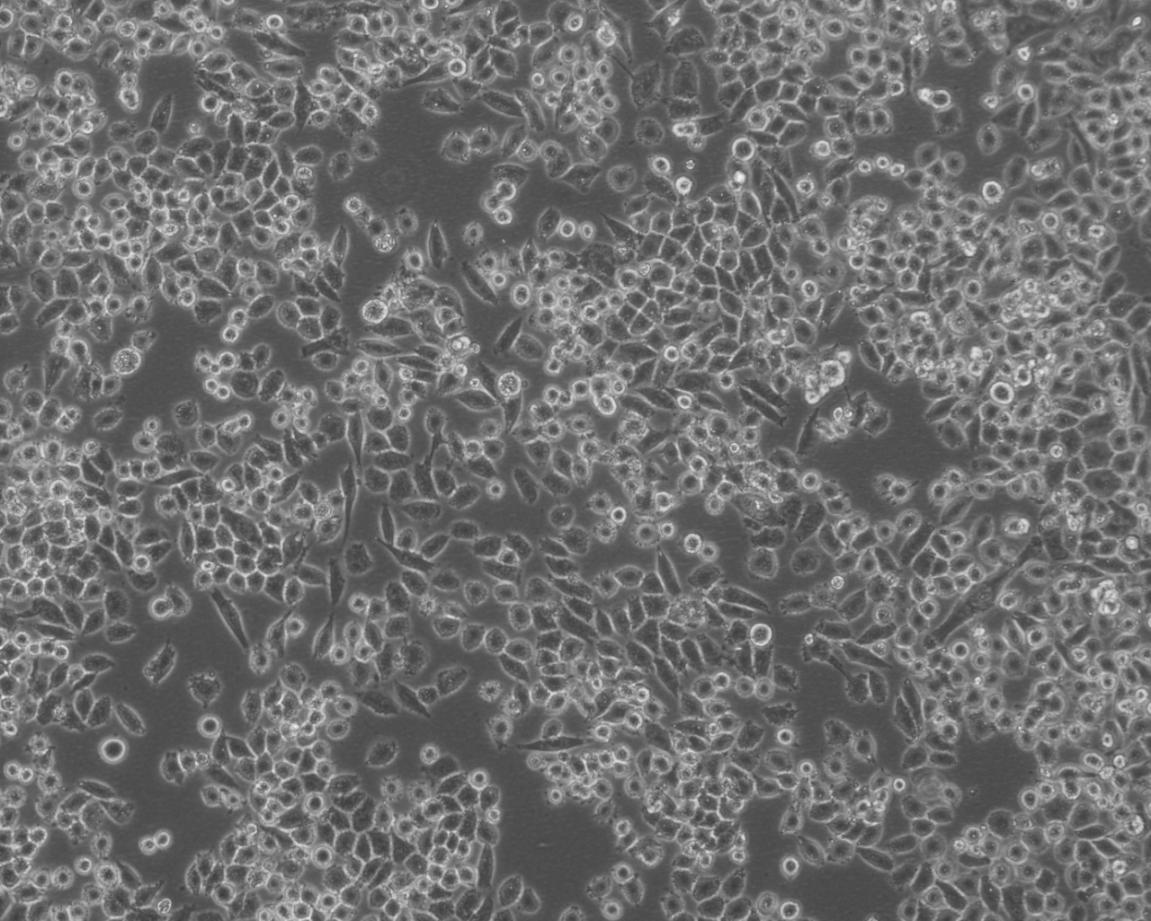
造成实验室细胞污染常见情况总结:
细胞培养中最常见污染的是细菌、真菌和支原体污染。细胞一旦污染,大多数较难处理。那么,哪些情况我们不注意的话就会造成细胞污染呢?我们根据常见细胞培养实验分析总结下。
1) 为节省时间,有人已经用超净台四个多小时,不开紫外灭菌30min,酒精擦拭后直接开始试验;
2) 器材或者溶液很久没用,未检测是否污染而直接使用;离心管多次使用,枪头为了方便交叉使用;
3) 超净台不点酒精灯;点了酒精灯放在右上角,而你在左下角做试验;
4) 不带手套,徒手操作;
5) 细胞培养间配备枪式移液器、手术器械、离心机、冰箱等专用仪器设备以及专用的实验服和拖鞋,未定期消毒。专用物品被带出传代细胞使用。培养细胞过程中使用的所有实验用具,如移液管、一次性枪头、一次性塑料离心管、冻存管等未按要求灭菌使用(通常需121°C高压灭菌20分钟后37%烤干备用)。超净台和桌面,东西太多太乱:超净台不是储物箱,什么培养皿、各种规格的板子、枪头就不要堆在超净台!这样就会有许多紫外线顾不到的卫生死角。传代细胞其他的桌面,切忌东西堆积如山,不要将酒精棉球、标签纸、牛皮纸买来后全部堆在传代细胞!一不小心“飘”进你的细胞培养板里,细胞就会养的不好,啥时候死了都不知道!【培养箱太久没清洁】细胞污染了,并非直接扔了培养皿就不管了,首先你还得看看这个恒温培养箱里其他培养皿或孔板里的细胞是否污染,如果有而且好几个板子都有类似的污染块,那很可能是培养箱中的水或者空气污染了,得给培养箱做个大扫除,重新酒精消毒,照紫外;孵箱里的水,水没了要记得加,还得记得十天半个月的就用酒精擦擦托盘。【传代细胞人多口杂,难管理】在传代细胞这种卫生要求高,人多了,不确定因素多了,难以保证试验在无菌条件下操作。出入试验室,实验服当风衣穿,不扣纽扣,不戴鞋套,就容易造成细胞污染;超净台做实验时,喜欢说话聊着做试验,要是还不带口罩,里面就有很多细菌等着去攻击你的细胞呢!
解冻细胞常见实验问题分析及推荐解决方法:在解冻冻存细胞时,发现会出现存活率低、大量细胞碎片及生长缓慢等问题,究竟是什么原因导致,我们该怎么进行解决?以下是国内外细胞培养专家针对解冻细胞实验问题,总结的一些解决方案!出现低存活率的可能原因及推荐解决方案如下:1)解冻过程中细胞裂解,推荐的解决方案:可预期到一定量的细胞死亡,因此细胞的浓度应足够高,考虑到这一损失。起始浓度为1*10(6)至1*10(7)细胞/毫升;2)解冻过程中的问题,推荐的解决方案:在-70℃至-80℃下保存冷冻的培养物,保存时间为1-5天,但这不是保存的方法。在37℃充分解冻后应立即开始培养;3)对冷冻液过敏,推荐的解决方案:A.完全或部分更换培养基,减少培养基中冷冻液的量。在24小时后更换培养液体可全部去除冷冻液。B.留出更多时间供培养物恢复。有时细胞需要几周时间才能形成单层或密集的悬浮物,取决于冷冻时细胞的年龄或传代次数或在生长阶段中的位置。冷冻的最佳条件在对数期;4)被冷冻的原种细胞的年龄或冷冻时培养物的年龄,推荐的解决方案:解冻最近冷冻的细胞。细胞处于冷冻状态的时间越长,存活率越低。检查冷冻细胞的时间和方法。在冷冻时细胞应处于对数期。
细胞产品包装:复苏形式:T25培养瓶(一瓶)或冻存形式:1ml冻存管(两支)
MIA PaCa-2细胞系 复苏培养更专注
细胞背景资料:详见相关文献介绍
【冻存细胞操作】
1)选对数增生期细胞(证明无支原体污染),在冻存前1d换液;
2)按常规方法把培养细胞制备成悬液,计数,使细胞密度达5×10(7)/ml左右密度,离心,去上清;
3)加入配制好的冻存液(培养液6.8ml,小牛血清2ml,DMSO 1ml,5.6%NaHCO3 0.1ml),按与去上清相同的量一滴一滴加入离心管中,然后用吸管轻轻吹打令细胞重悬。冻存细胞时培养液中加入保护剂10%二甲基亚砜(DMSO) 或甘油,可使冰点降低,使细胞内水分在冻结前透出细胞外;
4)分装于无菌冻存管中,每管加1.5m悬液;
5)旋好冻存管并仔细检查,一定要盖紧,做好标记;6)冻存:在特殊的仪器或简易的液氮容器中,按-1℃/min的速度,在30~40min时间内,下降到液氮表面,再停30min后,直接投入液氮中。要适当掌握下降冷冻速度,过快能影响细胞内水分透出,太慢则促进冰晶形成。操作时应戴防护眼镜和手套,以免液氮冻伤。
【复苏细胞操作】
1)从罐中取出冻存管;
2)迅速放入36℃~37℃水浴,不时摇动,使其急速融化,30~60s内完成;
3)冻存管用70%酒精擦拭消毒后,打开盖子,用吸管将细胞悬液注入离心管中,再滴加10ml培养液;
4)低速离心(500~1000r/min) 5min,去上清后再用培养液洗一次;
5)用培养液适当稀释后,装入培养瓶37℃培养,次日更换一次培养液后,继续培养。以后仍按常规进行培养。冻存细胞数量要充分,密度应达到10(7)/ml,在融后稀释20倍时,仍能保持5×10(5)/ml数量。