探秘原代细胞提取纯化:解锁生命科学的微观密码!
时间:2026-01-19 阅读:105
原代细胞:生命科学的基石
在生命科学研究的浩瀚星河中,原代细胞是一颗不可或缺的 “明星”。它就像连接微观世界与宏观生命现象的桥梁,为疾病机制研究、创新药物研发、再生医学应用等领域提供了最贴近体内真实状态的研究模型。从癌症的精准靶向治疗探索,到神经退行性疾病的发病机制解析,再到抗病毒药物的 efficacy 验证,原代细胞都发挥着不可替代的核心作用。今天,我们就一同揭开原代细胞提取纯化的神秘面纱,看看这一 “微观操作” 如何支撑起生命科学的重大突破。
原代细胞的 “前世今生”
1. 原代细胞的定义与特点
什么是原代细胞?简单来说,原代细胞是直接从机体组织或器官中分离、培养得到的细胞,未经过体外长期传代培养,保留了其在体内的原始生物学特性。它就像刚从 “自然环境” 中走出的 “原住民”,带着最本真的 “生命印记”,主要有以下几个鲜明特点:
① 贴近体内真实状态:原代细胞的形态、功能、代谢特征与体内细胞高度一致,能准确反映机体的生理和病理反应,是研究生命现象的 “天然模型”。
② 有限增殖能力:与无限传代的细胞系不同,原代细胞的增殖能力有限,通常只能传代少数几代,之后便会进入衰老或凋亡状态,这也决定了它的 “稀缺性”。
③ 异质性与个体差异:由于来源于不同个体或同一组织的不同部位,原代细胞存在天然的异质性,这种差异虽然会增加实验难度,但也更符合体内细胞的真实分布情况,让研究结果更具代表性。
2. 原代细胞与细胞系的区别
在实验研究中,很多人会混淆原代细胞和细胞系,其实二者有着本质区别:
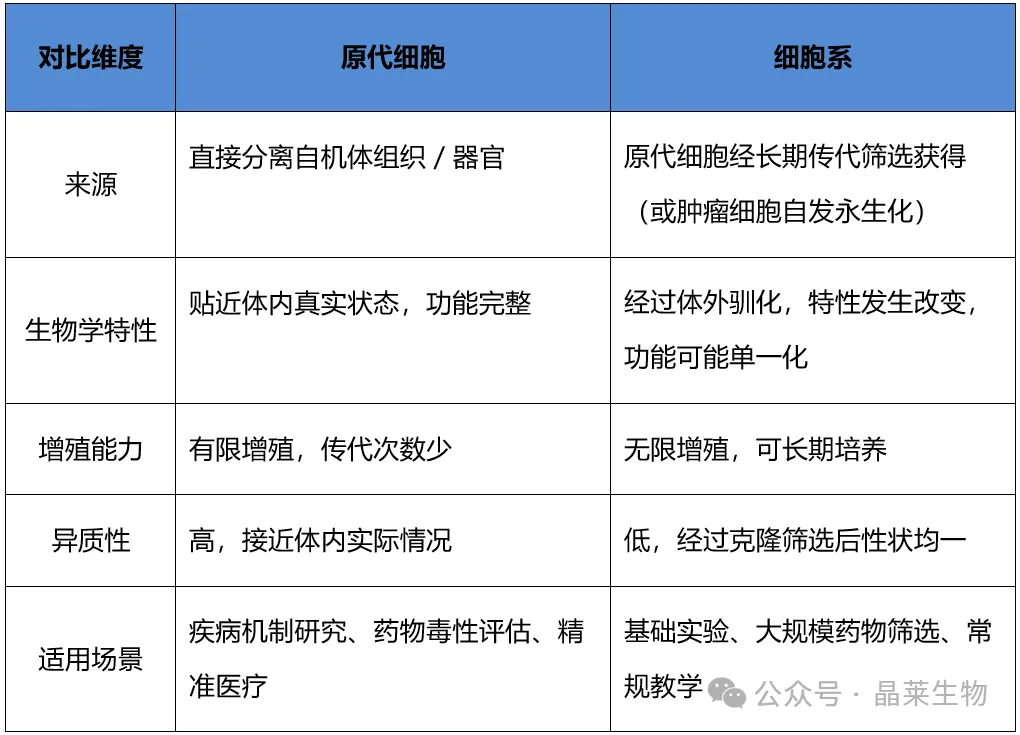
简单总结:如果说细胞系是 “标准化生产的工业产品”,那么原代细胞就是 “保留天然属性的手工珍品”,在需要还原体内真实生理病理状态的研究中,原代细胞的优势无可替代。
提取纯化:开启微观世界的钥匙
1. 提取纯化的重要性
“工欲善其事,必先利其器”,对于原代细胞研究而言,高纯度、高活性的原代细胞是实验成功的前提。如果提取的细胞活性低、杂质多,不仅会导致实验结果偏差,还可能浪费大量的时间和样本资源。例如,在肿瘤免疫治疗研究中,若从肿瘤组织中分离的免疫细胞纯度不足,就无法准确评估免疫细胞对肿瘤细胞的杀伤效果;在药物毒性测试中,低活性的原代肝细胞可能会误判药物的安全性。因此,原代细胞的提取纯化技术直接决定了研究的可靠性和科学性。
2. 提取步骤全解析
原代细胞的提取就像一场 “精密的微观手术”,每一步都需要严格把控,具体可分为以下两个核心环节:
① 取材:抓住 “新鲜” 与 “无菌” 两大关键
取材是提取原代细胞的第一步,也是决定细胞活性的基础。首先要明确取材的组织类型,不同组织的细胞分离方法不同,例如肝脏、肾脏等实体组织需要消化分离,而血液、淋巴液等则可直接分离悬浮细胞。其次,要关注组织的分化程度和供体年龄,一般来说,幼龄动物的组织细胞增殖能力更强,活性更高;分化程度低的组织(如胚胎组织)比分化成熟的组织更容易分离获得活细胞。
最重要的是,取材过程必须严格遵循无菌操作原则,避免细菌、真菌等污染。同时,取材要快速,从组织离体到开始处理最好控制在 30 分钟内,并且在冰浴条件下操作,减少细胞因缺氧、温度变化导致的损伤。取材后,还要用无菌的生理盐水或平衡盐溶液反复漂洗,去除组织表面的血液、杂质和坏死组织,为后续分离做好准备。
② 分离方法大揭秘:机械与消化的 “双管齐下”
根据组织类型的不同,原代细胞的分离方法主要分为机械分散法和消化分离法:
• 机械分散法:适用于结构疏松的组织,如脾脏、淋巴结、骨髓等。操作方法较为简单,通常是将组织块放在无菌的培养皿中,用剪刀剪碎成细小的组织碎片,再用吸管或玻璃匀浆器轻轻吹打、研磨,使细胞从组织中分散出来,最后通过过滤去除未分散的组织块,获得细胞悬液。这种方法的优点是操作快速、对细胞损伤小,但缺点是分离效率较低,适用于细胞含量丰富的组织。
• 消化分离法:是最常用的分离方法,适用于结构致密的实体组织,如肝脏、肾脏、肌肉、肿瘤组织等。核心原理是利用消化酶分解组织细胞间的胶原蛋白、弹性蛋白等连接物质,使细胞分散。常用的消化酶包括胰蛋白酶、胶原蛋白酶、透明质酸酶等,不同组织需选择合适的酶种类和浓度。例如,胰蛋白酶适用于消化上皮组织、肌肉组织,而胶原蛋白酶则更适合消化结缔组织、肿瘤组织。
操作时,将剪碎的组织块放入含有消化酶的培养基中,在 37℃、5% CO₂的培养箱中孵育一定时间,期间需轻轻摇晃培养瓶,促进酶与组织的充分接触。消化时间需严格控制,一般为 10-60 分钟,过长会导致细胞损伤,过短则组织分散不完全。消化完成后,加入含有血清的培养基终止酶的作用(血清中的蛋白质可抑制胰蛋白酶等的活性),再通过过滤、离心等步骤获得单细胞悬液。
3. 纯化方法大盘点:精准筛选 “目标细胞”
分离获得的细胞悬液中往往含有多种细胞类型,例如从肿瘤组织中分离的细胞可能包含肿瘤细胞、免疫细胞、成纤维细胞等,因此需要通过纯化技术筛选出目标细胞。常用的纯化方法可分为四大类:
① 基于物理特性的纯化
•离心筛选法:利用不同细胞的密度差异,通过离心力将细胞分离。例如,红细胞的密度较大,可通过低速离心(1000-1500 rpm)将其与其他细胞分离;而密度较小的淋巴细胞则可在更高转速下沉淀。这种方法操作简单、成本低,但分离精度较低,适用于初步纯化。
•密度梯度离心法:是更精准的物理分离技术。将细胞悬液铺在具有密度梯度的分离液(如 Percoll 液、Ficoll 液)上,通过高速离心后,不同密度的细胞会在梯度液中形成不同的细胞带。例如,利用 Ficoll 液可快速分离外周血中的淋巴细胞,纯度可达 90% 以上。这种方法分离效果好,对细胞损伤小,是免疫细胞分离的常用方法。
② 基于生物学特性的纯化
•磁珠分选法(MACS):利用抗原 - 抗体特异性结合的原理,将针对目标细胞表面抗原的抗体偶联在磁性微珠上,与细胞悬液混合后,目标细胞会通过抗体与磁珠结合,再将细胞悬液放入磁场中,结合了磁珠的目标细胞会被吸附在管壁上,未结合的杂质细胞则被洗脱,从而获得高纯度的目标细胞。这种方法操作快速、纯度高(可达 95% 以上),对细胞活性影响小,适用于少量或大量细胞的分选。
•流式细胞术分选(FACS):同样基于抗原 - 抗体结合原理,将荧光标记的特异性抗体与细胞结合后,细胞悬液通过流式细胞仪的喷嘴形成单个细胞流,在激光照射下,目标细胞会发出特定的荧光信号,仪器会根据荧光信号将目标细胞分选出来。这种方法不仅能分选目标细胞,还能同时分析细胞的多种特性(如大小、颗粒度、表面抗原表达量),分选纯度极高,但仪器成本高,操作相对复杂,且对细胞活性有一定影响。
③ 基于贴壁特性的纯化
•差速贴壁法:利用不同细胞贴壁速度的差异进行分离。例如,成纤维细胞的贴壁速度较快(通常 2-4 小时即可贴壁),而上皮细胞、免疫细胞等贴壁速度较慢。将细胞悬液接种到培养瓶中,培养一定时间后,先贴壁的成纤维细胞会附着在瓶壁上,此时将未贴壁的细胞悬液转移到新的培养瓶中,即可实现两种细胞的分离。这种方法操作简单、无需特殊试剂,适用于贴壁细胞与非贴壁细胞的分离。
•选择性贴壁法:通过改变培养瓶的表面特性或添加特定试剂,促进目标细胞贴壁,抑制杂质细胞贴壁。例如,在培养瓶表面包被胶原蛋白、纤连蛋白等基质,可促进上皮细胞、内皮细胞等贴壁生长,从而提高目标细胞的纯度。
④ 基于功能特性的纯化
•克隆培养法:将细胞悬液稀释到合适浓度,接种到培养皿中,使每个培养孔中仅含有单个细胞,培养一段时间后,单个细胞会增殖形成细胞克隆。通过观察克隆的形态、功能或检测特定标志物,筛选出目标细胞克隆,再进行扩大培养。这种方法可获得纯度极高的细胞株,但操作耗时,适用于需要获得单一细胞来源的研究。
•代谢标记筛选法:利用目标细胞与杂质细胞在代谢上的差异进行筛选。例如,某些肿瘤细胞对特定的营养物质或药物具有抗性,可在培养基中添加该物质,抑制杂质细胞的生长,从而筛选出目标细胞。这种方法针对性强,但需要明确目标细胞的代谢特性,适用范围较窄。
实操指南:避坑指南与技巧秘籍
1. 注意事项需牢记
原代细胞提取纯化是一项 “精细活”,以下这些细节直接影响细胞的活性和纯度,一定要牢记:
① 组织块漂洗要充分:至少漂洗 3 次,每次用无菌生理盐水或平衡盐溶液轻轻吹打,去除残留的血液、组织液和坏死组织,避免杂质影响后续消化和纯化。
② 控制消化酶的浓度和作用时间:酶浓度过高或消化时间过长会导致细胞破裂、活性下降;浓度过低或时间过短则组织分散不完全。建议根据组织类型预实验确定最佳条件,例如胰蛋白酶的常用浓度为 0.25%-0.5%,消化时间一般不超过 60 分钟。
③ 消化后及时终止酶解:加入含有血清的培养基是最常用的终止方法,血清中的白蛋白、球蛋白等可与酶结合,抑制其活性,避免细胞持续受到酶的损伤。
④ 离心操作要温和:离心转速不宜过高(一般 1000-2000 rpm),离心时间控制在 5-10 分钟,避免离心力过大导致细胞破裂。离心后弃上清时,要轻轻倾倒,避免扰动细胞沉淀。
⑤ 全程保持无菌环境:从取材到培养的每一步都要在无菌操作台中进行,实验器械、培养基、试剂等都要经过灭菌处理,防止细菌、真菌污染。
2. 常见问题巧应对
在提取纯化过程中,难免会遇到各种问题,以下是常见问题及解决办法:
问题 1:细胞活性低,镜下观察大量细胞漂浮、形态不规则。
解决办法:
① 检查取材速度,确保组织离体后快速处理,全程冰浴;
② 调整消化酶浓度和时间,避免过度消化;
③ 离心时降低转速,延长离心时间,确保细胞沉淀完全;
④ 培养条件要适宜,培养基成分要新鲜,CO₂浓度和温度要稳定。
问题 2:细胞纯度低,杂质细胞过多。
解决办法:
① 优化纯化方法,例如对于免疫细胞,可采用磁珠分选法替代离心法;
② 增加纯化次数,例如差速贴壁法可重复 2-3 次,提高贴壁细胞纯度;
③ 选择特异性更高的纯化试剂,如针对目标细胞的特异性抗体;
④ 取材时尽量选择组织边缘,减少坏死组织和杂质的混入。
问题 3:细胞增殖能力差,传代后生长缓慢。
解决办法:
① 选择幼龄供体的组织,提高细胞增殖潜力;
② 培养基中添加生长因子,如 EGF、FGF 等,促进细胞增殖;
③ 减少细胞操作次数,避免反复吹打导致细胞损伤;
④ 保持培养环境稳定,避免温度、CO₂浓度波动。
未来展望:无限可能的微观世界
原代细胞提取纯化技术作为生命科学研究的 “基础工具”,其发展与生命科学的进步息息相关。随着技术的不断革新,我们相信未来原代细胞提取纯化将朝着更高效、更精准、更自动化的方向发展:
一方面,单细胞分离和培养技术将进一步突破,实现对单个原代细胞的精准操控和分析;
另一方面,3D 培养、类器官技术与原代细胞提取纯化技术的结合,将构建更贴近体内环境的研究模型,为疾病研究和药物研发提供更强大的支撑。
从实验室的微观操作到临床治疗的重大突破,原代细胞提取纯化技术正在解锁生命科学的无限可能。无论是科研工作者还是行业从业者,都在这一领域不断探索、创新。如果你也对原代细胞研究感兴趣,欢迎在评论区分享你的经验和疑问,让我们一起探索这个神奇的微观世界!
关于晶莱















