【五分钟讲实验】国自然热点“脂质代谢”与肿瘤及铁死亡相关调控机制分析!
时间:2024-05-20 阅读:872什么是脂质代谢?
脂类是机体内的一类有机大分子物质,包括脂肪、磷脂、糖脂、胆固醇等多种分子。脂质代谢则指的是这些物质在细胞内产生、储存、运输、降解、氧化功能的一系列代谢过程。
千万不要以为“脂质”代谢,就只能和脂肪、肥胖相关哦~脂质代谢的异常可以引起炎症、应激、胰岛素抵抗、细胞异常活化。
同时脂质代谢还和“铁死亡”密切相关。所以,除了肥胖之外,异常的脂质代谢还可以直接引起糖尿病、心血管病变、脂肪肝、神经退行性病变、肿瘤等疾病的发生。
主要脂质代谢途径
细胞脂质代谢是由所有主要大分子支持的。脂质可以通过被动扩散和FA转运或转位酶蛋白(包括FATPs和CD36)进入细胞。葡萄糖摄取和糖酵解提供丙酮酸和乙酰辅酶a,以支持TCA循环的循环。线粒体FAO是线粒体中用于TCA代谢的乙酰辅酶a的另一个来源。柠檬酸盐在TCA循环过程中合成,并从线粒体输出,作为重新生成脂肪的第一步。谷氨酸是乙酰辅酶a的另一个潜在来源,其中还原性羧化作用可以通过a-酮戊二酸和异柠檬酸以及细胞质和线粒体酶IDH1和IDH2分别支持胞质柠檬酸池。乙酸也可以通过ACSS2生成乙酰辅酶a,也在胞质溶胶中。柠檬酸盐通过ACLY转化为乙酰辅酶a,为FA合成和胆固醇合成提供了主要的双碳构建块。ACACA催化新生脂肪生成的限速步骤,产生丙二酰辅酶a。乙酰辅酶a和丙二酰辅酶a用于生成棕榈酸酯,可通过ELOVL酶(延长FA链)和去饱和酶SCD和FADS2进一步修饰,生成SFA和MUFA。
此外,摄取的必需脂肪酸(LA和ALA)可以通过FADS和ELOVL酶的作用转化为不同的PUFA。胆固醇合成利用乙酰辅酶a通过ACAT产生乙酰乙酰辅酶a。HMGCS产生HMG-CoA,通过HMGCR(胆固醇合成中的限速步骤)转化为甲羟戊酸,并进一步加工成胆固醇种类。脂质以甘油-3磷酸为骨架结合成TAG后,可以储存在ld中。GPAT将甘油-3-磷酸与长链FA结合生成LPA,这是TAG合成中的限速步骤。LPA由AGPAT转化为PA,再由PAP转化为DAG。DGAT催化产生TAG的最后一步,然后TAG可以被隔离并储存在ld中,在内质网膜内合成。DAG还可用于合成膜磷脂,主要种类有PC、PE、PI和PS。
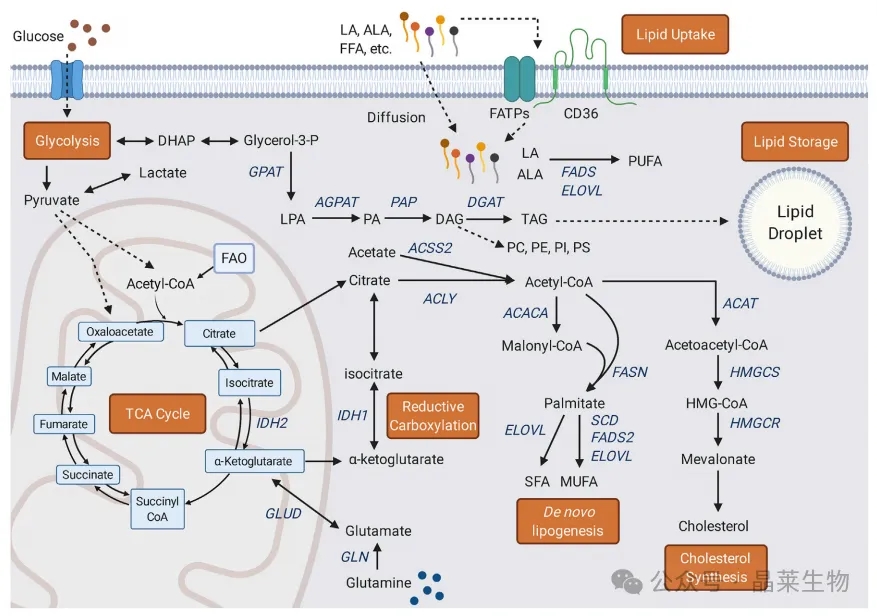
ACACA,乙酰辅酶a羧化酶;ACAT,乙酰辅酶a乙酰转移酶;ACLY, atp -柠檬酸裂解酶; ACSS2,乙酰辅酶a合成酶2;AGPAT,酰基甘油磷酸酰基转移酶;ALA, a-亚麻酸;DAG,甘油二酯; DGAT,二甘油酯酰基转移酶;DHAP:磷酸二羟丙酮;ELOVL,超长脂质延伸蛋白; FADS,脂肪酸去饱和酶;FAO,脂肪酸氧化;FASN:脂肪酸合成酶; FATPs,脂肪酸转运蛋白;FFAs,游离脂肪酸; GLUD,谷氨酰胺脱氢酶;GLN谷氨酰胺酶; GPAT,甘油-3-磷酸酰基转移酶;HMGCR, HMG-CoA还原酶;HMGCS, HMG-CoA合成酶;LA,亚油酸; LPA,溶血磷脂酸;MUFAs,单不饱和脂肪酸;PA:磷脂酸;PAP:磷脂酸磷酸酶; PC,磷脂酰胆碱;PE、磷脂酰乙醇胺; PI,磷脂酰肌醇;PS,磷脂酰丝氨酸;PUFA,多不饱和脂肪酸; SCD,硬脂酰辅酶a去饱和酶;SFA,饱和脂肪酸;TAG:三酰基甘油; TCA cycle,三羧酸循环。
脂质代谢与癌症研究
1. 肿瘤微环境与脂质代谢之间的串扰
肿瘤细胞可以为了自身的利益而失调脂质代谢,使它们能够适应不利的条件。这种重编程可能源于遗传和表观遗传改变和/或由TME中的不利条件驱动。
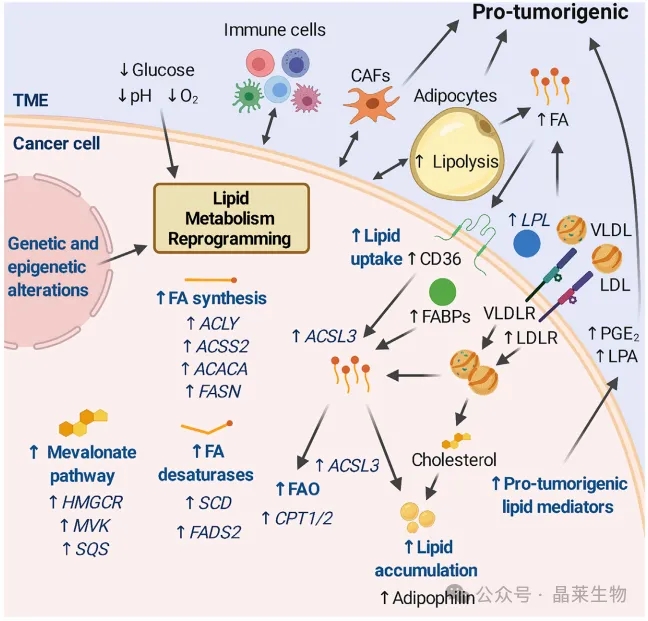
图中概述了可以改变的途径,描述了上调蛋白的例子,以及肿瘤细胞可以与TME相互作用的关键参与者。一些肿瘤可诱导邻近脂肪细胞脂解,释放FA, FA可被癌细胞吸收,支持脂质积累和FAO。脂蛋白也可以作为脂质来源被肿瘤细胞吸收。不同的免疫细胞都能发挥抗肿瘤作用,但其功能往往被肿瘤破坏,导致免疫抑制甚至致瘤状态。脂质介质的产生也可以确定肿瘤的进展,例如促进血管生成或影响免疫室。
不同的肿瘤采用不同的适应机制,这证明了肿瘤中脂质代谢的异质性。
2. 膜脂在致癌信号传导中作用
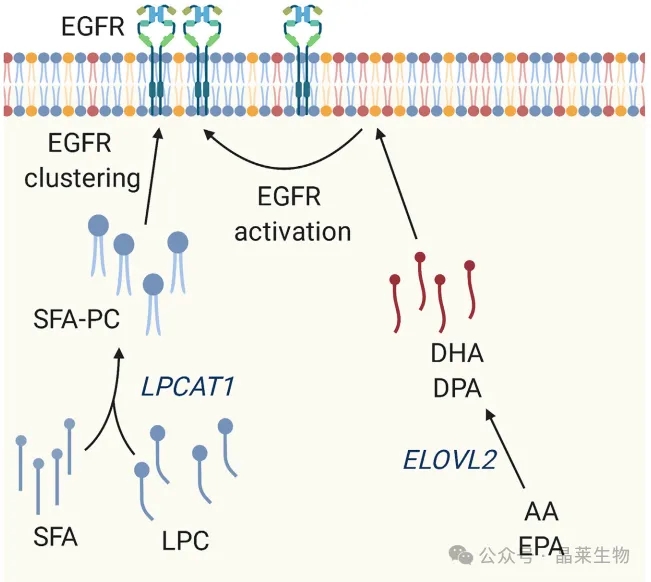
膜磷脂的组成可能在调节细胞表面受体信号传导中发挥关键作用,例如通过调节EGFR聚集。LPCAT1对SFA有底物偏好,通过凝聚SFA和LPC,它产生饱和的PC,这种膜脂谱的转变促进了EGFR在质膜上的聚集。ELOVL2通过介导AA或EPA的伸长来增加DHA和DPA在磷脂中的掺入。同样,这些磷脂被认为可以改变质膜,从而促进EGFR的激活。
3. 脂质相关的机制支持癌症转移
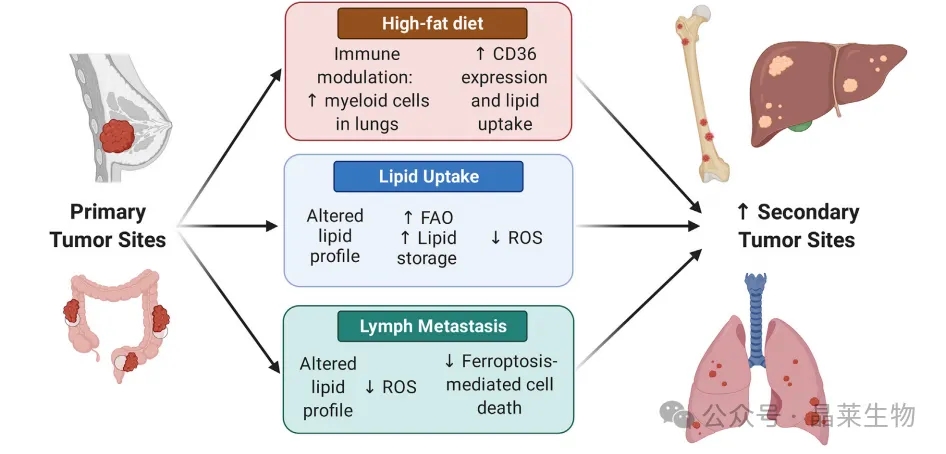
由于饮食和肿瘤微环境(TME)中的脂质可用性,可以以多种方式影响转移性进展。一些临床前模型发现,高脂饮食(HFD)喂养会增加包括乳腺癌和结肠癌原发肿瘤在内的几种小鼠模型的继发性肿瘤位点。脂质可用性可能通过为能量产生和支持细胞增殖的生物合成过程提供脂质底物来增强转移。高脂饮食喂养还显示会调节肺部的髓样细胞群,与增加的肺转移相关。增加的脂质摄取,部分由CD36表达升高所驱动,与相邻的正常组织和原发肿瘤组织相比,在转移性肿瘤组织中创建了改变的脂质特征。
转移性肿瘤表现出增加的脂肪酸氧化(FAO)、增加的脂滴(LDs)中的脂质储存,以及随后减少的活性氧(ROS)产生。当播散的细胞通过富含油酸的淋巴系统时,它们的淋巴转移也表现出改变的脂质特征。最近的研究表明,淋巴转移表现出减少的ROS产生和铁死亡细胞死亡,部分原因是油酸摄取的增加。
许多机制可能参与脂质介导的转移,支持如骨、肝和肺等组织中的继发性肿瘤发展。
4. 肿瘤微环境中免疫细胞的代谢表型
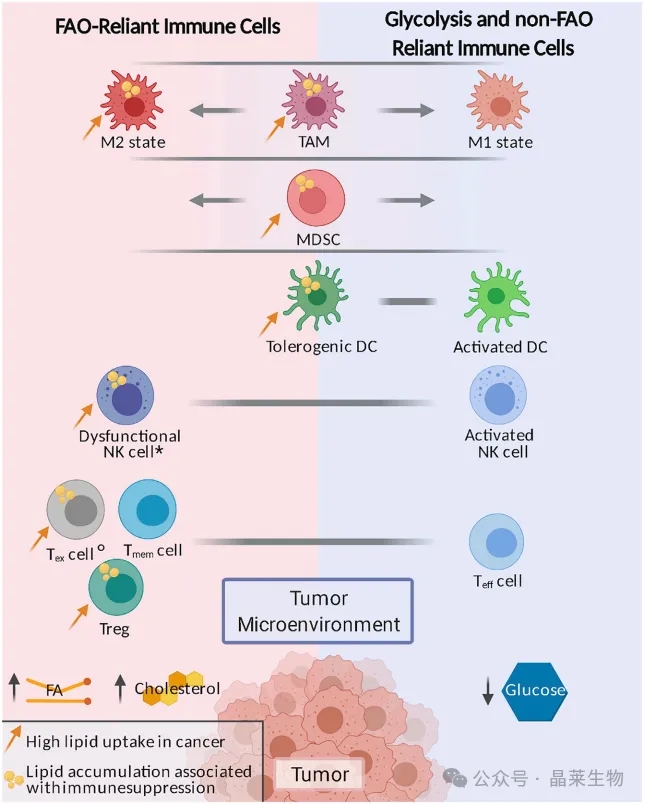
大多数与肿瘤相关的免疫细胞都显示出偏向于糖酵解或脂肪酸氧化(FAO)的代谢程序。髓源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs)可以呈现出一系列广泛的代谢表型(由褪色的条幅表示)。
肿瘤微环境中的低葡萄糖和高脂肪酸水平支持依赖脂质的代谢程序,而某些免疫细胞中的脂质积累与促肿瘤发生和免疫抑制表型相关。
5. 癌症治疗种脂质代谢途径的抑制剂
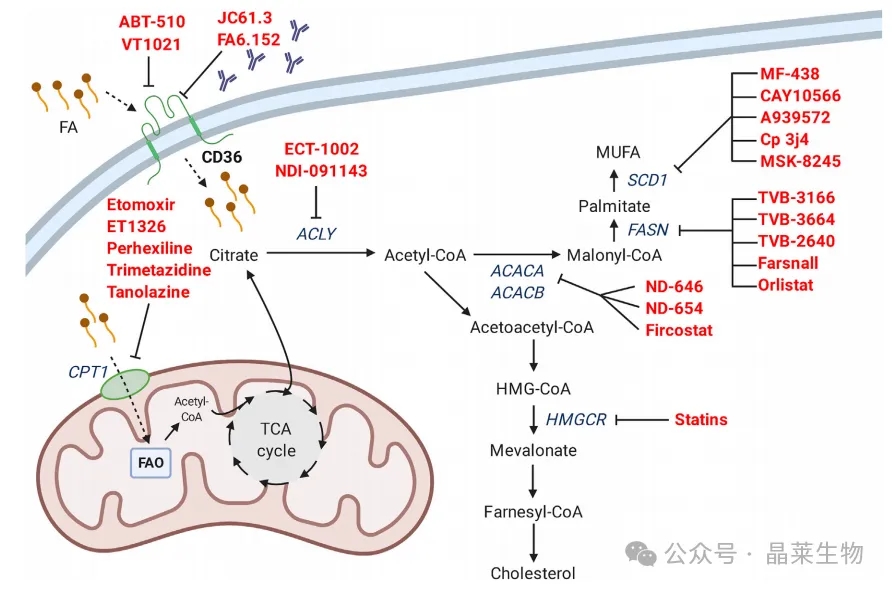
① 通过直接抑制剂(如凝血酶敏蛋白-1类似物VT1021和ABT-510)、抑制性抗体(如JC61.3、FA6.152)来抑制CD36脂肪酸转运酶,可以减少脂肪酸的摄取。防止脂肪酸进入线粒体可以阻止线粒体脂肪酸氧化,并损害细胞代谢和柠檬酸的产生,进而抑制脂肪生成。
② 目前有多种线粒体脂肪酸转运体CPT1的抑制剂,包括依托莫司他、ET1326、派克昔林、曲美他嗪和塔诺拉唑。通过药理学干预可以在多个点抑制新脂肪生成。ECT-1002和NDI-091143可以抑制ACLY,阻止乙酰辅酶A的产生,进而抑制ACACA和ACACB限速且不可逆的羧化为丙二酰辅酶A。ACACA/ACACB的直接抑制剂包括ND-646和ND-654化合物以及fircostat。丙二酰辅酶A通过FASN转化为新脂肪生成产生的第一种脂肪酸——棕榈酸。
③可用的FASN抑制剂包括TVB化合物(TVB-3166、TVB-3664、TVB-2640和farsnall)。棕榈酸的进一步加工可以包括转化为MUFA(单不饱和脂肪酸),而SCD1催化限速步骤,在碳链中引入双键。这种酶可以由多种化合物抑制(MF-483、CAY10566、A939572、Cp 3j4和MSK-8245)。他汀类药物是一类已在临床上用于治疗心血管疾病的药物,在HMGCR的限速步骤上抑制胆固醇合成。
脂质代谢与铁死亡研究
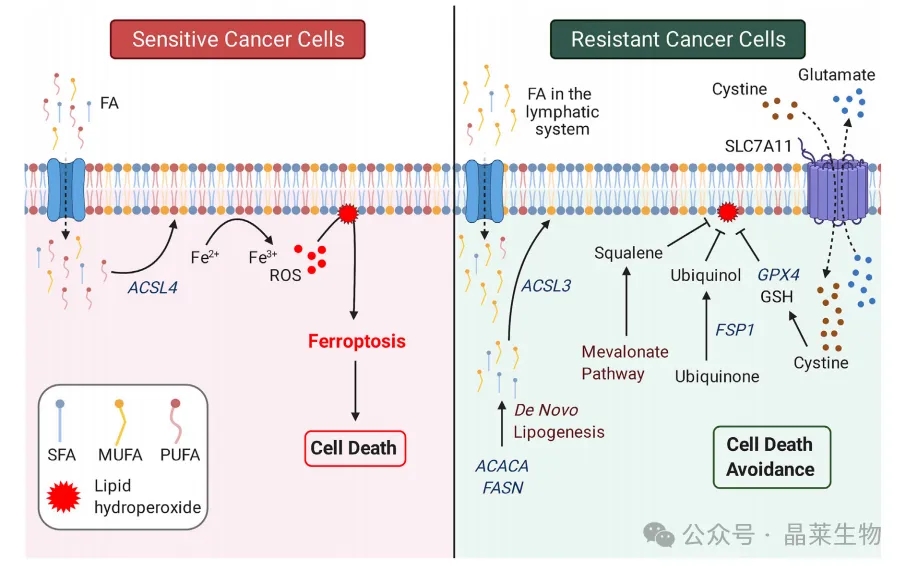
1. 铁死亡是一种依赖于铁的细胞死亡形式,它依赖于多不饱和膜磷脂的过氧化。几种基于脂质的机制可以协同作用,促进或降低铁死亡的敏感性。增加的脂质摄取可以使癌细胞膜富含多不饱和脂肪酸(PUFA)种类并促进铁死亡。与从头合成的脂肪酸(FA)相比,饮食和基质来源的外源性脂肪酸通常更富含PUFA,尤其是大多数正常组织的脂肪生成较低。
2. ACSL4是一种酶,它在将PUFA种类整合到膜脂质中很重要,因此可以使细胞对铁死亡更敏感。相比之下,某些环境如淋巴液富含单不饱和脂肪酸(MUFA),如油酸。在这种情况下,增加的外源性脂质摄取会使细胞膜富含MUFA,从而使细胞在ACSL3依赖的过程中对铁死亡产生抗性。
3. 与ACSL4相反,ACSL3在某些癌症模型中被证明是将MUFA整合到膜中所必需的。此外,产生饱和脂肪酸(SFA)和MUFA作为最终产物的升高的脂肪生成,会使膜富含对铁死亡具有抗性的磷脂种类。此外,提高细胞的抗氧化潜力足以抑制铁死亡。
4. 图中已经描述了几种机制,其中最引人注目的是胱氨酸转运蛋白SLC7A11在驱动GSH合成中的作用,以及GSH依赖的膜磷脂过氧化物酶GPX4的作用。同时,还已知其他关键的GSH非依赖性抗氧化机制。这些包括FSP1依赖的产生强效抗氧化剂泛醌(ubiquinol)以及下游于甲羟戊酸途径合成的自由基清除烃类角鲨烯(squalene)。
脂质代谢是一个远未结束的话题。鉴于越来越多的小分子抑制剂在组织靶向作用方面越来越好,脂质靶向治疗策略仍然有很多机会。
晶莱生物
以上部分信息来源于文献和网络,如有侵权请联系客服删除。
关于晶莱