【五分钟讲实验】各类体外细胞实验合集详解!
时间:2024-04-08 阅读:1263今天小编整理了多种体外细胞实验的干货共大家学习和参考:MPC5足细胞缺氧模型、脊索样细胞诱导分化成髓核样细胞、人诱导多功能干细胞(hiPSC)诱导分化成脊索样细胞、大鼠脂肪间充质干细胞成脂诱导模型、3T3-L1细胞成脂诱导模型、乳鼠二型肺泡上皮细胞(AECII)分离提取。
1. 实验背景
脂多糖(Lipopolysaccharide)(英文简写LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的物质(糖脂质)。脂多糖由三部分组成:类脂A、核心多糖、O-抗原。LPS中的类脂A部分作为脂质双分子层外层的组成部分进入到脂质层中,糖链部分暴露在细胞外面,然后以这种形式存在于革兰氏阴性细菌的细胞表面。在LPS的生理活性表现中被认为起到最重要作用的是类脂A部分,类脂A可以单独体现其生理作用 。LPS很难从细胞壁脱落,当细菌死亡等时它会通过溶解、破坏细胞来脱落,并通过作用于动物细胞等而发挥其毒性。由于这种性质,它不是细菌分泌到体外的毒素(外毒素),而是不被分泌的"存在于细菌体内的毒素",所以又被称为内毒素。
内毒素模型是将纯化的LPS直接注射人动物体内构建的,由于其致病因素单一、能够排除其他影响因素,而成为研究细菌感染单一成分在感染引起的炎症反应中的发病机制的理想模型1。LPS是革兰氏阴性菌细胞壁最外层的一层较厚(8~10nm)的类脂多糖物质,因其在免疫调节方面的特性而成为医学研究的兴趣点。
2. 实验材料
① 实验细胞:RWPE-1细胞。
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机
③ 试剂:0.25% 胰蛋白酶、双抗、胎牛血清、PBS、RWPE-1细胞专用培养基、
3. 实验操作
① 取LPS粉末溶于无菌水使其母液浓度为5mg/ml,0.22um过滤器过滤;
② 用细胞专用培养基稀释LPS母液;
③ 细胞铺板24h后,弃上清加入配制好的LPS溶液;
④ 37℃ 5%CO2培养箱继续孵育24h;
⑤ 检测相应炎症指标。
4. 评价方法
① ELISA检测细胞炎症因子表达(IL-1、IL-6、IL-18、TNF-α等);
② 试剂盒检测ROS、LDH、SOD、MDA等;
③ 流式/免疫荧光检测ROS、JC-1等;
④ PCR/WB检测炎症因子基因和蛋白水平的表达等。

5. 经验总结
① LPS可溶于DMSO,也可溶于水,为了减少溶剂对细胞的影响,可选择水去溶解LPS,最大溶解度为5mg/ml;
② LPS诱导细胞炎症反应,一定浓度诱导细胞不一定会出现细胞死亡的情况,因此不宜选用CCK8法去选择LPS造模浓度,可选择检测多个炎症因子去筛选浓度;
③ 不同厂家品牌的LPS货号不同引起的炎症反应不一定相同,还需客户自己选择。
MPC5足细胞缺氧模型
1. 实验背景
正常情况下,细胞体外培养需5%CO2与95%空气环境,然而,降低培养环境的氧分压或使细胞用氧障碍可以造成缺氧状态,目前常用的缺氧方法有物理性缺氧法和化学性缺氧法。
① 物理性缺氧法:通过降低培养环境的氧分压造成细胞缺氧性损伤,类似于体内发生的低张性缺氧。
② 化学性缺氧法:在培养基中加入化学物质,造成细胞用氧障碍或使培养基内的氧气耗尽,如在培养基内加人氰化物、连二亚硫酸钠等。化学缺氧模型制备简单,但由于添加的物质可能会改变培养基的化学成分,且添加剂本身对细胞有损伤作用,增加了实验的混杂因素,需慎重选用。
③ 联合缺氧法:2种或2种以上方法联合使用可使细胞缺氧更为明显。例如:在培养基中添加连二亚硫酸钠,然后,将细胞放入95%N2+5%CO2密闭容器中,连二亚硫酸钠已使培养基内氧气耗尽,再置入无氧外环境即可造成稳定的细胞缺氧。
2. 实验材料
① 实验细胞:MPC5细胞
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机、酶标仪、三气培养箱
③ 试剂:0.25% 胰蛋白酶、双抗、胎牛血清、PBS、DMEM培养基、CCK8
3. 实验操作
① 细胞铺两块96孔板,
② 37℃,5%CO2箱中孵育24h后,细胞换液;
③ 将其中一块96孔板放置在设置缺氧的三气培养箱中培养;
④ 培养至低氧细胞出现明显损伤后分别取出96孔板;
⑤ 吸去培养基,向每孔中加入100μL CCK-8混合液;37℃,5%CO2箱中孵育1-2h;
⑥ 酶标仪测定在450 nm处的吸光度。
4.评价方法
① CCK8检测;
② 显微镜下观察细胞形态。

5. 经验总结
① 细胞经过常氧与低氧处理时,要控制好两块培养板内的细胞密度,必须同时铺板,保持细胞密度一致。
② 细胞铺板后需要在常氧下稳定培养24h,使其细胞能正常贴壁生长,24h后需同时更换新鲜培养基后在进行常氧与缺氧分别处理。
③ 低氧模型时间长短需要实时观察细胞是否有损伤,不同的细胞缺氧模型的氧浓度和细胞损伤时间还需以具体实验为准。
脊索样细胞诱导分化成髓核样细胞
1. 实验背景
椎间盘再生研究中,脊索细胞独特的生理功能受到关注。成人髓核内脊索细凋亡与髓核内蛋白多糖含量降低、胶原含量增加、水含量丢失相关.脊索细胞分泌的可溶性因子具有引导终板软骨细胞向髓核迁移,调节髓核细胞蛋白多糖合成的作用。脊索细胞可促进髓核软骨样细胞增殖和表型维持,在维持髓核内细胞数量及细胞外基质含量中起着重要作用。脊索细胞独特的生理功能,在组织工程修复退变椎间盘研究中展现出广阔的应用前景。
2. 实验材料
① 实验细胞:脊索样细胞。
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机。
③ 试剂:0.25% 胰蛋白酶、双抗、hiPSC细胞专用培养基、ITS、NEAA、抗坏血酸、L-脯氨酸、地塞米松及TGF-β3。
3. 实验操作
采用含有1%的ITS、1%的NEAA、1%的青链霉素、50ug/ml抗坏血酸、40ug/ml的L-脯氨酸、10nM的地塞米松及10ng/ml的TGF-β3的DMEM-HG培养基进行诱导,细胞诱导15天以上,实时观察拍照。
4. 评价方法
① 可测定空泡细胞;
② 流式细胞荧光分选空泡细胞的GD2/TIE2的表型;
③ 免疫荧光染色分析各组细胞中GD2(双唾液酸神经节苷脂2)、TIE2(TEK受体酪氨酸激酶2)、II型胶原、aggrecan、T及NOTO的表达。

5. 经验总结
① 细胞诱导过程中需每天更换诱导培养基,已满足细胞营养需求,若细胞出现较多死亡,及时更换成正常细胞完全培养基进行过度。
② 细胞诱导周期较长,容易出现细胞扎堆情况,拍照时尽量选择细胞单层生长的区域去拍照。
③ 诱导后期镜下观察出现大量空泡细胞,即可收集样本验证诱导是否成功。
人诱导多功能干细胞(hiPSC)
诱导分化成脊索样细胞
1.实验背景
诱导性多能干细胞(Induced pluripotent stem cells,iPSCs)技术是指通过导入特定的转录因子将终末分化的体细胞重编程为多能性干细胞。分化的细胞在特定条件下被逆转后,恢复到全能性状态,或者形成胚胎干细胞系,或者进一步发育成新个体的过程即为细胞重编程(Cell reprogramming)。分化是基因选择性表达的结果,并没有改变遗传物质,而重编程在某种意义上就是分化的一个逆转。
与经典的胚胎干细胞技术和体细胞核移植技术不同,iPSCs技术不使用胚胎细胞或卵细胞,因此没有伦理学问题。此外,利用iPSCs技术可以用病人自己的体细胞制备专有的干细胞,从而大大降低了免疫排斥反应发生的可能性。iPSCs的岀现,在干细胞、表观遗传学以及生物医学等研究领域都引起了强烈的反响,使人们对多能性的调控机制有了突破性的新认识,进一步拉近了干细胞和临床疾病治疗的距离。
iPSCs在细胞替代性治疗以及发病机理的研究、新药筛选以及神经系统疾病、心血管疾病等临床疾病治疗等方面具有巨大的潜在价值。
2. 实验材料
① 实验细胞:hiPSC细胞。
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机。
③ 试剂:0.25% 胰蛋白酶、双抗、hiPSC细胞专用培养基、ACTIVIN A、CHIR、NOGGIN、AGN193109、FGF2。
3. 实验操作
① 取hiPSC细胞复苏和扩培后测定细胞数量,
② 当细胞量密度大于5*105/cm2时,
③ 加入10ng/ml的ACTIVIN A,3uM的CHIR,50ng/ml的NOGGIN,10uM的AGN193109,及10ng/ml的FGF2处理细胞,
④ 培养到第5天左右,实时观察细胞形态变化,
⑤ 收集爬片做免疫荧光验证等。

4. 评价方法
可用IF或qPCR分析细胞NOTO、T及FOXA1、Chordin、FOXJ1、Noggin、及SHH的表达,来评价脊索样细胞诱导分化成功。
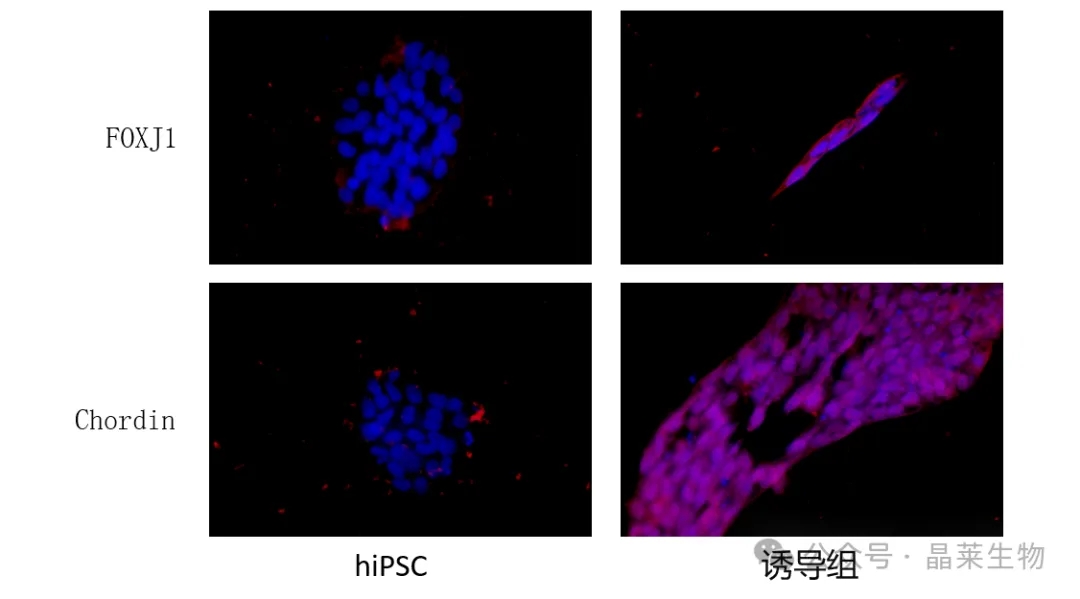
5. 经验总结
① 培养前一天,提前包被人多潜能干细胞铺底工作液的培养皿/瓶,并加入适量复苏完全培养基,置于5% CO2的37℃恒温细胞培养箱中。细胞复苏需使用复苏专用培养基,可大大提高细胞的复苏效率。复苏过程中,转移细胞、吹打混匀和重悬细胞时,吹打力度要轻柔,并尽量减少吹打次数,细胞接种后,即刻在显微镜下观察细胞团块的大小,4 ~ 10个细胞的团块为最佳。如果吹打力度过大或次数过多,导致细胞分散成单细胞,细胞复苏率将偏低。
② 细胞培养需每天更换新鲜完全培养基,以满足细胞营养需求,诱导过程中也需每天换液。
大鼠脂肪间充质干细胞成脂诱导模型
1. 实验背景
间质干细胞向成骨细胞的分化是理解骨形成机制的有力工具,它也被用于鉴别骨质疏松症、骨修复和成骨不全等遗传紊乱疾病。同其他组织器官一样,骨组织也在不断地进行着细胞代谢,称为骨代谢。它可以大致分为骨形成和骨重塑两个阶段,前者在个体生长发育期起主要作用,后者则持续整个生命周期。
成骨分化是骨生成的关键步骤,即骨髓间充质干细胞经历骨原细胞(osteoprogenitor cells)、成骨前体细胞(pre-osteoblasts)、成熟的骨细胞(osteoblasts)和终末阶段的骨细胞(osteocytes)的一个复杂的过程,其中涉及到多种类型细胞间和细胞内的信号传递,如信号通路、转录因子、生长因子、MicroRNA 等,形成了一个完整的骨代谢调控负反馈环路。
2. 实验材料
① 实验细胞:大鼠脂肪间充质干细胞。
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机。
③ 试剂:0.25% 胰蛋白酶、100x双抗、大鼠脂肪间充质干细胞专用培养基、成骨诱导分化试剂盒,茜素红S染色液。
3. 实验操作
① 当大鼠脂肪间充质干细胞的融合度达到80-90%时,即可用0.25%胰酶进行消化。
② 将消化下来的细胞,根据细胞即时的生长速度估算,接种一定量的细胞(接种后第二天的汇合度能达到70-80%)于6孔板中,每孔加入2ml专用完全培养基培养。
③ 将细胞置于37℃,5%CO2的培养箱中培养。
④ 当细胞融合度达到70-80%(或>80%)时,小心将上清吸走,加入2ml大鼠脂肪间充质干细胞成骨诱导分化培养基。
⑤ 每隔三天换用新鲜的大鼠脂肪间充质干细胞成骨诱导分化培养基。
⑥ 诱导2-4周后,视细胞的形态变化及生长状况,使用茜素红S染色液进行鉴定。
4. 评价方法
茜素红S染色:茜素红S是一种蒽醌类衍生物,能和多种金属离子螯合生成稳定的橙红色或深红色的复合物,是一种良好的金属指示剂,也可作为吸光度法测定金属离子的显色剂,还可作为酸碱指示剂,或用于极谱法测定金属离子。在组织学和组织病理学中,由于茜素红S可与碳酸钙或磷酸钙中的钙盐螯合形成橙红色复合物,而常用于染色或定位组织中的钙质沉积。

5. 经验总结
① 大鼠脂肪间充质干细胞成骨诱导时,融合度尽量达到80%,或者更高,诱导时可能会使细胞有所损伤导致后期产生骨细胞量少,但融合度一定不能低于70%。
② 换诱导培养基的频率大致保持在3天一次,如果期间细胞产生的排泄物导致培养基内杂质多便可以马上换液,不可以过度延长换液时间,导致细胞死亡。
③ 为了减少诱导过程中细胞飘起、不贴壁,铺板前可先铺明胶包被细胞板底部,换液时尽量轻轻加入诱导培养基,不要将细胞吹起,导致细胞脱落。
3T3-L1细胞成脂诱导模型
1. 实验背景
细胞生物学方面,前脂肪细胞是一类同时具有增殖及分化为成熟脂肪细胞能力的前体细胞,此种前体细胞在不同的生长因子、激素等的作用下,经历有丝分裂克隆期、生长停滞期、进一步的克隆期 终末分化四个阶段,细胞本身的成纤维状态发生改变,通过胞质内甘油三酯聚集形成成熟脂肪细胞,这一过程,称为“成脂分化”,该过程一直是肥胖研究领域的热点。
为了能够直观地了解细胞分化内部脂质累积的过程,需要在体外建立数量可控,分化较为稳定的成熟脂肪细胞分化模型。3T3-L1细胞 (小鼠胚胎成纤维细胞)是通过克隆分离得到的3T3(swiss小白鼠)的连续亚株。当3T3-L1细胞从快速分裂到长满且接触抑制时,3T3-L1细胞在适当的诱导下前脂肪可向脂肪样逆转。
2. 实验材料
① 实验细胞:3T3-L1细胞。
② 器械:超净工作台、CO2培养箱、生物倒置显微镜、台式低速离心机。
③ 试剂:0.25% 胰蛋白酶、双抗、3T3-L1细胞专用培养基、成脂诱导分化试剂盒。
3. 实验操作
① 加1ml 0.1%明胶到六孔板中,摇匀,使其能覆盖各孔底面。
② 将铺有0.1%明胶的六孔板放置在超净台或CO2培养箱至少30min。
③ 30min后吸去明胶即可用于接种细胞;
④ 将细胞接种于六孔板,37℃、5%CO2培养。
⑤ 当细胞汇合度达到100%时,小心地将孔内完全培养基吸走,向六孔板中加入2ml OriCell®小鼠细胞成脂诱导分化培养基A液。
⑥ 诱导3天后,吸去A液,加入成脂诱导分化培养基B液。
⑦ 维持1天后,换回A液进行诱导。
⑧ A液和B液交替使用。
⑨ 重复诱导和维持过程,直到出现足量、大小适宜的脂滴,即可油红O染色。

4. 评价方法
油红O脂肪染色法是指在日常病理诊断和科研工作中为了显示组织或细胞内的脂肪常采用油红O进行染色的方法,油红O为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织或细胞内甘油三酯等中性脂肪着色。可将油脂染成红色,显微镜下观察染色情况即可评估细胞的成脂性。
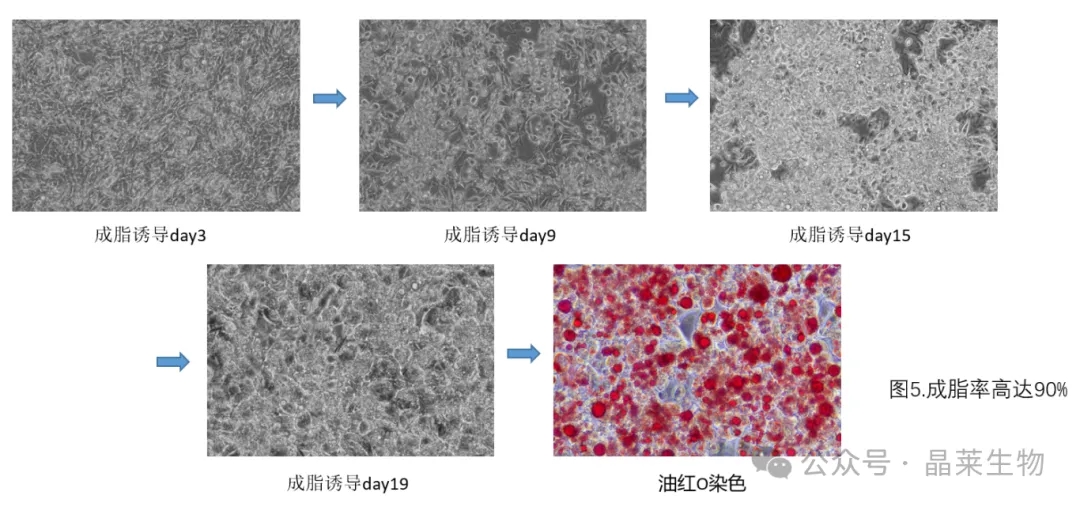
5. 经验总结
① 油红O染色后尽快拍照,或者用封口膜封装后置于4℃,不要超过一周,油脂会相互融合,无法保持染色时的状态。
② A液刺激脂滴形成,B液维持已形成的脂滴,并促进脂滴增大。通常情况下按照“A液3天,B液1天”的使用方法,也可根据细胞状态灵活调整A液、B液的使用比例。
③ 为了减少诱导过程中细胞飘起、不贴壁,铺板前先铺明胶包被细胞板底部,诱导时间过长也有可能出现细胞层卷边情况,若已有足量、大小合适的脂滴,即可染色收集。
乳鼠二型肺泡上皮细胞(AECII)分离提取
1. 细胞简介
二型肺泡细胞(ATⅡ)又称颗粒肺泡细胞,散在分布于ATⅠ肺泡细胞(ATⅠ)之间及其相邻的肺泡间隔结合处。其体积较小,呈立方形,表面稍突向肺泡腔。细胞核大而圆,胞质染色较浅淡,胞质中常见空泡。数量较ATⅠ多,ATⅡ占肺泡上皮细胞总数的14%到16%,但仅覆盖5℅的肺泡表面。二型肺泡细胞能分泌颗粒内容,在肺泡上皮表面形成表面活性物质,具有降低肺泡表面张力,稳定肺泡大小的重要作用。
2. 原代分离提取步骤
① 将乳鼠移入超净台,从胸部横断乳鼠,小心取出双肺置于预冷的PBS液中,尽可能除净残留的气管组织和结缔组织等非肺组织,PBS液清洗2~3次,用锋利眼科剪将肺组织剪为1mm3 左右大小的组织碎块,用0.25%胰酶(含0.01% DnaseⅠ)溶液清洗1次,然后继续用0.25%胰酶(含0.01% DnaseⅠ)溶液于37℃搅动消化10~20min。
② 用等量10%FBS的DMEM/F12(完全培养基)终止消化,200目筛网过滤后,1500r/min低温离心5min,去上清,收集沉淀,0.1%Ⅰ型胶原酶 37℃,5% CO2 孵箱内消化10~20min。
终止消化仍用等量含10%FBS的DMEM/F12,1000r/min离心5min,收集细胞沉淀。
③ 将细胞悬液接种入培养瓶中,置37℃,5% CO2培养箱内孵育45min,此时贴壁的细胞多为成纤维细胞,悬在培养液中的细胞多数为AECⅡ、部分成纤维细胞及其他杂细胞。
④ 将培养液吸出接种于另一培养瓶中,同样继续37℃孵育40min,连续2~3次,最后吸出培养液,800r/min离 心5min,去上清,用含10%胎牛血清的DMEM/F12重悬细胞沉淀,按密度为4*105个细胞/cm2 接种于培养瓶中,37℃,5% CO2条件下培养24h后换液,去除未贴壁细胞继续培养3~6d,倒置显微镜观察细胞生长状态和形态特征。培养48h细胞状态良好,可进行进一步的后续实验。
3. 乳鼠二型肺泡上皮细胞(AECⅡ)质量评价
① 台盼蓝染色法
活细胞计数:台盼蓝染色后显微镜下进行细胞计数,计算细胞存活率(活细胞数/细胞总数×100%)。
② AECⅡ形态特征观察
体外原代培养的AECⅡ约18h已经贴壁生长。
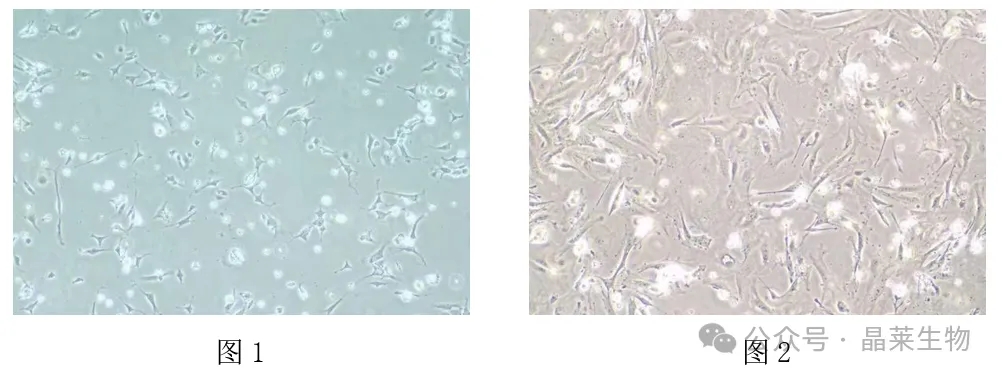
培养24h,细胞伸展呈多边形或立方形,聚集成岛状生长,细胞之间连接紧密,细胞胞质丰富,内含大量反差明显的细小颗粒(图1)。
培养36~48h,细胞平展呈多边形,逐渐融合,相互连接成细胞单层。培养大约72h后,细胞逐渐变得扁平,细胞内颗粒较前减少,有排空现象,胞质颜色变淡(图2)。
③ 透射电镜观察
细胞消化后,离心,收集细胞沉淀。经戊二醛固定处理程序后,制成电镜细胞标本,用电镜观察细胞特征性的超微结构,可见黑色颗粒状特征性的板层体,细胞膜上有明显的微绒毛。
④ 纯度鉴定
经SP-C免疫荧光鉴定细胞纯度。
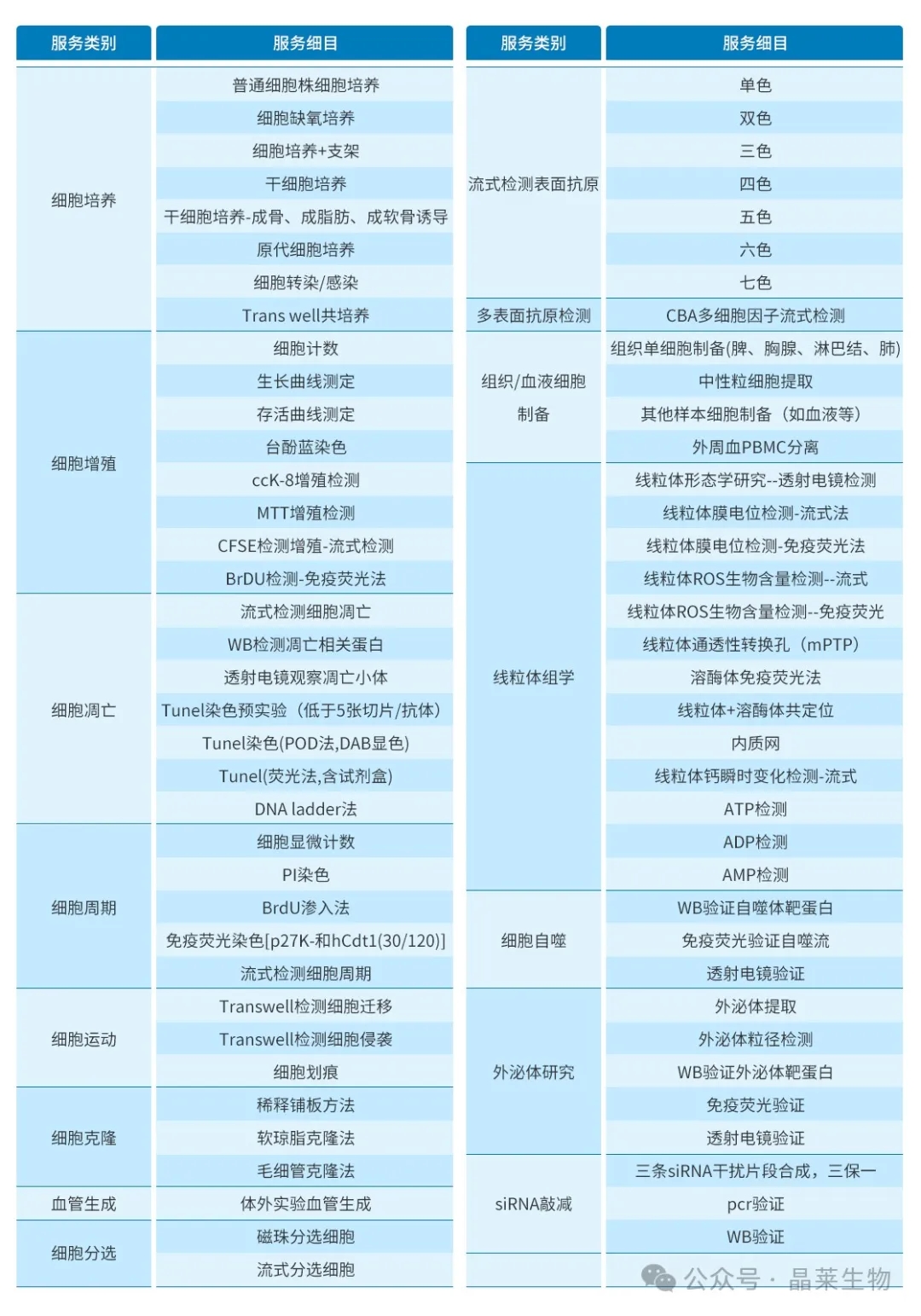
晶莱细胞实验服务
晶莱生物为研发者提供细胞培养、细胞增殖、细胞周期、细胞凋亡、细胞运动、细胞克隆等多种细胞实验服务,可直接用于相关体外细胞模型研究。
晶莱生物
以上部分数据与结果图来源于网络和文献,如有侵权请联系客服删除。
关于晶莱
关注公众号,了解更多!