【泌尿生殖系统疾病模型】肾病动物模型构建大全及案例分析!
时间:2024-03-04 阅读:1925肾病大体分为急性肾炎和慢性肾炎。
急性肾炎是急性肾小球肾炎的简称,大多数是因为感染性疾病所继发的肾小球免疫性损伤,以链球菌感染后肾小球肾炎最为常见。本病好发于小孩,以一过性全身浮肿、血尿、少尿和高血压为特征表现。扁桃体和皮肤链球菌感染是急性肾炎的主要前驱病因,所以预防链球菌感染为最有效措施。
慢性肾炎是我国当前最常见的慢性肾脏病病种,它是一组多病因,以免疫炎症机制及非免疫机制引起的肾小球疾病,多数患者与链球菌感染并无明确关系。
由于我们接触的更多的是慢性肾炎,所以后续更多的是围绕慢性肾炎展开来讲。


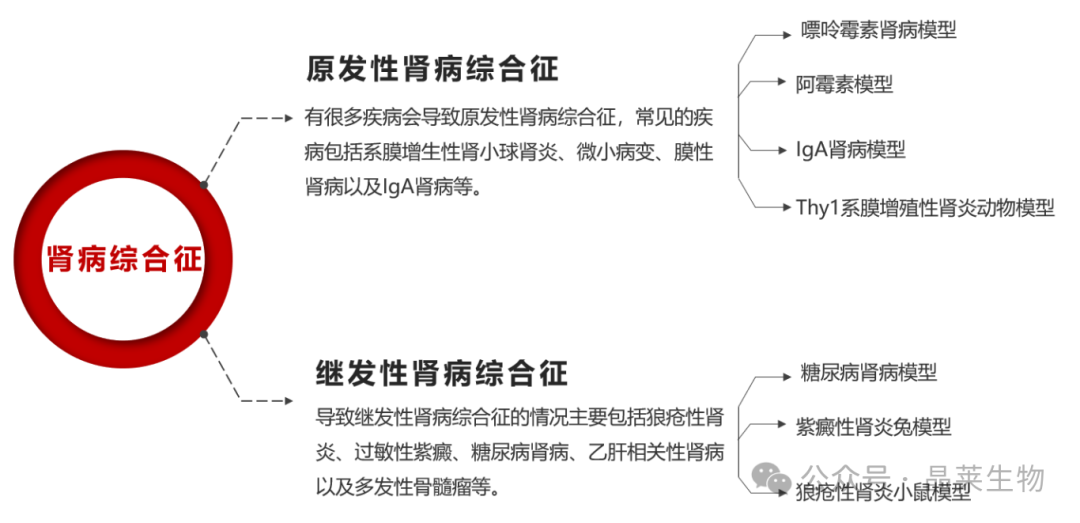
膜性肾病--海曼肾炎模型
膜性肾病( MN) 是成人肾病综合征常见病理类型之一,其中大鼠 Heymann 肾炎(HN) 模型的病理改变及表现与人类膜性肾病十分相似,已作为国内外公认的研究人类膜性肾病的大鼠动物模型。
HN又可以分为主动型海曼肾炎(AHN)与被动型海曼肾炎(PHN)两种。
常用的造模方法:
① AHN:Fx1a或megalin(Gp330)免疫诱导进行造模。
② PHN:将AHN中的抗原沉淀注射给兔子或羊,使之产生相应的抗血清,然后注射给大鼠进行造模。
(图片来源于网络)
1. 实验方法
① 动物选择:使用5周龄SD大鼠作为实验动物。
② 实验材料:代谢笼,采血管,1ml注射器。
③ Fx1A抗体制备:Fx1A抗体通常是从Heymann肾炎患者的血清中提取或通过免疫化动物(如兔、羊)来制备,亦可进行购买 (PTX-002S, 0.8mL/100g, Probetex, San Antonio, USA)。
④ 诱导炎症:将大鼠随机分为实验组和对照组,对照组大鼠尾静脉注射等体积生理盐水,而实验组尾静脉注射羊抗鼠Fx1A血清(0.8mL/100g)。
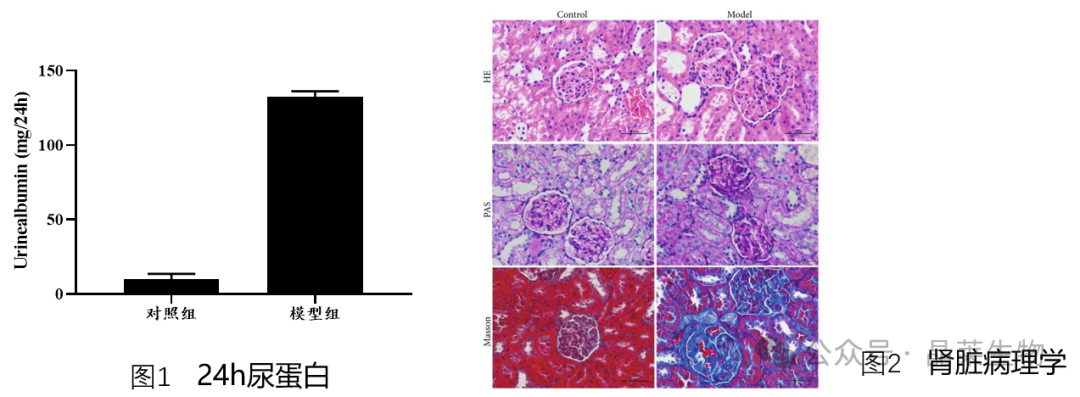
⑤ 监测症状:检测大鼠尿蛋白定量。检测蛋白定量大于20mg/24h,视为造模成功。
⑥ 病理学评估:在实验结束后,对大鼠的肾脏进行解剖学和病理学检查,观察肾小管萎缩、扩张、肾小管类型、间质炎症和间质纤维化等病变。

2. 评价指标
① 尿液分析:尿蛋白量、红细胞尿、尿液比重。
② 血液生化指标:肾功能标志物(血清肌酐和血清尿素氮(BUN) 等)。
③ 组织学评估:肾脏病理学( HE染色、 PAS染色、 Masson染色) 。
④ 免疫学参数:抗体水平、炎症标志物。
3. 模型特点
① 被动型 Heymann肾炎的一个主要特征是肾小球滤过膜的破损从而导致蛋白质从尿液中泄漏。因此,蛋白尿量是模型评价的关键指标。
② Heymann抗体与肾小球抗原结合后,免疫复合物在肾小球的毛细血管内膜和基底膜上沉积。这会引发炎症反应和细胞损伤,类似于自身免疫性肾炎的病理机制。
③ 模型表现出肾小球的病理学变化,包括肾小球体积增大、基底膜增厚、细胞浸润、免疫复合物沉积等特点。这些变化类似于人类免疫性肾炎的病理学特征。
④ 成模率:90%以上。
4. 注意事项
① 抗体制备是Heymann肾炎模型的关键步骤。抗体通常由狗或兔子免疫Heymann抗原蛋白制备,要确保抗体制备的质量和纯度,以减少非特异性效应。
② 尿蛋白是Heymann肾炎模型的关键指标,使用代谢笼收集尿液时,要防止粪便和大鼠嚼碎的饲料掉入影响实验结果。
③ Heymann肾炎的发病和病程会随时间而变化,研究不同阶段的肾病变要选择适合的实验时间点。
④ 尾静脉注射要求实验人员技术成熟(二级实验员),才能保证每只老鼠都能造模成功。
⑤ 收集代谢笼保证时间的固定,确保是24小时的全部尿液。
⑥ 造模成功后应密切观察大鼠情况,因为可能会出现四肢肿胀,肚子变大等相关症状。
5. 风险评估
① 多数情况下尿蛋白在大鼠抗血清注射7d左右开始明显升高,在14-28天开始缓解回落,但由于大鼠的个体差异及抗血清效价的不同,蛋白尿的程度可能有不同,可添加肾脏免疫荧光及电镜拍照作为模型验证的辅助指标。
② 模型制备是否成功与注射鼠抗 Fx1A 血清的部位和剂量密切相关,目前常用给药方式有腹腔注射、尾静脉注射,其中尾静脉注射血清吸收速率快、体内分布均匀,但尾静脉操作相对困难,腹腔注射可减轻由于尾静脉注射导致的疼痛刺激且操作较为简单,可根据实验目的选择合适的给药方式。
③ 在成功构建了被动型 Heymann 肾炎模型之后,其稳定性问题仍需继续关注,大鼠体内足细胞自噬等机制可能导致 PHN 模型中蛋白尿出现自发缓解而影响 PHN 模型的稳定性。
6. 应用方向
① 肾病发病机制研究:通过模拟肾炎模型,研究肾病的发病机制,包括免疫反应、免疫复合物形成、肾小球和肾小管的病理变化等。
② 新药物筛选:评估候选药物对肾炎疾病的潜在疗效,寻找治疗靶点和药物。
③ 免疫学研究:研究免疫细胞、免疫因子和免疫通路在肾炎发病中的作用,以揭示免疫性肾脏疾病的机制。
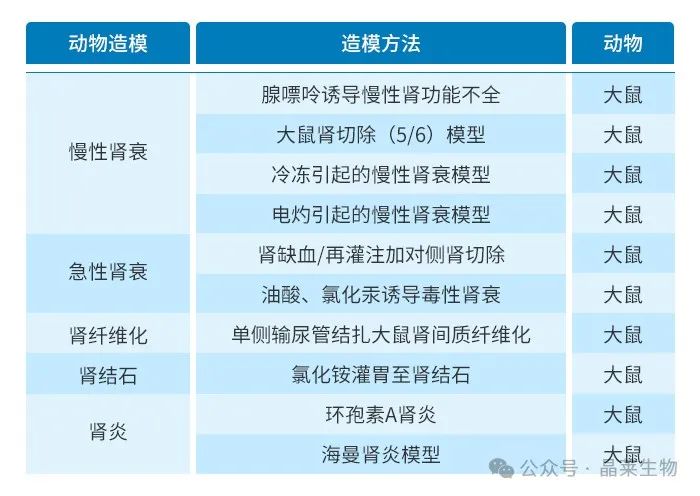
1. 慢性肾功能衰竭模型
慢性肾功能衰竭(CRF)又称慢性肾功能不全,是指各种原因造成的慢性进行性肾实质损害,致使肾脏明显萎缩,不能维持其基本功能,临床出现以代谢产物潴留,水、电解质、酸碱平衡失调,全身各系统受累为主要表现的临床综合征,也称为尿毒症。从原发病起病到肾功能不全的开始,间隔时间可为数年到十余年。慢性肾功能衰竭是肾功能不全的严重阶段。

慢性肾功能衰竭的病因以各种原发性及继发性肾小球肾炎占首位,其次为泌尿系统先天畸形(如肾发育不良,先天性多囊肾,膀胱输尿管反流等),遗传性疾病(如遗传性肾炎,肾髓质囊性病,Fanconi综合征等)全身性系统疾病中以肾小动脉硬化,高血压,结缔组织病等多见,近年来,CRF的原发病有所变化,肾间质小管损害引起的CRF也逐渐受到人们的重视,糖尿病肾病,自身免疫性与结缔组织疾病肾损害,引起的CRF也有上升趋势。
2. 大鼠5/6肾切除模型
2.1 实验材料:
① 设备:麻醉系统或试剂 ,保温毯;
② 动物 :SD大鼠 ,200-300g之间;
③ 手术器械:备皮刀片、棉签、手术刀、动脉夹、牵开拉钩 ,眼科手术剪 ,眼科手术镊子 ,5-0缝合线 ,弯三角缝针等。
2.2 操作:
① 大鼠用3%戊巴比妥腹腔注射麻醉后备皮、消毒,从左肋骨下缘、脊柱旁开1.5cm处皮肤做一纵向切口,长约1.5cm,逐层分离筋膜、腹内外斜肌筋膜、进入后腹膜腔,分离脂肪层,暴露左侧肾脏,钝分离脂肪囊,小心剥离肾包膜及肾上腺,注意避免损伤肾上腺,动脉夹夹闭左侧肾蒂,剪切掉左肾上、下极 2/3肾实质,3M组织胶水涂于创面止血,去掉动脉夹观察 30-50秒后无继续出血,小心将残肾还纳入腹腔,逐层缝合肌层、皮下及皮肤,局部消毒。
② 大鼠术后恢复7天开始第2次手术,采用同样的方法麻醉并固定动物。腹部正中开口,迅速切除左肾。明胶海绵快速吸干血液后滴几滴凝血酶溶液帮助止血,然后快速关腹。术后保暖。即制备成5/6肾切除大鼠模型。
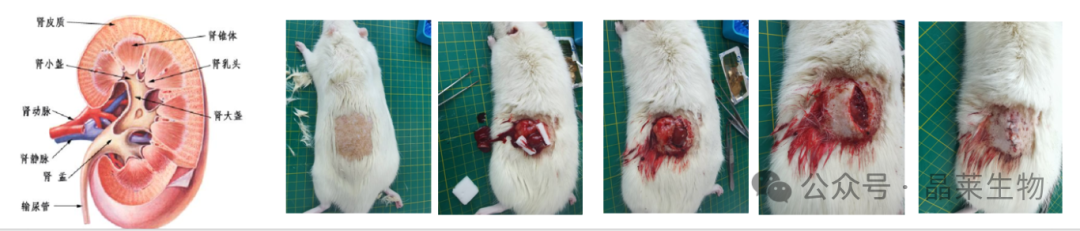
2.3 评价指标
① 蛋白定量及肾功能测定:血清肌酐、尿素氮及24h尿蛋白定量水平。
② 组织病理学改变:观察炎性细胞浸润 、 小管萎缩 、 肾小球硬化与间质纤维化等症状。
③ ELISA检测炎症指标:TNF-ɑ、IFN-γ、IL-1β、IL-6。
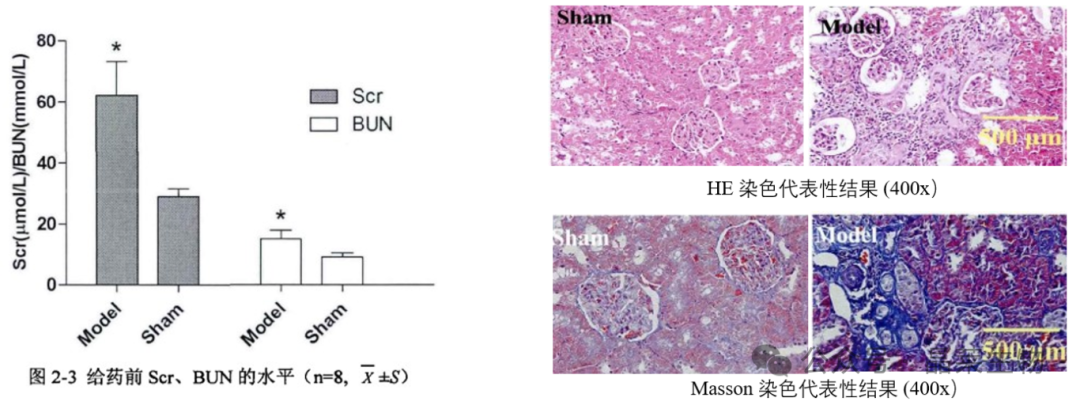
2.4 模型特点
① 保护残存肾组织相对正常的情况下造成残存肾组织超负荷工作模型,排除了各种原发肾脏疾病的致病因素对残存肾单位的影响,使影响因素简单化。
② 通过改变肾切除的量对发生肾衰的时间进行控制,满足不同实验的需要
① 大鼠经常出现自发性肾病、术前测量大鼠无蛋白尿很重要。
② 雄性大鼠可以避免生理周期带来的个体差异。
③ 麻醉和腹腔暴露手术会导致动物体温明显降低,保暖可以减少动物术后死亡率。
④ 切除右肾时速度要快,但注意不要损伤输尿管,更不要剪断输尿管。
⑤ 切除右肾的操作最好让同一位术者操作,保障残余肾单位体积基本一致。
⑥ 凝血酶溶液滴完后,需确认无较大出血再关腹,否则关腹后的大出血是没办法处理的。
① 模型制备周期较长,需要进行两期手术。
② 操作复杂,对操作技能要求高(一级实验员),且易引起出血和术后感染,甚至死亡。
① 可用于临床CRF治疗相关药物的研究:减轻肾组织灌注以及肾高滤过,抑制系膜细胞增殖,抗氧化作用,降压等方面。
② 新药物筛选:评估候选药物对慢性肾功能衰竭的潜在疗效,寻找治疗靶点和药物。
③ 基因调控研究:研究模型可帮助揭示特定基因对慢性肾功能衰竭的调控作用。
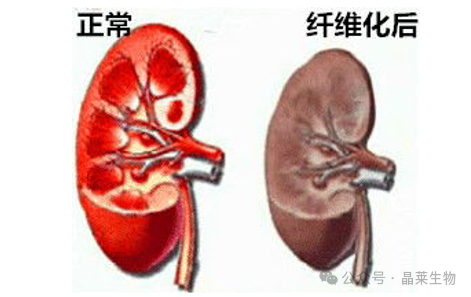
3. UUO肾纤维化模型
肾脏间质纤维化是CKD终末期的典型病理改变,纤维化程度越重,肾脏功能就越差。因此,很多肾病课题组都在积极探索减轻肾间质纤维化的药物。
其中肾间质纤维化最常见的模型为:UUO肾纤维化模型;
单侧输尿管梗阻模型是肾纤维化的机制研究,以及评估改善肾脏疾病的潜在治疗方法的常用模型之一。此模型会引起肾小管和间质细胞的增生和巨噬细胞/单核细胞在肾实质中的聚集与浸润,这些改变可以激活RAS系统,会导致肾小管间质纤维化和肾小管萎缩,最终可导致肾功能衰竭。
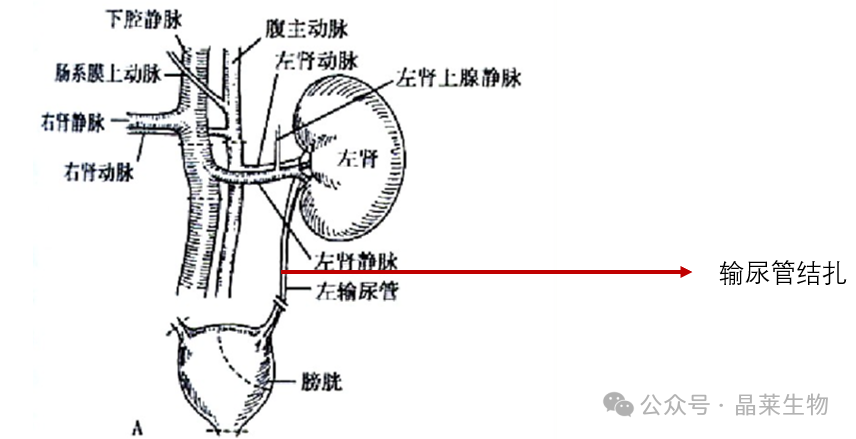
3.1 实验方法
① 设备:麻醉系统或试剂 ,保温毯;
② 动物 :SD大鼠 ,200-300g之间;
③ 手术器械:备皮刀片、棉签、手术刀、牵开拉钩 ,眼科手术剪 ,眼科手术镊子 ,5-0缝合线 ,弯三角缝针等。
④ 大鼠麻醉后仰卧位固定,在左侧腹部中间位置开腹;沿着肾门向下寻找输尿管(像一根白色细线)使用玻璃分针(可减额外损伤)游离左侧输尿管,在肾盂开口处和输尿管上1/3的位置分别做永久结扎,然后从两个结扎点中间剪断左侧输尿管。逐层缝合,关腹。

① 术后3-7天,主要病变是肾小管扩张、间质炎细胞浸润、肾小管上皮细胞空泡变,有一些肾小管上皮细胞会坏死脱落到管腔中,管型少见。
② 术后14天,主要病变是间质炎细胞浸润加重、近端肾小管结构丢失、远端肾小管扩张,可见管型,间质纤维化也出现了(纤维细胞和成纤维细胞同时存在)。
③ 术后21天,间质炎细胞浸润存在,但不是主要矛盾。主要特征是肾小管结构消失,肾间质纤维化加重。
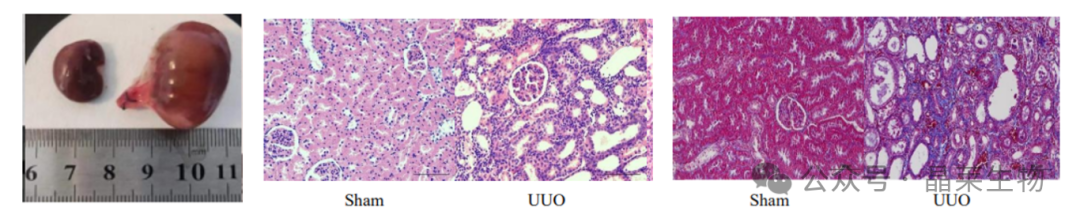
① 该模型肾纤维化特征明显,死亡率低,较适用于对肾间质纤维化的研究。
② 该模型模拟临床输尿管梗阻导致肾间质损伤,是研究较成熟的抱负肾间质纤维化模型。
③ 模型表现出肾小球的病理学变化,包括肾小球基底膜变厚、小球玻璃样转变。血生化:BUN升高1-1.5倍,Scr升高2倍左右。这些变化类似于人类肾纤维化的病理学特征。
3.4 注意事项
① 术后密切观察切口有无感染、出血、开裂;观察大鼠活动状态、饮食量和毛色颜色。
② 术后左侧季肋区可触及肿大明显,部分可见左侧变大凸起,必要时连续注射抗生素以防感染。
③ 肾纤维化的发病和病程会随时间而变化,研究不同阶段的肾病变要选择适合的实验时间点。
3.5 风险评估
① 该模型为进行性小管萎缩及间质纤维化,需要连续观察14天。并且在造模成功后仍需持续观察。
② 操作复杂,对操作技能要求高(一级实验员),且易引起出血和术后感染,甚至死亡。
③ 该模型无肾功能丧失,并且临床上类似UUO的病例非常罕见。
3.6 应用方向
① 疾病模拟:动物模型可以模拟人类的肾纤维化过程,帮助研究者深入理解肾纤维化的发病机制。
② 病理学研究:通过对动物模型进行病理学检查,研究者可以观察到肾纤维化的病理变化,如肾小球硬化、肾小管萎缩等。
③ 遗传学研究:动物模型还可以用于研究肾纤维化的遗传问题,探索基因与肾纤维化的关系。
以上部分数据与结果图来源于网络和文献,如有侵权请联系客服删除。
参考文献:
[1]武利军. 奈比洛尔改善UUO大鼠肾间质纤维化的机制研究[D].山西医科大学,2023.DOI:10.27288/d.cnki.gsxyu.2023.001320.
[2]莫立乾. 复方黄甘对5/6肾切除大鼠的肾脏保护作用及其机制研究[D].南方医科大学,2016.
[3]Di Tu Qiu,Jin Juan,Hu Xiao et al. Curcumin Improves the Renal Autophagy in Rat Experimental Membranous Nephropathy via Regulating the PI3K/AKT/mTOR and Nrf2/HO-1 Signaling Pathways.23[J] .Biomed Res Int, 2020, 2020: 7069052.
晶莱生物为研发者提供慢性肾功能衰竭模型、肾纤维化、肾炎、肾结石、急性肾功能衰竭等多种肾脏疾病动物模型构建实验服务,可直接用于相关肾脏疾病课题及医药开发研究。
关于晶莱
关注公众号,了解更多!