国自然热点“转录调控”研究之 RBFOX2调节胰腺癌中选择性剪接的转移特征
时间:2023-08-03 阅读:1704RBFOX2 modulates a metastatic signature of alternative splicing in pancreatic cancer
RBFOX2调节胰腺癌中选择性剪接的转移特征

期刊:Nature
发表时间:2023-03-22
影响因子:69.504
研究背景
胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma ,PDA)——疾病背景
PDA是一种具有局部侵袭性及转移性扩散的高致死性肿瘤,虽然已经有4个关键的致癌基因被发现了(KRAS、SMAD4、CDKN2A和TP53),但是它们都在PDA进展中保守,没有关于它们突变对PDA转移进展的报道。到目前为止,与PDA转移扩散相关的基因突变还没有被发现,且选择性剪接和剪接因子在PDA中发挥作用的报道很少。

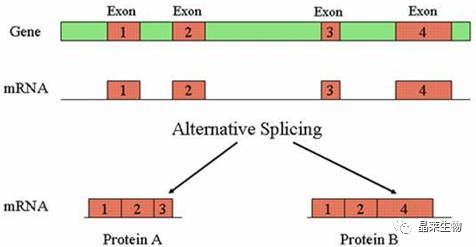
可变剪接(或选择性剪接, alternative splicing,AS)
有些基因的一个mRNA前体通过不同的剪接方式(选择不同的剪接位点)产生不同的mRNA剪接异构体,这一过程称为可变剪接。可变剪接是调节基因表达和产生蛋白质组多样性的重要机制。
技术路线
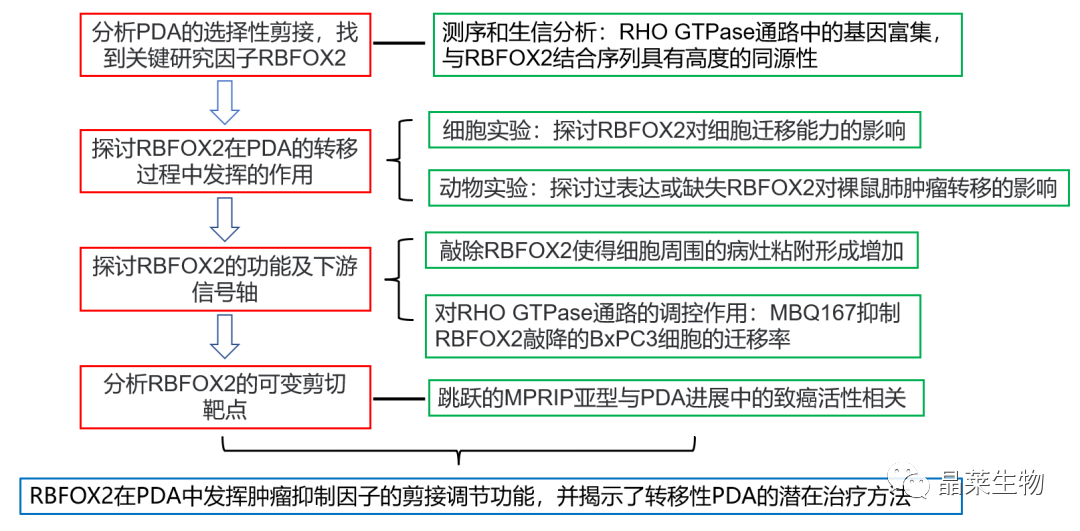
研究结果及分析
1. PDA(胰腺导管腺癌)的AS(可变剪接)事件整体情况
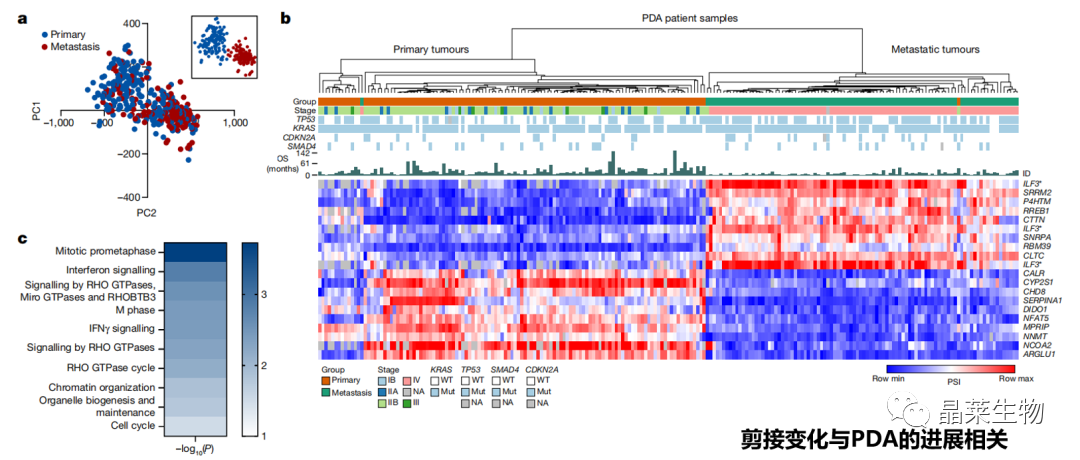
a. 对395个PDA患者的RNA测序数据进行AS事件的分析,发现了两个集群:61%的原发性胰腺肿瘤属于cluster 1,71%的转移性肿瘤属于cluster 2;
b. 在原发组和转移组之间鉴定了约8000个显著差异的剪接事件,前20个剪接事件足以将PDA患者样本分为与临床分期高度相关的两组;
c. 参与细胞骨架组装和迁移的RHO GTPase通路基因富集。
1.2 RBFOX2基序的富集
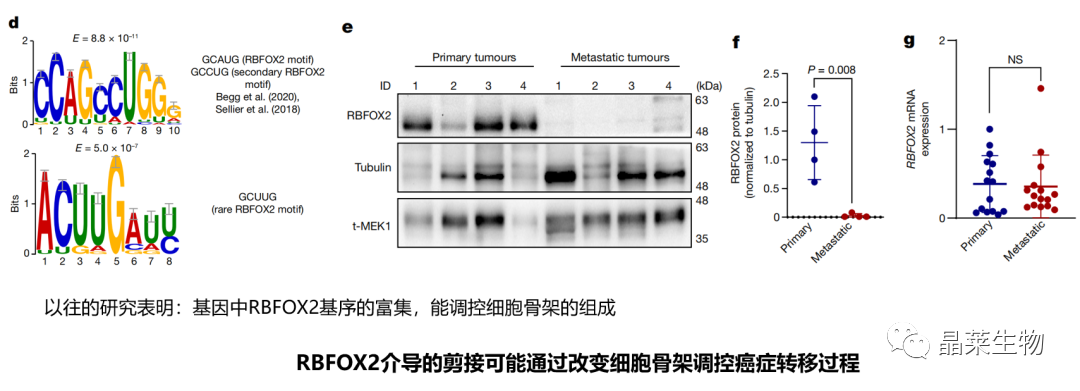
d. 对RHO通路基因的差异剪接事件进行从头基序分析:5 '剪接位点上游最丰富的基序与RBFOX2结合序列具有高度同源性;
e-g. PDX衍生的转移性患者样本中,剪接因子RBFOX2的蛋白水平低于原发肿瘤样本,而mRNA水平没有明显差异。
(PDA患者衍生的异种移植瘤裸鼠模型)
2. RBFOX2在胰腺癌进展中作为转移性肿瘤抑制因子
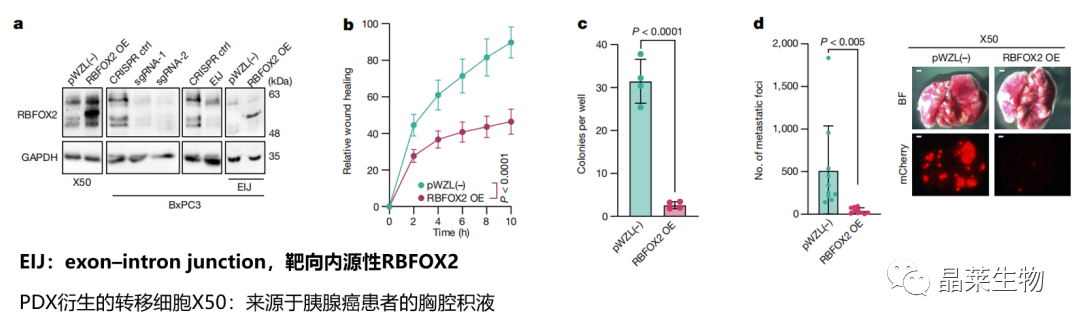
a. 蛋白免疫印迹检测过表达和敲除RBFOX2;
b. X50细胞伤口愈合实验;
c. X50细胞克隆形成实验;
d. 用RBFOX2 cDNA mCherry标记的X50 PDX细胞静脉注射到裸鼠体内,肺转移瘤显著减少。
RBFOX2的过表达抑制PDA细胞的转移潜力。

e. BxPC3原代PDA细胞伤口愈合实验
f. BxPC3克隆形成实验
g. 将GFP标记的RBFOX2敲除的BxPC3原代PDA细胞静脉注射到NOD-SCID小鼠体内
h. 用 EIJ sgRNA处理的BxPC3细胞具有与RBFOX2基因敲除细胞类似的表型
i. 将RBFOX2的cDNA引入EIJ细胞可挽救其表型
RBFOX2缺失会导致肺转移能力增强:设计一种针对RBFOX2中外显子-内含子交界处的sgRNA(RBFOX2 EIJ sgRNA),从而只沉默内源性的RBFOX2。
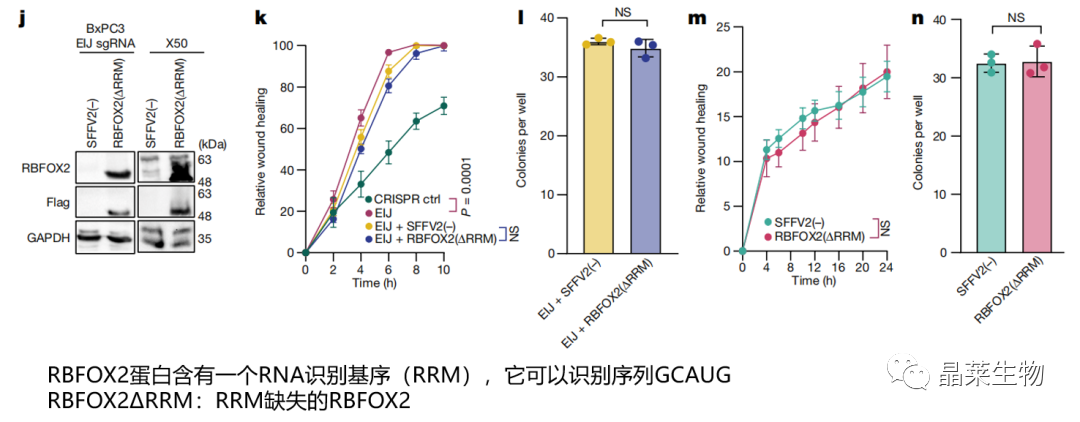
j. 在RBFOX2 EIJ sgRNA的BxPC3原代PDA细胞和X50转移性PDA细胞中过表达RBFOX2ΔRRM,无法挽救表型;
k-l. BxPC3伤口愈合、克隆形成实验;
m-n. X50伤口愈合、克隆形成实验。
RBFOX2的RRM对其在PDA进展中的肿瘤抑制活性是必不可少的。
3.1 RBFOX2介导局灶黏附
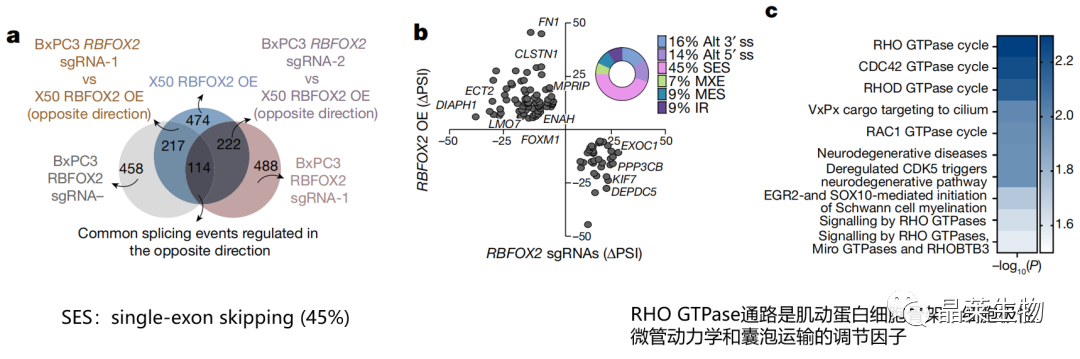
a-b. RNA测序及生信分析:114个RBFOX2依赖的交替剪接事件,这些事件相互调节
c. 87个RBFOX2调控的基因在RHO GTPase (RHOA、CDC42和RAC1)通路上的富集
为确定调节PDA细胞转移过程中,RBFOX2的剪接目标
MXE:mutually exclusive exons (外显子互斥7%)
互斥可变剪接:基因组上串联排列着2个或2个以上相邻可变外显子,有且只有一个可变外显子经过剪接进入到同一个成熟mRNA分子中。互斥外显子的长度相同或者相差3的整倍数
IR:intron retention内含子保留,进一步支持了RBFOX2在PDA中作为转移性肿瘤抑制因子的生物学作用
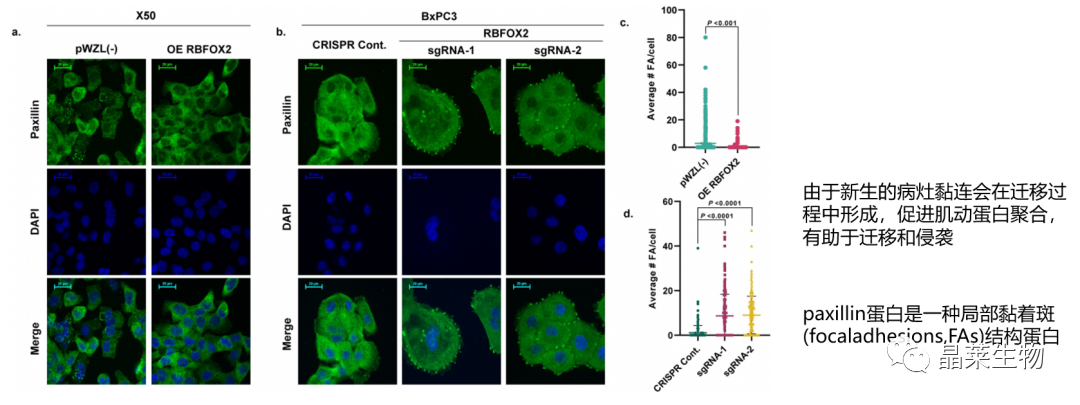
RHO通路调控肌动蛋白细胞骨架的组装,而粘着斑的形成需要细胞骨架的重排,在细胞迁移过程中需要形成新的粘着斑(一种将细胞与细胞外机制进行连接的亚细胞结构),增强粘着斑形成会促进肿瘤转移。
3.2 RHO GTPase途径的抑制作用
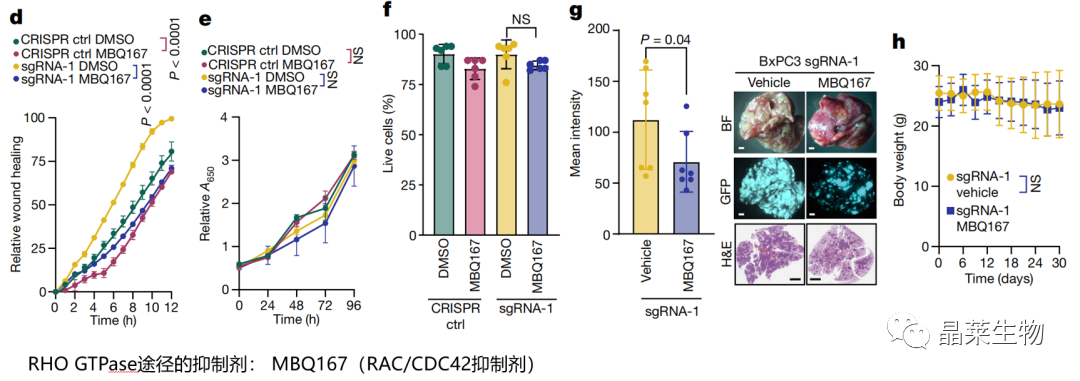
d-f. 对RBFOX2缺失的BxPC3细胞进行MBQ167干预可抑制其迁移率,但体外的存活率或增殖率没有变化;
g-h. 对静脉注射GFP标记的RBFOX2耗尽的BxPC3细胞的小鼠体内给予MBQ167,可抑制肺部转移。
抑制RHO通路可以抑制肿瘤细胞转移。
4. MPRIP剪接调节胰腺肿瘤细胞的转移潜能
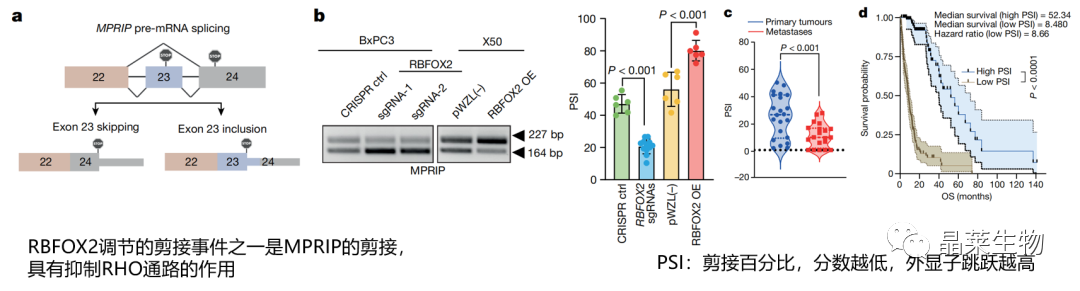
a-b. 敲除RBFOX2会导致MPRIP第23个外显子被跳过(外显子跳跃),而过表达RBFOX2会导致该外显子不被跳过(外显子包含);
c. 与原发肿瘤相比,转移性PDA样本中MPRIP 23号外显子跳跃异构体的数量较高(PSI较低);
d. MPRIP低组的患者生存结果更差。
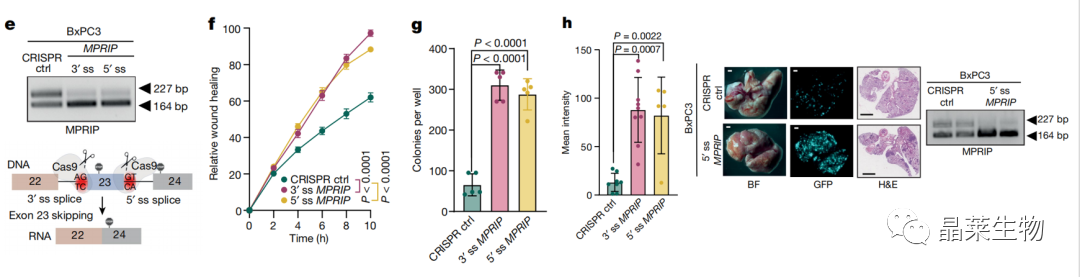
e. 诱导23号外显子跳跃异构体:设计了针对第23外显子的3′或5′剪接位点的sgRNAs,都能有效触发23号外显子跳转
f-g. 表达sgRNAs的BxPC3原代肿瘤细胞在软琼脂中表现出更强的迁移、克隆形成能力
h. 将GFP标记的BxPC3原发肿瘤细胞(3′或5′剪接位点sgRNAs)静脉注射到NOD-SCID小鼠体内,与对照细胞相比,肺转移灶的数量明显增加
接下来测试MPRIP剪接的调控是否会影响PDA肿瘤细胞系的转移潜力,将GFP标记的BxPC3原发肿瘤细胞用3′或5′剪接位点sgRNAs静脉注射到NOD-SCID小鼠体内,与对照细胞相比,肺转移灶的数量明显增加。
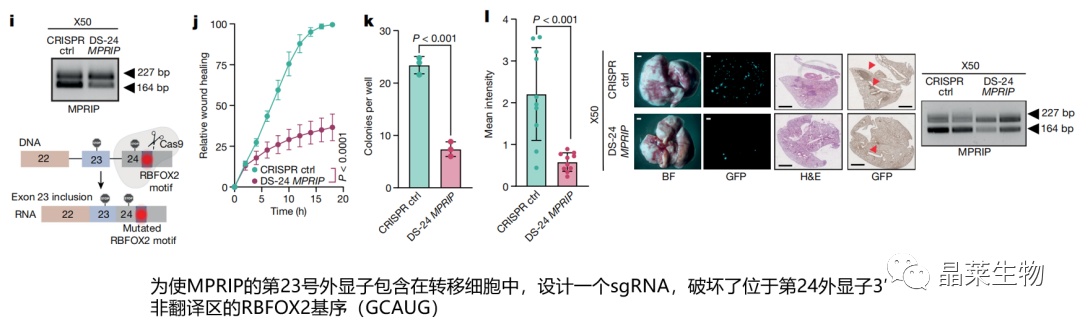
i. 设计sgRNA导致23号外显子的包含
j-k. 携带靶向RBFOX2基序的sgRNA(DS-24 MPRIP sgRNA)的X50转移细胞迁移能力、克隆形成能力明显降低
l. MPRIP外显子23保留异构体的转移的X50细胞,抑制了肺转移潜力
RBFOX2调控的PDA进展与MPRIP 23号外显子跳跃异构体有关。
文献结论
本研究发现:
差异剪接事件与PDA进展程度相关,并鉴定到剪接因子RBFOX2参与其中,过表达RBFOX2可以降低癌细胞转移能力,而敲除RBFOX2可以增强癌细胞转移能力,说明RBFOX2是一个PDA的转移抑制因子,并发现RBFOX2的靶基因参与RHO GTPase通路,调控细胞骨架组装和粘着斑形成,且RBFOX2的靶基因MPRIP与PDA转移相关。
通路机制:
RBFOX2通过可变剪切调控下游基因MPRIP的表达,靶向RHO GTPase通路,从而影响胰腺癌的转移。
文献总结
创新点:
1. 利用已发表的数据进行分析
作者对已发表的395个PDA患者样本的RNA测序数据库进行分析,根据可变剪接谱而不是基因表达谱对样本进行分类,说明剪接变化与PDA的进展相关。
2. 为临床治疗转移性胰腺癌提供了新思路
发现了RNA剪接与PDA转移之间的关系,揭示了RBFOX2作为PDA肿瘤抑制因子的功能和机制,为未来治疗转移性PDA提供新的思路和理论基础。
文献涉及实验技术

关注公众号,了解更多!














