国自然热点“外泌体”之活化的Drp1调节p62介导的自噬通量,并通过ROS-RIP1/RIP3-外泌体轴加重脑缺血再灌注中的炎症
时间:2023-05-15 阅读:2021Activated Drp1 regulates p62-mediated autophagic fux and aggravates infammation in cerebral ischemia-reperfusion via the ROS-RIP1/RIP3-exosome axis
活化的Drp1调节p62介导的自噬通量,并通过ROS-RIP1/RIP3-外泌体轴加重脑缺血再灌注中的炎症

期刊:Military Medical Research
发表时间:2022
影响因子:34.915
研究背景
脑缺血再灌注损伤(CIRI)是指当缺血脑组织的血供恢复时可发生的继发性脑损伤。
CIRI是一个复杂的病理生理过程,涉及能量紊乱,细胞酸中毒,兴奋性氨基酸的释放增加,细胞内钙稳态的损失,自由基生成,凋亡基因的激活,相互因果和相互交织,形成一个恶性循环,最终导致细胞凋亡或坏死。目前,触发CIRI恶性循环的机制仍在探索中。
线粒体功能障碍与CIRI密切相关,是脑缺血后神经细胞死亡的关键靶区。线粒体裂变相关蛋白Drp1和自噬相关蛋白p62的表达和活性的变化在缺血-缺氧诱导的氧化应激损伤中起着重要作用。
CIRI损伤是否改变了线粒体质量失衡的两个关键过程,即Drp1-medi化的线粒体裂变和p62介导的自噬通量,这两个过程之间是否存在内部核心关系,以及Drp1和p62如何参与调节CIRI的恶性循环尚不清楚。迄今为止,没有任何相关报告试图回答这些问题。
研究思路
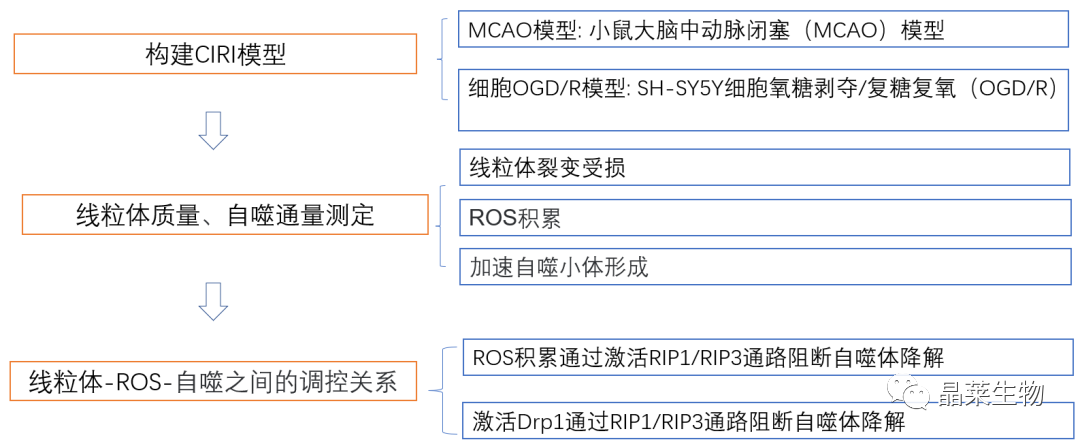
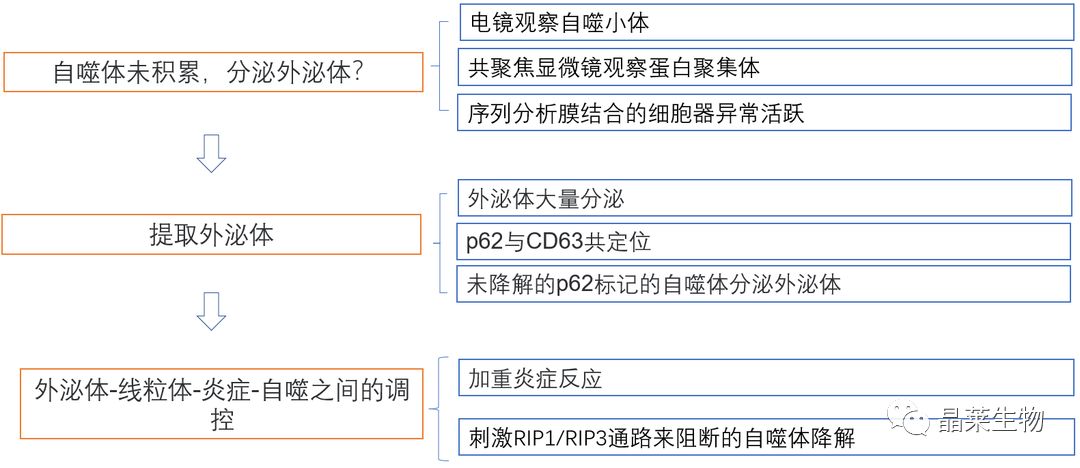
研究结果及分析
1.1 CIRI后,激活Drp1诱导线粒体过度裂变
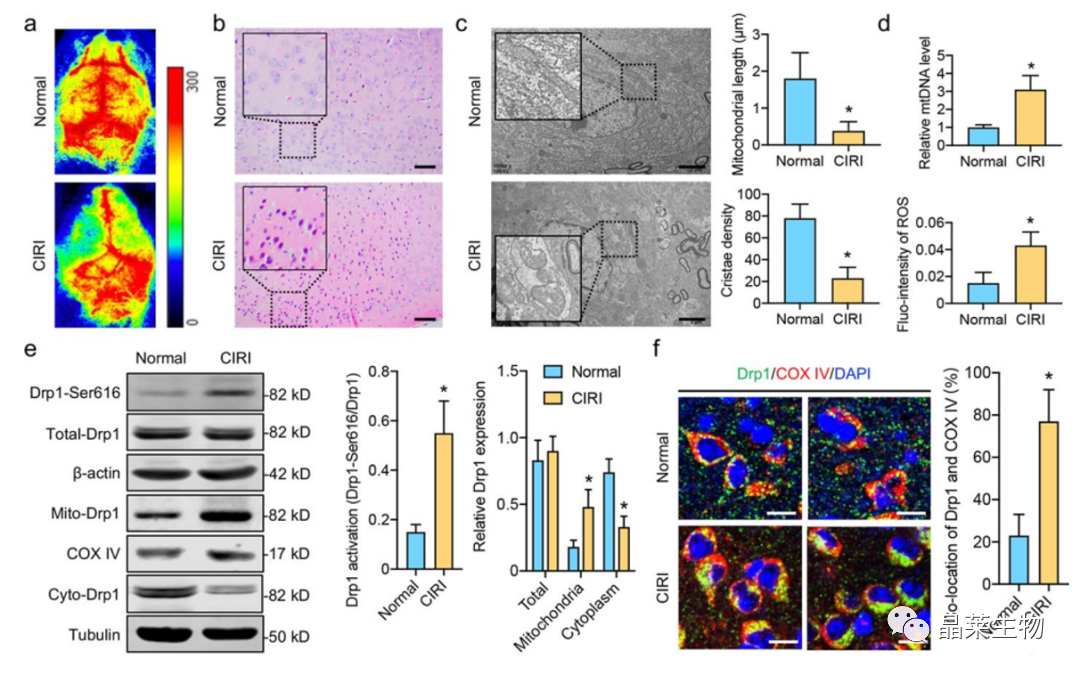
a.脑血流散斑断层扫描。
b 大脑皮层的HE染。
c透射电镜图像显示CIRI后大脑皮层线粒体。各组线粒体长度和嵴密度的定量数据
f.免疫荧光
1.2 ODG/R后,激活Drp1诱导线粒体过度裂变和ROS积累
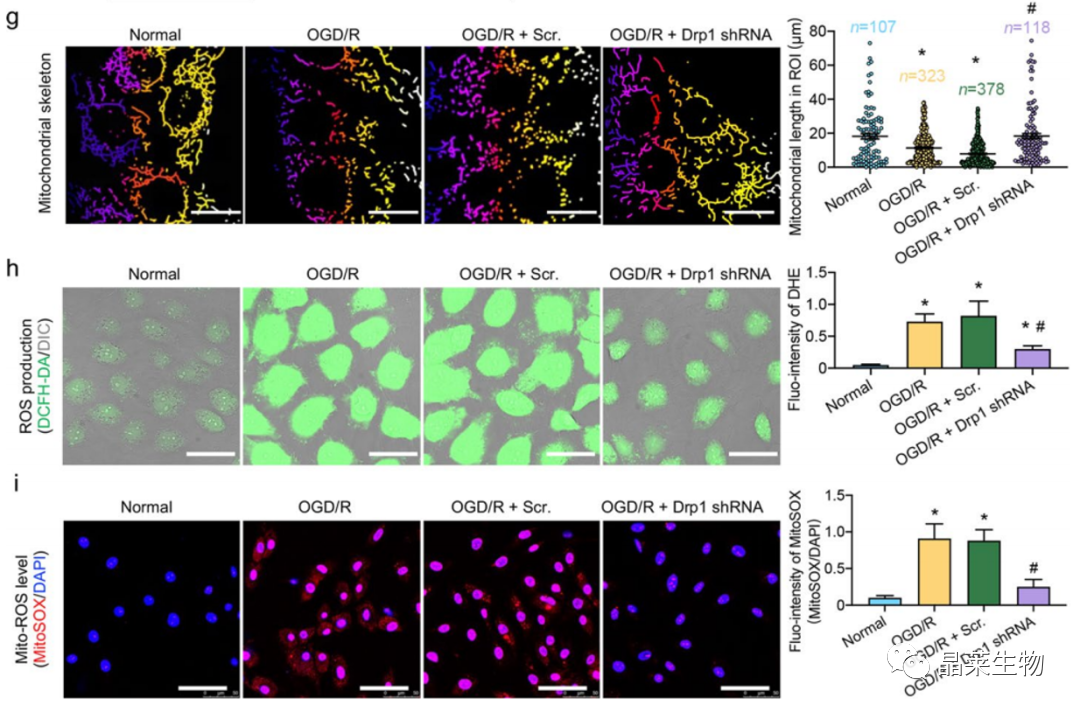
g.共聚焦:线粒体形态
h.细胞ROS
i.线粒体ROS
CIRI和ODG/R后活化的Drp1诱导的线粒体裂变和ROS积累过多。
2.1 CIRI后,Drp1影响p62介导的自噬小体形成
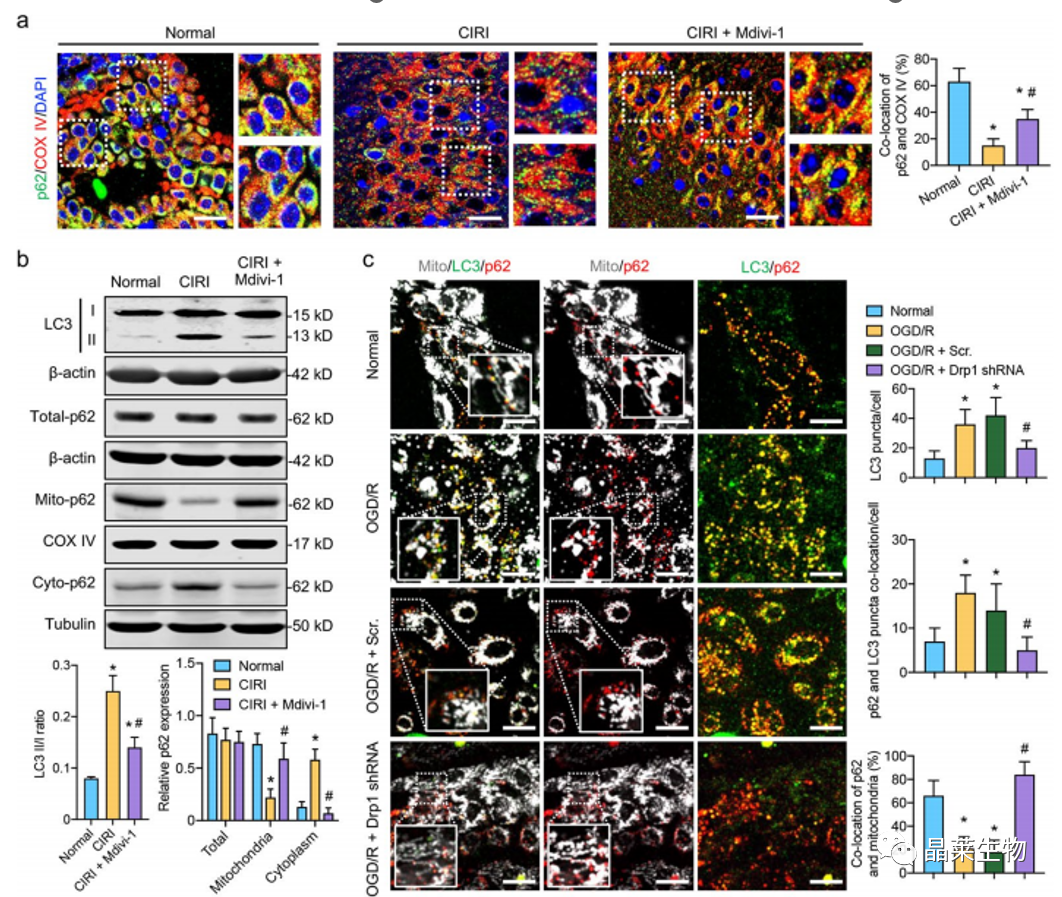
a. 免疫荧光图像显示CIRI和Mdivi-62治疗后p1和线粒体在大脑皮层中的共位。
b. LC3 II/I和CIRI和Mdivi-62处理后p1在总、细胞质和线粒体部分的蛋白表达。
c. 共聚焦图像显示 Drp3 shRNA 后 LC62、p5 和线粒体在 OGD/R 处理的 SH-SY1Y 细胞中的共位。
这些结果表明,CIRI诱导的Drp1激活可能增强线粒体中p62的释放,并加速CIRI后自噬体的形成。
2.2 ODG/R后,Drp1影响p62介导的自噬小体形成
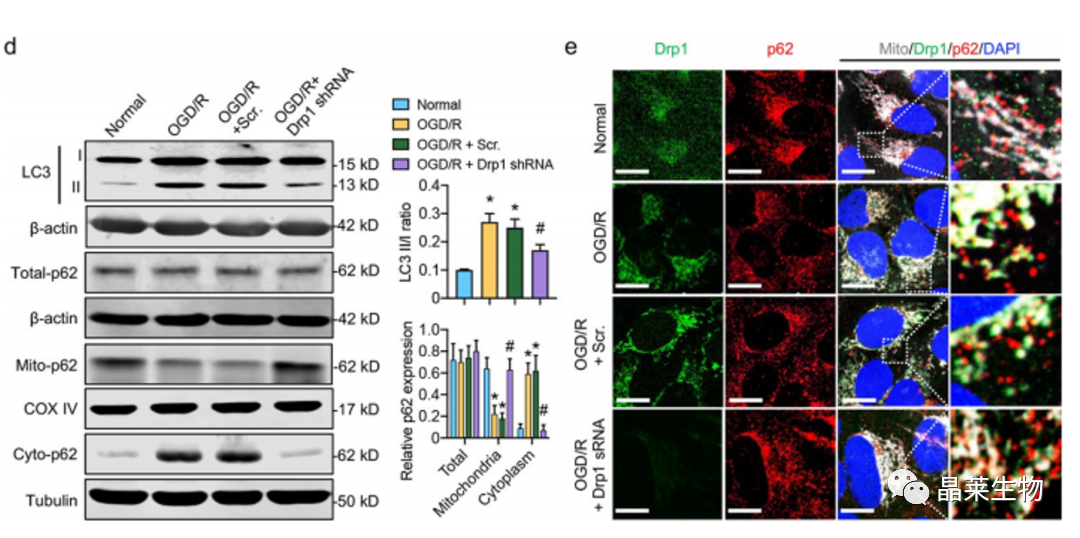
d. LC3 II/I 和 p62 在 Drp5 shRNA 后 OGD/R 处理的 SH-SY1Y 细胞中总、细胞质和线粒体部分的蛋白表达。
e. 共聚焦图像
这些观察表明,活化的Drp1可能促进线粒体p62在OGD/R后释放到细胞质中,而不影响p62的表达。总体而言,上述体内和体外结果证实,活化的Drp1的线粒体易位可能加速CIRI后p62介导的自噬体形成。

3.1 OGD/R后,ROS积累通过激活RIP1/RIP3通路阻断自噬体降解
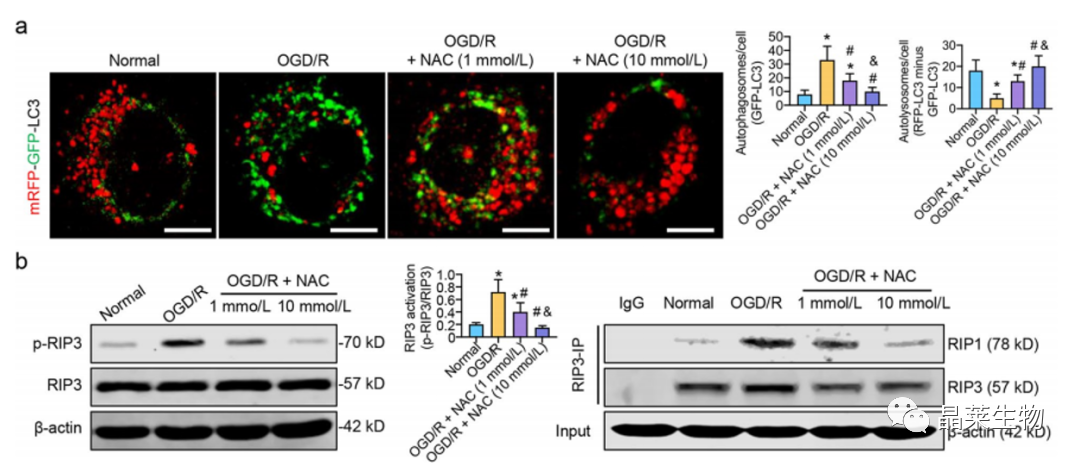
a. 表明p62介导的自噬通量可能与DRP1诱导的ROS积累有关。
b. 结果表明,OGD/R诱导的ROS积累可能通过激活RIP1/RIP3途径阻断自噬通量。
3.2 激活Drp1通过RIP1/RIP3通路阻断自噬体降解
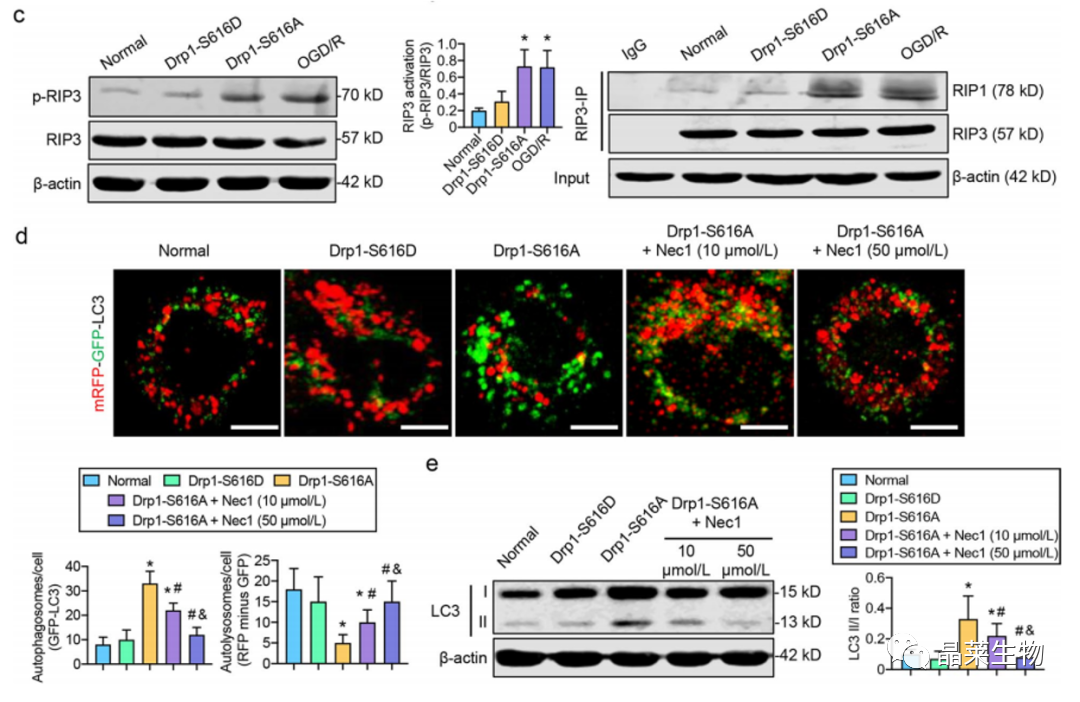
c. 蛋白质印迹分析。
d. 免疫荧光
e. 蛋白质印迹分析
这些结果证实,活化的Drp1诱导的ROS积累可能通过RIP1 / RIP3途径阻断自噬通量。

4.1 在CIRI和OGD/R后,电镜下没有观察到自噬体的大量积累,没有形成大量聚集体
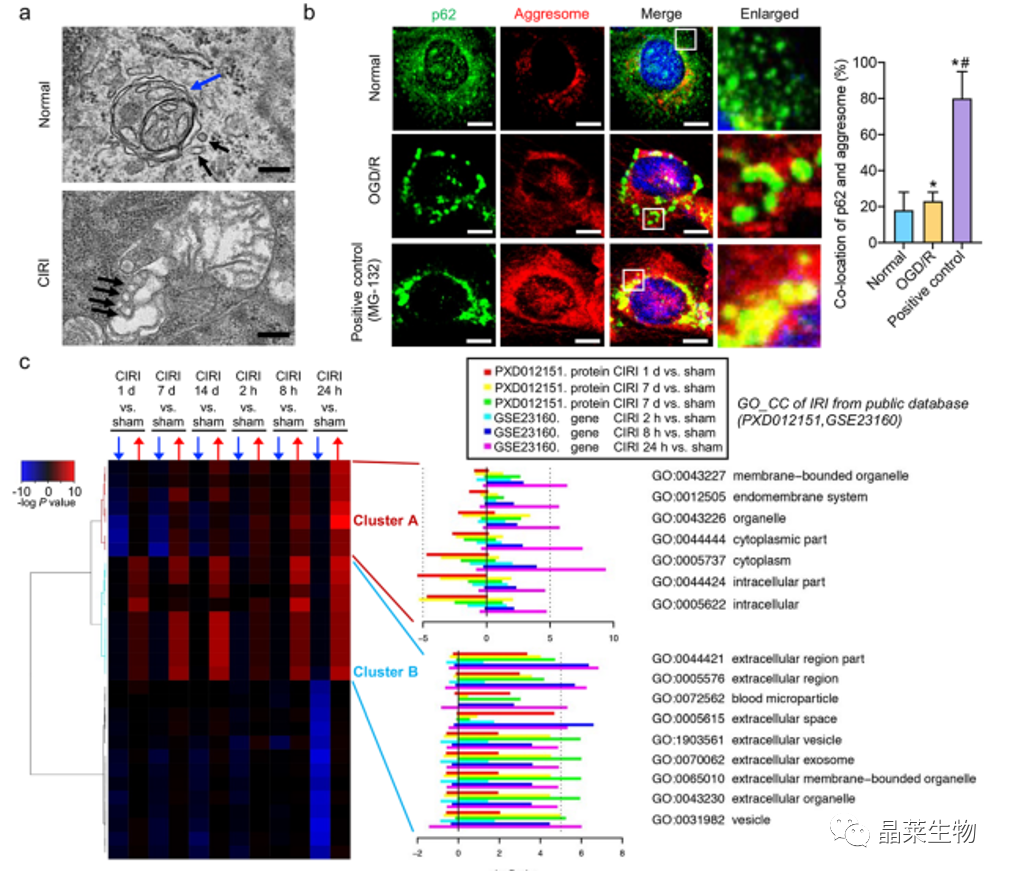
a. 透射电镜图像显示CIRI后的膜性结构。
蓝色箭头:含有线粒体片段的自噬小体。
黑色箭头:疑似外泌体的膜性结构。
b. 共聚焦,蛋白凝聚物
由活化的Drp62诱导的未降解的p1标记的自噬体在CIRI和OGD / R之后通过外泌体分泌。
4.2 在CIRI和OGD/R后,激活Drp1诱导分泌外泌体
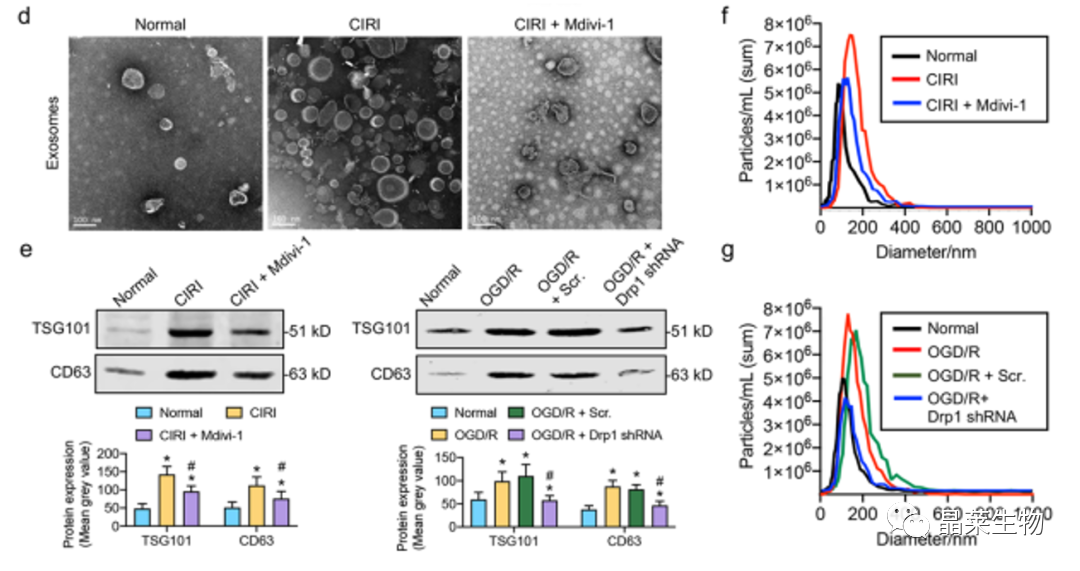
这些结果表明,活化的Drp1增加了CIRI和OGD/R后外泌体中的含量。
综上所述,推测自噬通量被Drp62-ROS-RIP1/RIP1轴阻断后p3标记的自噬体缺乏大量积累可能是由于CIRI后含有大量未降解自噬体的外泌体分泌增加。
5.1 CIRI后,大量未降解的p62标记的自噬体以外泌体的形式被释放,含有p62标记的自噬体的外泌体加重了炎症反应
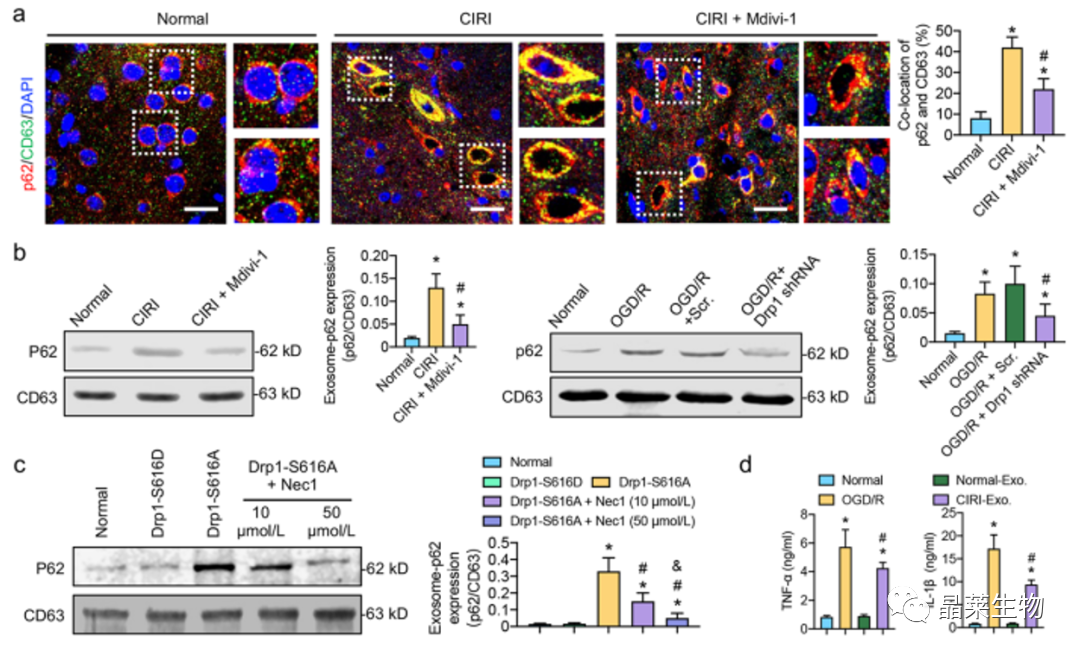
a.b.c. 结果证实了CIRI后大量未降解的p62标记的自噬体以外泌体的形式释放。
d. 结果表明,CIRI衍生的外泌体,而不是正常来源的外泌体,可以显着增加正常SH-SY1Y细胞中的TNF-α和IL-5β水平,表明含有未降解自噬体的外泌体可能在CIRI后加重炎症。
5.2 CIRI后,含有p62标记的自噬体的外泌体,进一步刺激RIP1/RIP3通路来阻断的自噬体降解
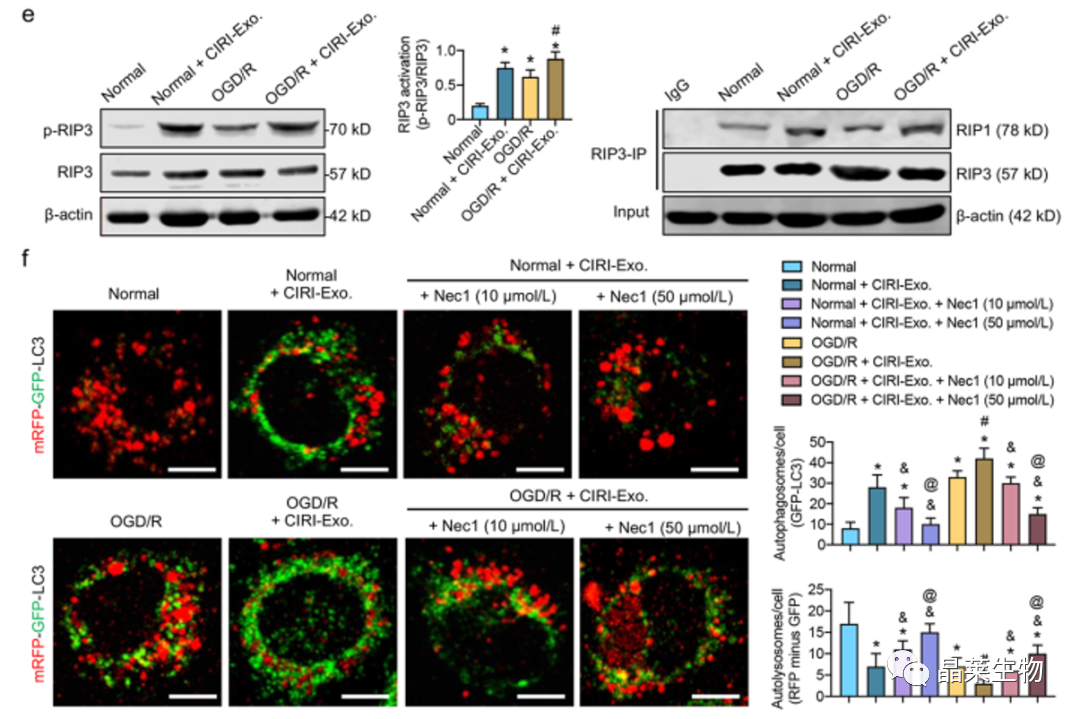
e. 用CIRI衍生的外泌体刺激正常和OGD / R处理的SH-SY5Y细胞可以在一定程度上进一步激活RIP1 / RIP3途径。
f. CIRI介导的外泌体对自噬体降解的阻断作用也可能被RIP1 / RIP1抑制剂Nec3以剂量依赖性方式抑制。
这些结果表明,CIRI后外泌体刺激的炎症因子可能通过RIP1/RIP3途径进一步阻断自噬体降解,引发病理生理恶性循环。
文献结论
CIRI激活Drp1,加速p62介导的自噬小体的形成,同时通过RIP1/RIP3通路的激活,抑制自噬小体向自噬溶酶体的转变。
未降解的自噬小体以外泌体的形式分泌在细胞外,导致炎症级联反应,进一步损伤线粒体,导致ROS产生过多,自噬小体降解受阻,引发恶性循环。
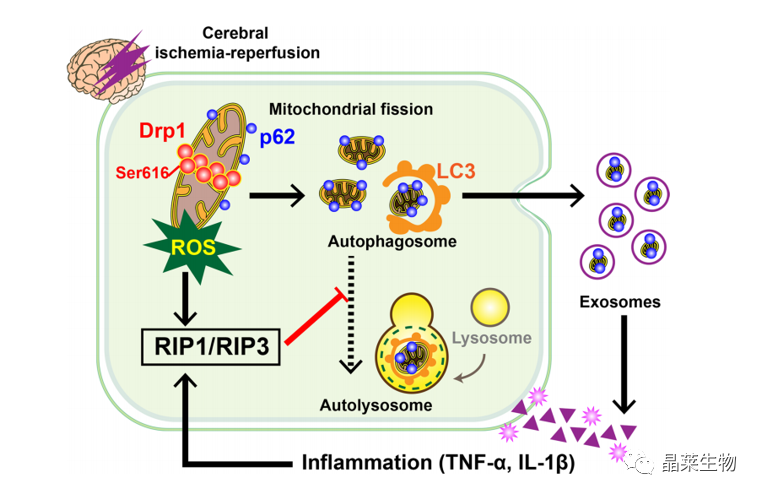
文献总结
创新点:
阐明了CIRI后,激活Drp1通过RIP1/RIP3通路加速自噬小体的形成,并阻断自噬体降解。并发现自噬体降解受阻后,能以外泌体的形式分泌,导致炎症级联反应,形成恶性循环。系统地剖析了CIRI后的病理生理恶性循环。
提示,通过调节RIP1/RIP3通路来加速p62自噬体转化和清除受损的线粒体,以及维持线粒体质量平衡和重建线粒体ROS积累,可能是改善CIRI病理生理的有效措施。
局限性:
1.使用OGD/r处理的SH-SY5Y细胞模型;是否也适用于其他脑组织细胞系,如BV2和CIRI临床样本,还需要进一步验证。
2.除了经典的p62介导的线粒体自噬途径外,其他lc3结合受体,如BNIP3、FUNDC1和FKBP8,是否也可能参与CIRI后drp1调控的自噬流,值得进一步研究。
3.由于目前外泌体检测方法的局限性,没有高时间和空间分辨率特异性成像,目前我们只能使用外泌体标记蛋白结合光学成像技术进行定位分析。在未来,需要在单细胞和单外泌体水平上进行更准确的动态研究。
4.在实际情况下,脑缺血-再灌注通常发生在被凝块阻断的脑血血流中,并被组织型纤溶酶原激活物(t-PA)恢复。血凝块或t-PA如何影响本研究的结论需要在临床试验中进一步研究。
文献涉及的实验技术

关注公众号,了解更多!














