国自然热点 “细胞焦亡” 研究之高p62表达抑制NLRP1炎症小体并增加皮肤鳞状细胞的抗应激性
时间:2023-04-10 阅读:2082High p62 expression suppresses the NLRP1 inflammasome andincreases stress resistance in cutaneous SC
高p62表达抑制NLRP1炎症小体并增加皮肤鳞状细胞的抗应激性

Journal :cell death & disease
IF:9.696
研究背景
•皮肤是抵御外部第一道防线,它的最外层是表皮,一个不断更新的分层上皮,几乎完全由角质形成细胞组成。角质形成细胞衍生的癌症是全球最普遍的癌症类型,包括基底细胞癌和鳞状细胞癌(BCC和SCC)。慢性皮肤炎症,尤其是暴露于完全被表皮吸收的UVB辐射,是发生鳞状细胞癌的主要危险因素。
•UVB辐射是一种完全的致癌物质,能够诱发和促进皮肤癌。UVB在人角质形成细胞中NLRP1磷酸化时激活NLRP1(炎症小体),这被认为是晒伤发生的原因。炎性小体由一组蛋白质复合物组成,这些复合物在传感器蛋白检测到某些应激因子时组装,例如NLRP1、NLRP3或AIM2,在衔接蛋白ASC(含有半胱天冬酶活化结构域的细胞凋亡相关斑点样蛋白)寡聚化后,蛋白酶半胱天冬酶-1(Caspase-1)被激活。反过来,半胱天冬酶-1切割并激活促炎细胞因子proIL-1β和-18,其释放诱导炎症反应。此外,半胱天冬酶-1激活加GSDMD,导致其在细胞膜中寡聚化和孔形成。此外,GSDMD诱导的孔形成可导致裂解性和促炎型细胞死亡,称为焦亡。炎症小体是免疫所必需的,但炎症小体在癌症发展中的作用尚不完全清楚。
•p62蛋白在自噬中具有重要意义,可拮抗炎症小体途径。此外,诱导NLRP3激活的受损线粒体被p62靶向线粒体降解,p62本身也被自噬降解,因此,其蛋白质水平可能与自噬通量成反比。由于其多结构域结构,p62也可调节其他促炎和抗炎途径,包括细胞保护性转录因子Nrf2、促炎转录因子NF-κB以及通过mTORC1复合物控制细胞增殖和分化的激酶mTOR。相关数据表明,p62表达在不同类型的癌细胞中上调,人皮肤鳞状细胞癌中,由于自噬增加,p62在癌症相关成纤维细胞中的表达受到抑制。相比之下,与健康皮肤相比,鳞状细胞可能表达较高的p62水平,但也有证据表明p62在肿瘤进展时受到抑制。
研究思路
1. p62在鳞状细胞和鳞状细胞癌中表达增加 。
2. 敲低p62促进了鳞状细胞中UVB诱导的NLRP1炎症小体活化 。
3. p62是角质形成细胞(HPK)中NLRP1炎症小体的负调节因子
4. SCC 细胞中自噬、mTORC1 和 Nrf2 没有显著失调
5. NF-κB 诱导 SCC 细胞系中的 p62 表达
6. p62增加和NLRP1 / ASC使SCC12细胞对抗肿瘤药物敏感
研究结果及分析
1.p62在鳞状细胞和鳞状细胞癌中表达增加
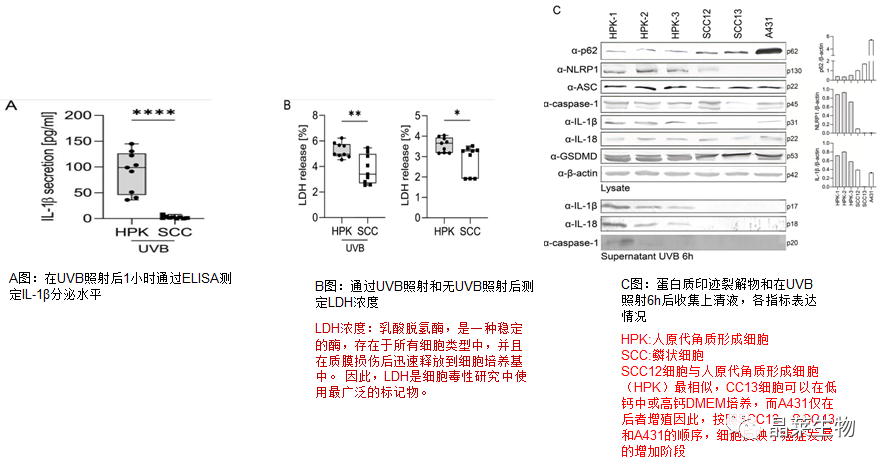
上图所示:SCC细胞系中没有激活NLRP1,失败原因可能是由mRNA中NLRP1和ASC的表达降低引起的。
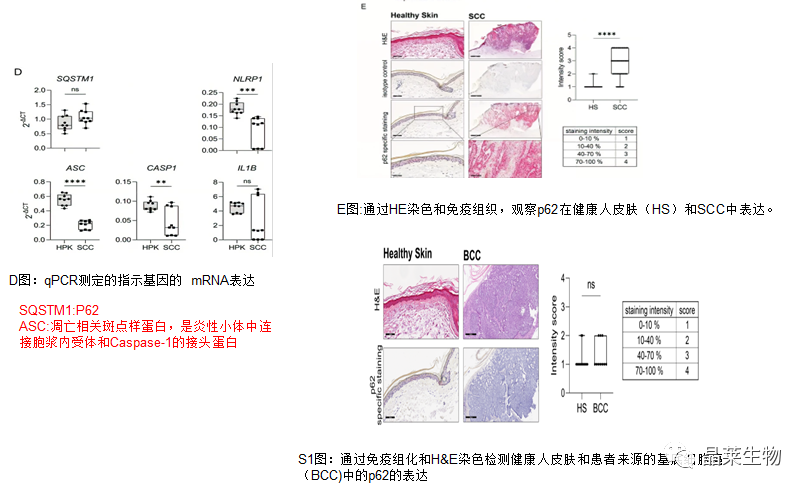
通过这些实验,我们发现鳞状细胞系(与HPK相比)以及鳞状细胞癌肿瘤(与正常皮肤和BCC相比)中p62表达增加。
2.敲低p62促进了鳞状细胞中UVB诱导的NLRP1炎症小体活化
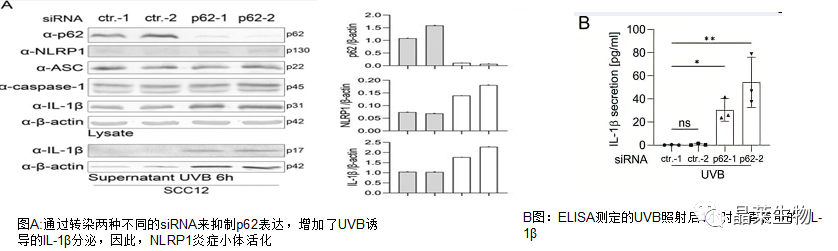

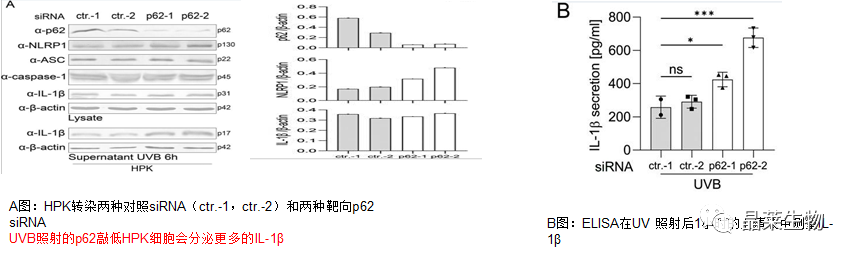
3.p62是角质形成细胞(HPK)中NLRP1炎症小体的负调节因子
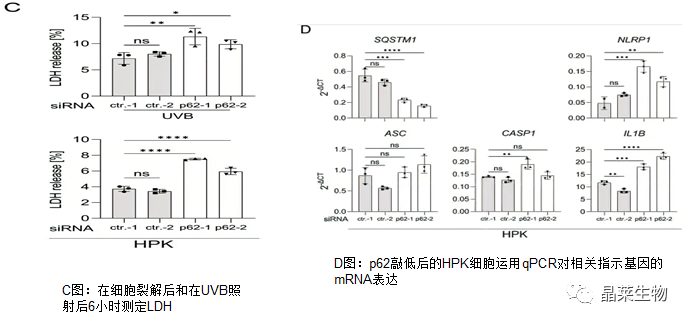
4.SCC 细胞中自噬、mTORC1 和 Nrf2 没有显著失调
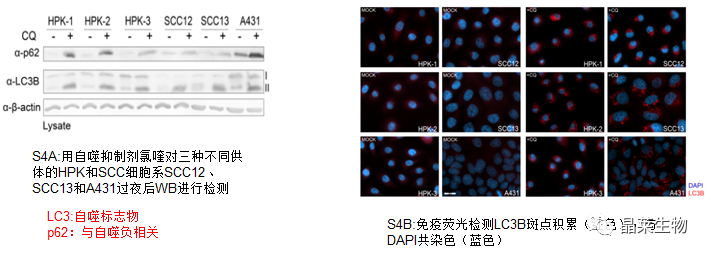
氯喹诱导HPK和SCC细胞系中p62和LC3B的表达增加相似,表明所有细胞类型的自噬通量率相当。


为了分析Nrf2途径是否是SCC细胞中p62的主要下游靶标,对SCC12细胞p62进行敲除。
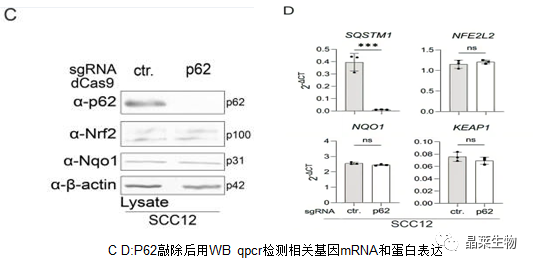
SCC细胞中p62敲除不影响Nrf2的表达和活性。

这些实验表明,在HPK和SCC细胞自噬中,mTORC1和Nrf2不是p62的主要下游或上游途径。此外,SCC细胞系中p62表达的上调不是这些细胞中自噬减少的结果。
5.NF-κB 诱导 SCC 细胞系中的 p62 表达
研究表明NF-κB以上游和下游方式与p62连接。一方面,p62/SQSTM1基因的转录受NF-κB调控,另一方面,p62是NF-κB的激活因子
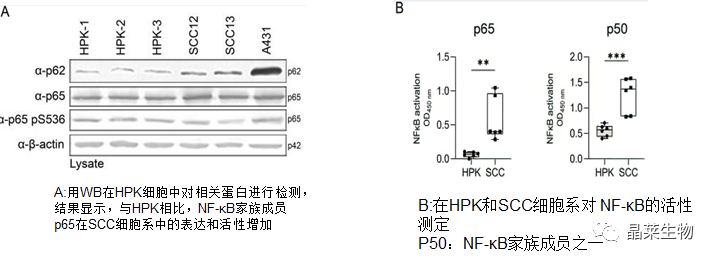
A B结果显示与HPK相比,鳞状细胞中p65和p50的活性增加
为了探究p62水平与NF-κB的关系,在SCC12细胞中敲降P62
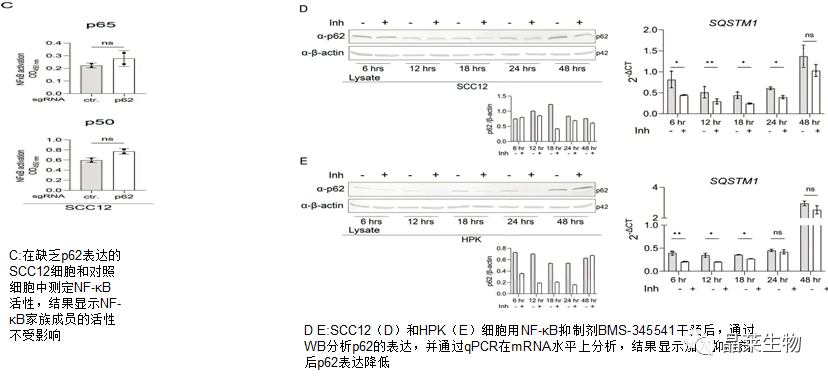
实验结果显示在SCC12细胞和HPK中,p62蛋白和mRNA表达在抑制NF-κB时降低,证明SCC细胞系中p62水平的增加至少部分是由这些细胞中NF-κB活性增强诱导的。
6.p62增加和NLRP1 / ASC使SCC12细胞对抗肿瘤药物敏感
接下来,我们想知道SCC细胞是否可以从高水平的p62中受益

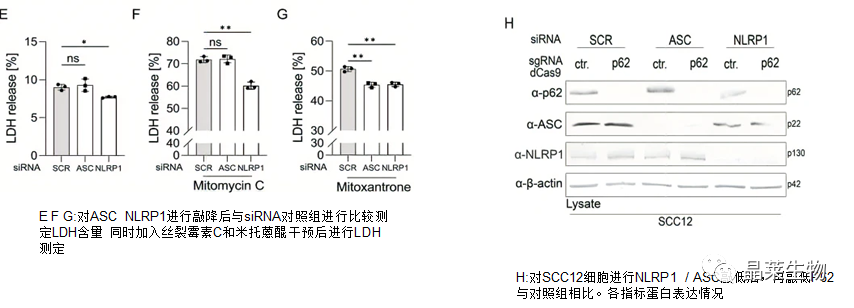
结果显示,与对照组和ASC敲低组相比,NLRP1敲低的细胞LDH释放水平较低.此外,NLRP1敲低显着保护了丝裂霉素C处理的SCC12细胞,而NLRP1和ASC敲低都减少了米托蒽醌处理后的LDH释放。
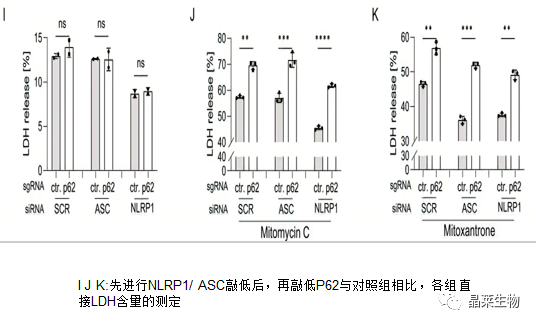
实验表明,无论 ASC 或 NLRP1表达如何敲低,p62 敲除都以类似的方式增加丝裂霉素 C 和米托蒽醌处理的 SCC细胞的细胞死亡(J K ASC和NLRP1 p62与ctrl对比),表明 p62 的细胞保护独立于 NLRP1 途径发生。此外,NLRP1敲低减少了对照和p62敲除细胞中由丝裂霉素C或米托蒽醌处理诱导的细胞死亡(J K图NLRP1 ctrl)。
敲低ASC表达仅对米托蒽醌诱导的细胞死亡有影响(K图NLRP1 ctrl)
文献结论
文献在SCC细胞系和SCC肿瘤中发现了高水平的自噬受体p62。鳞状细胞中NF-κB活性增加导致p62上调。抑制p62表达可挽救早期SCC细胞中UVB诱导的NLRP1炎症小体活化。p62表达保护SCC细胞免受细胞毒性药物的侵害,而NLRP1使它们敏感。
文献研究将p62确定为人皮肤SCC细胞中NLRP1炎症小体的新型负调节因子,其中通过增加p62水平抑制NLRP1支持皮肤癌细胞的应激抵抗力。
文献总结
不足:
1.本文比较了敲除NLRP1和P62后,NLRP1蛋白的表达情况,但两个指标同时敲除后NLRP1蛋白表达差异不显著,应该在敲除NLRP1基础上,提高P62表达,进一步探究NLRP1的变化差异。
2. 对P62过表达抑制NLRP1的实验论证比较少。
文献使用的实验技术

关注公众号,了解更多!














