脑胶质瘤动物模型
时间:2022-12-27 阅读:2565脑胶质瘤约占中枢神经肿瘤的一半, 临床治疗效果差。尤其是胶质母细胞瘤, 其恶性程度极高, 预后性差, 是威胁人类健康的主要恶性肿瘤之一,因此, 选择一种有效的动物模型是研究脑胶质瘤发病机制及其治疗方法的关键。
1. 设计脑胶质瘤动物模型原则:
①肿瘤须起源于脑胶质细胞;
②肿瘤细胞能在体外或体内正常生长和增殖;
③肿瘤生长状况可评估;
④模型肿瘤应具有与人脑胶质瘤相似的生物学特征,如浸润性生长、异常血管生成、血-脑屏障通透性的改变等;
⑤荷瘤鼠生存期应尽可能长,以用于检验和治疗;
⑥肿瘤细胞对同源宿主的免疫排斥低;
⑦肿瘤细胞无皮下或硬膜外腔转移;
⑧模型对治疗手段的反应可模拟临床工作中人脑胶质瘤的治疗过程。
2. 受体动物选择
① 啮齿类动物
建立脑胶质瘤移植瘤动物模型最常用的受体动物为雄性大、小 鼠类等。
研究表明雌激素及孕激素某种程度上对脑胶质瘤的发生有抑制作用,因此应使用雄鼠构建动物模型。常用的大鼠有 SD 大鼠、Wistar大鼠、Fischer344大鼠等,小鼠有 BALB /C 小鼠、昆明小鼠、C57小鼠及裸鼠等。
② 其他动物
斑马鱼模型在癌症研究方面取得了显著的进展,这些研究的一个重要基础是斑马鱼模型和人类肿瘤中的分子通路具有高度的相似性和保守性。
斑马鱼模型的一个严重缺陷是,脑胶质瘤处于 32℃的环境中,可能会对新陈代谢和致癌分子通路的活性产生影响。
现阶段,如猪、犬等,也被用作脑胶质瘤实验动物模型的受体动物。
3. 模型的构建
① 种植位置选择
异位移植瘤模型多通过在动物皮下注射脑胶质瘤细胞悬液,然后用卡尺测量肿瘤体积变化以观察肿瘤生长情况。由于接种位置与中枢神经系统在微环境上存在明显差异,且机体强烈的免疫排斥导致肿瘤产生自愈倾向,使模型稳定性欠佳,限制了异位移植瘤模型的应用。
② 原位移植瘤手术方法与要点
①采用剪碎肿瘤组织块,然后用针管将其植入到动物颅内的方法,这种方法虽然操作简单,但难以保证定位的精确性及操作的稳定性,成功率低,且难以定量研究。
②利用立体定向技术将经过培养的、标准定量的肿瘤细胞接种到鼠脑中。使用立体定向仪,成瘤率明显提高。用此法可使脑胶质瘤细胞能定位、定量地注入目标位置,防止针头误入侧脑室,减少颅外生长,从而使构建的模型更为可靠。
根据诱导剂的不同,脑胶质瘤动物模型又主要分为化学物质诱发和病毒诱发型。
化学物质诱发的脑胶质瘤动物模型
首见是利用甲基胆蒽制成丸剂植入小鼠脑内而成功诱发的脑胶质瘤。随后,又出现了新的致瘤物质,如烷化剂, 尤其是甲基亚硝基脲和乙基亚硝基脲在中枢神经系统中具有很高的肿瘤诱发率。
研究表明由乙基亚硝基脲诱发的Fisher大鼠脑胶质瘤模型, 联合影像学的应用, 是实验室模拟治疗低级胶质瘤的有效方法。
化学物质诱发的胶质瘤模型病程与人类胶质瘤较为相似, 可被用于胶质瘤的移植试验等, 但也存在诱发肿瘤的遗传背景不清楚、种类不一、性质不稳定等缺点。
病毒诱导肿瘤发生的可能机制有两个:
①是病毒通过将其基因组整合至宿主细胞基因组, 导致宿主肿瘤相关基因的激活或抑癌基因的失活。
②是有些病毒基因内含有致癌基因, 其编码的蛋白可促使宿主细胞发生癌变。
目前应用于诱发脑胶质瘤动物模型的病毒有 BKV、JCV 和 RSV等。
病毒诱发模型是用于研究胶质瘤放/化疗效果的较好模型;但由于该胶质瘤模型动物表达某些病毒性肿瘤特异性抗原, 在研究胶质瘤免疫疗法时, 表现出很强的免疫原性, 因此,在实际应用中并不常用。
移植性动物模型是目前应用最多的肿瘤模型, 也是胶质瘤动物模型中使用最多的方法。
移植性肿瘤动物模型可分为异种移植和同种移植模型:
1. 异种移植模型
为了更好地模拟人脑胶质瘤的特性,异种移植瘤模型常用原代人源脑胶质瘤细胞、脑胶质瘤干细胞( glioma stem cell,GSC) 和脑胶质瘤组织。常用的细胞系包括人脑胶质瘤细胞系 U87、U251、LN229、T98G、U373 等。
如人类胶质瘤细胞系 U251 皮下或颅内注射的裸鼠模型, 可模拟人类胶质瘤的典型性特征, 在组织病理学和免疫组织化学方面与人类胶质母细胞瘤极为相似; 人类胶质瘤细胞系 U87 颅内注射的裸鼠模型虽然与人类胶质瘤不太相似, 但却是用于研究抗肿瘤血管生成及胶质瘤高复发率的良好模型。
2. 同种移植模型
同种移植动物模型的特点是肿瘤组织或细胞移植发生在同种或同系动物之间。同种移植瘤模型常用的细胞系包括大鼠脑胶质瘤细胞系 C6、9L和小鼠脑胶质瘤细胞系GL261、G422等
小鼠胶质瘤细胞系 GL261颅内注射正常小鼠模型; 大鼠胶质瘤细胞系 C6 接种于 Long–Evans大鼠模型; 大鼠胶质瘤细胞系 9L 脑纹状体注射Wistar大鼠模型。
这类模型具有以下性质:
①在颅内形成的移植瘤能较好地模拟中枢神经系统肿瘤的微环境;
②生长在脑内的移植瘤能够在种植位置局部以浸润方式生长,与人脑胶质瘤的生物学行为相对一致。过去原位移植瘤模型存在操作复杂、难以观察肿瘤生长情况等缺陷,但随着立体定向注射技术和影像诊断技术的进步,原位移植瘤模型有了更加广泛的应用空间。
C6胶质瘤动物模型
C6胶质瘤细胞株最先由Wistar-Furth大鼠接触N,N’亚硝基甲基脲诱导产生,这种瘤细胞株在形态学上与GBM相似,核呈多形性,所形成的肿瘤周围有一层反应性增生的星形细胞,肿瘤生长速度较快,呈浸润性生长。
受体动物:Wistar大鼠、Sprague-Dawley(SD)大鼠和Long-Evans大鼠,移植部位一般为大鼠尾状核内。
对于SD大鼠和Long-Evans大鼠,种植C6细胞所形成的瘤体边界清晰并且有包膜,类似于人脑转移瘤和自发性胶质瘤;
而在Wistar大鼠脑内形成的肿瘤更具有人恶性胶质瘤的特点,包括核多形性、高有丝分裂指数、瘤内局灶坏死出血和脑实质浸润。
C6/Wistar模型所形成的胶质母细胞瘤表现出明显的侵袭性,整个中枢神经系统内都可以见到单个迁移的C6细胞。瘤细胞通常沿着神经纤维和血管周围间隙迁移,这种迁移方式同样见于大鼠脑内的人异种移植肿瘤细胞和人脑内恶性胶质瘤细胞。
9L胶质瘤模型
除了C6脑胶质瘤模型外,9L胶质瘤模型的使用率也比较高。其中9L胶质肉瘤模型是将N-甲基亚硝基脲连续注射给Fischer344大鼠约26周诱发而成,属于胶质细胞起源的恶性肿瘤。
举例:将9L瘤细胞移植到Fischer大鼠尾状核内后,镜下可见瘤体由密集的肿瘤细胞所构成,9L细胞呈圆形或梭形,瘤细胞具有高核浆比和变形的核仁,病灶内无自发性坏死。
F98胶质瘤模型
F98胶质瘤细胞株广泛用于同源大鼠颅内移植进行神经肿瘤学研究。此细胞株由Wechsler等对孕20 d BD IX大鼠静脉注射N-乙基-N-亚硝基脲诱导产生。
目前认为F98细胞是间变性胶质瘤理想的模型,具有高浸润性、低免疫原性和中度血管生成活力,同时也具有人GBM的一些属性,普遍作为临床前期啮齿类动物胶质瘤模型。
受体动物:其荷瘤大鼠一般选取Fischer344大鼠。
小鼠是最主要的转基因模式动物, 被广泛的应用于生物科学和医药研究中。目前采用的方法主要有两大类:
(1)传统的转基因小鼠类型;
(2)病毒载体介导类型。
很多人类肿瘤的发生通常伴随着癌基因的激活和抑癌基因的突变或缺失, 胶质瘤的发生也不例外。
1. 传统的基因工程小鼠肿瘤模型
在受精卵和胚胎干细胞水平进行基因导入或敲除可以建立传统基因工程小鼠模型。但是,成人脑胶质瘤主要是后天在环境因素的影响下发病,而传统的基因工程小鼠模型是在其胚胎发育期人为更改肿瘤发生基因或肿瘤抑制基因的表达水平,其肿瘤的发生时间比人类脑胶质瘤的好发年龄早。
此外,由于基因敲除小鼠的所有体细胞基因组上都存在靶基因的缺失或突变,有些基因敲除后动物难以成活,无法进行后续研究。因此,目前已基本不采用此模型。
转基因胶质瘤小鼠模型
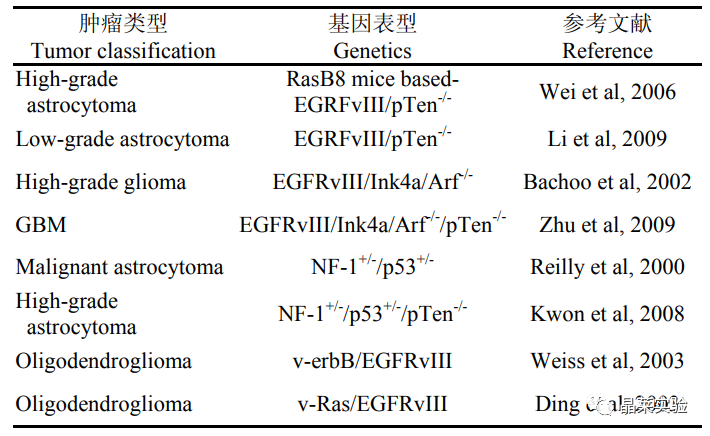
2. 病毒介导的胶质瘤模型
根据使用载体的不同又可分为腺病毒介导、逆转录病毒介导和慢病毒介导胶质瘤模型。
三种载体各有其优缺点:
腺病毒载体具有高效传递和表达基因的能力, 但腺病毒自身具有的非特异致瘤性限制了其应用;
逆转录病毒基因组能稳定地整合至宿主基因组中, 但其宿主范围较窄, 只能感染分裂细胞;
慢病毒载体是目前应用前景较好的转基因载体, 该载体不仅能将外源基因有效地整合到靶细胞基因组内, 而且可以感染各种非分裂细胞。
案例举例:
通过逆转录病毒 RCAS-TVA 系统激活小鼠大脑中Ras和 Akt的表达, 可实现目标基因在胶质细胞中的靶向性表达;
通过慢病毒载体介导Ras的表达或Akt的激活, 它们的表达受到 Cre 重组酶的控制, 将病毒注入 GFAP-Cre 基因小鼠海马区或脑室下区(sub-ventricular zone, SVZ), 可导致 GBM 的发生, 但如果将病毒注射在大脑皮层, 则无法产生脑胶质瘤。
通过腺病毒载体 GFAP-Cre 系统灭活 Rb、p53 和(或)pTen 基因在 GFAP 表达的胶质细胞中表达, 建立胶质瘤的小鼠模型。
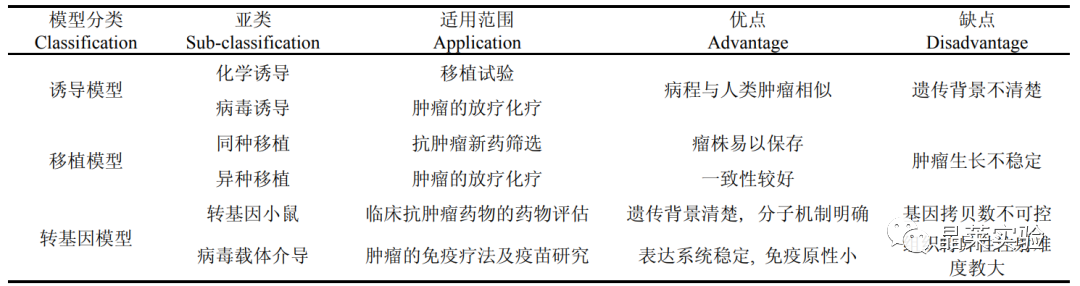
三种肿瘤动物模型优缺点比较
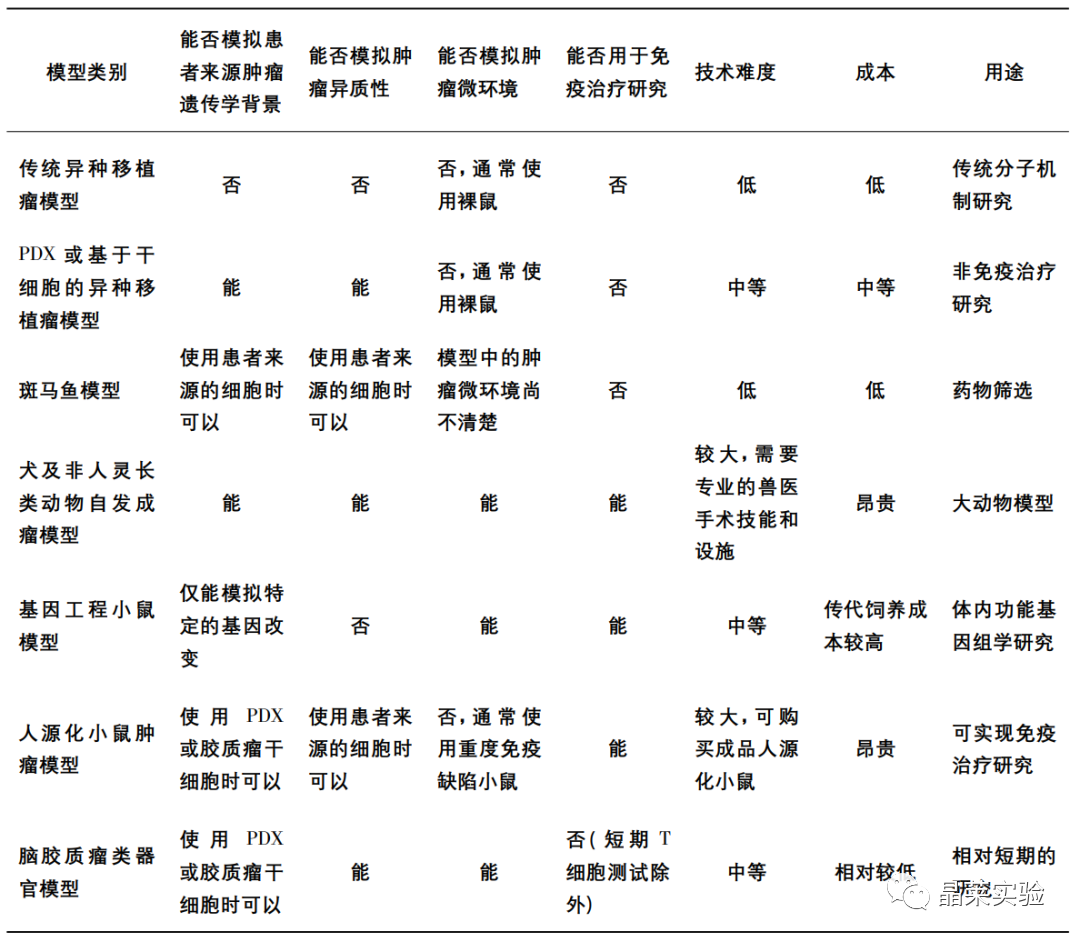
各种脑胶质瘤模型的特点比较
1、动物行为学评价
观察动物表现既往采用观察症状、体征的方法对动物模型的肿瘤生长情况进行评估,如进食情况、体重、精神状态以及压迫症状( 颅内压增高表现、偏瘫) 等。
2、组织学检查
瘤体形态欠规则,无包膜,向周围浸润生长,切面色白,呈鱼肉状。
3、病理染色
HE染色后镜下观察,可见肿瘤区较正常脑组织染色深,有较明确的边界。肿瘤细胞丰富、密集,常排列呈束状及小团块状,细胞分化差,胞核大、圆、深染,核分裂象多见。
肿块内部血管丰富,常见栅栏状坏死区,瘤周组织可有水肿。Ki-67染色结果可反映肿瘤细胞的增殖能力。
4、小动物活体成像检查
活体成像发光技术已广泛应用于肿瘤体内实验。
该技术是让肿瘤细胞带上荧光素酶( Luciferase)或绿色荧光蛋白(GFP)标签,然后用小动物活体成像仪检测肿瘤的生物发光或荧光,以直观可视地、动态地观察肿瘤生长,检测肿瘤生长情况以评估肿瘤大小。
5、影像学检查
磁共振成像( MRI) 技术的应用为动物成瘤过程的检测提供了新的途径。
它作为一种无创性的影像学检测方法,可以在不处死动物的情况下对肿瘤的生长情况进行动态的、多方位的观察,便于在适当的时间进行药效学研究。
参考文献:
Research progress on experimental animal models for gliomas MAO Yufei ,WANG Yan,REN Zhongyu,ZHOU Xiuping .
Animal models of human glioma: the progress of application and investigation ZHU Hui-Fang, ZHANG Yuan-Xu, ZHAO Xu-Dong* (Kunming Institute of Zoology, Chinese Academy of Science, Kunming 650223, China)
Wang X,Wang ZH,Zhang Y,et al.Golgi phosphoprotein 3 sensitizes the tumour suppression effect of gefitinib on gliomas[J/OL].Cell Prolif,2019,52( 4) : e12636.
Zhang Y,Wang Y,Zhou D,et al. Radiation-induced YAP activation confers glioma radioresistance via promoting FGF2 transcription and DNA damage repair[J]. Oncogene,2021,40( 27) : 4580- 4591.
Raila FA,Bowles AP Jr,Perkins E,et al. Sequential imaging and volumetric analysis of an intracerebral C6 glioma by means of a clinical MRI system[J]. J Neurooncol,1999,43( 1) : 11-17.













