癫痫动物模型的构建及应用概况
时间:2022-11-21 阅读:1828癫痫是多种原因导致的脑部神经元高度同步化异常放电的临床综合征,临床表现具有发作性、短暂性、重复性和刻板性的特点。
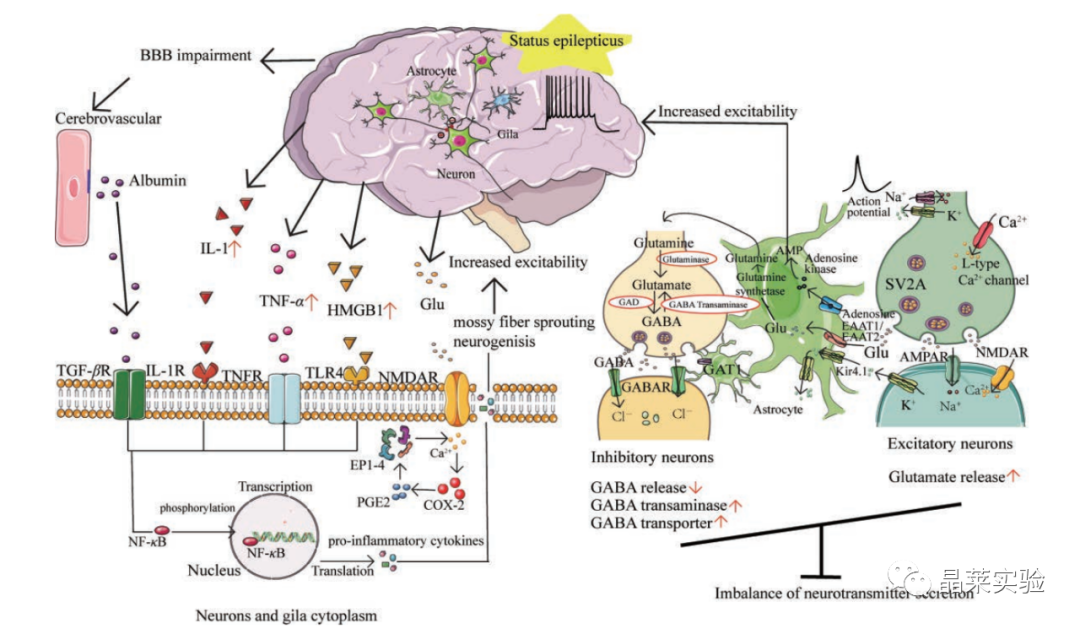
本文将目前已有的癫痫动物模型的诱发方式、优缺点、主要应用等做一总结。
常用的化学点燃方式可通过直接在动物脑内注射低剂量的兴奋剂,或通过反复系统应用阈下浓度的惊厥剂来诱发癫痫。
由于点燃可以精确地确定癫痫发作的时间、癫痫发作的部位,故可提供癫痫倾向性、反复癫痫发作对大脑的影响、不同结构在调节癫痫持续时间和扩散中的作用、不同区域相对易感性等大量信息。
当然它也有一定的缺点: 局部刺激可能无法预测其他部位的后果; 在正常动物中进行的癫痫可能与癫痫动物的发作结果不同,且不同品系、年龄、性别动物对这些化学致痫剂及AEDs 反应存在差异。
1. 戊四氮( pentylenetetrazol,PTZ)
化学药品中最经典的便是通过阻断GABA传递致痫的PTZ,可用于建立急、慢性癫痫动物模型。在啮齿类动物中以阈值剂量注射 PTZ 可导致急性肌阵挛和紧张性扩张; 而以较低的阈下剂量重复给药可引起点燃现象,其最初的非惊厥剂量可降低实验动物的死亡率,同时大多数动物都能诱发癫痫活动,如无需后续药物干预的改良 window-PTZ 点燃法。
低剂量 PTZ( 20 ~ 30 mg /kg) 可引起失神发作,适合于相关 AEDs 筛选。
2. 红藻氨酸( kainic acid,KA)
脑内注射 KA 可用于研究致痫灶对周围和正常脑组织的影响,而全身注射 KA 通常用来研究大脑多个区域对癫痫发生的易感性和药物研究。
在此基础上的 KA 快速点燃法可节约时间、药品成本且具有永久性,KA 模型在潜伏期、行为症状、潜伏期持续时间以及潜伏期和慢性期的脑电图特征等方面与人类相似,有助于我们更好地了解颞叶癫痫过程及相关重要共病,开发更有效的靶向治疗药物。
3. 匹罗卡品
毛果芸香碱( 匹罗卡品)诱导癫痫的能力可能取决于 M1 受体的激活,并可在癫痫发作后可引起海马谷氨酸水平升高及 NMDA 受体激活,从而维持癫痫发作。
该模型具有反复自发性发作、典型海马硬化、苔藓纤维发芽等特点。
匹罗卡品模型相较于PTZ和更加持久,更可靠、实验时间更短及成本最低。虽然其脑电图特征和神经病理学改变与 KA 相似,但全身应用匹罗卡品后,可观察到丘脑、黑质、大脑皮质等更广泛的形态学病变,但须考虑到系统性使用 KA 也可能会导致海马外区域损伤,且颞叶癫痫患者也会有海马外神经元损伤的表现。
4. 金属
通过损伤皮层制备癫痫模型应用最为广泛的便是植入金属,其中最具有代表性的是涂抹铝乳膏的动物模型。
该模型发作间期和发作期脑电图与临床局灶性癫痫相似,偶尔会进展为继发性全面强直阵挛性发作,且该模型对标准 AEDs 的反应也与局灶性癫痫患者相同。
虽然植入金属模型是慢性局灶性癫痫的良好模型,但制备难度大、成本高。
另外,铁离子导入蛛网膜下腔动物模型与皮层或杏仁核注射相比,虽不适合作为人类难治性癫痫的药物及发病机制研究,但其早期诱发出癫痫强烈,成功率高( 95%) ,且能模拟人类蛛网膜下腔出血所产生的癫痫,操作起来也相对容易。
5. 青霉素
低剂量青霉素诱导局灶性癫痫模型适用于研究癫痫发作活动扩散的分析,但青霉素模型更常用于模仿具有抗药性的失神发作。
用青霉素预处理大鼠后,可增加其他化学药物诱导 SWDs,对研究与棘慢波发放相关的细胞机制与在产生棘慢波爆发时皮质对皮质下结构的作用非常有用。
6. AY-9944
AY-9944 是一种抑制 7-脱氢胆固醇降解为胆固醇的化合物,是目前唯一永久性的不典型失神模型,其诱导机制尚不完全清楚,不过为胆固醇在抑制癫痫发生的作用提供思路。
另外 AY 结合抗有丝分裂剂 ( methylazoxymethanol acetate,MAM) 可模拟伴有脑发育不全的难治性不典型失神发作。
该模型在可靠性、自发性、复发性和诱发癫痫的慢性发作方面比遗传模型相更具优势,但在识别和量化实验性失神发作所需脑电图监测方面要求更高。
7. γ-羟基丁酸盐( γ-hydroxybutyrate,GHB)
GHB 模型是公认的失神发作模型,可观察到双侧同步的与行为停止、面部肌阵挛和颤动抽搐有关的 SWDs。使用有生物活性的 GHB 前体( GBL)可产生与 GHB 完全相同的脑电图和行为效应,但其效应相对更持续和迅速。
1. 电刺激
一种局灶性癫痫发作模型是通过直接电刺激皮质产生的,重复电脉冲会导致脑急剧放电。另一种更常用的是通过电点燃数周后,动物可表现出自发癫痫发作。
对于电刺激模型,通常认为电刺激间隔时间才是关键变量,在波宽 1 ms,频率 60 Hz,刺激时间为 1 s 的标准条件下,间隔 15 min 到 7 d都能引出点燃,但间隔 15 ~ 30 min 需要更多次刺激才能点燃。
由于电点燃法需要先进的外科手术和脑电图技术,60Hz角膜点燃法成为了一种简单有效的替代方法。该模型在显性表现和脑电图模式上与精神运动性癫痫具有高相似性; 也被认为是耐药性癫痫潜在治疗药物的筛选工具。
最大电休克( maximal electroshock,MES) 是目前研究全面性发作最透彻、最适宜使用的模型。因为 MES 和 PTZ 制备方法简单,且有比较高的筛选AEDs 的效率,故 MES 模型和 PTZ 模型通常是作为初次筛选癫痫药物的金标准。
2. 低温
低温损伤模型是一种不需要将外源性药物注入体内也可以引起局灶性癫痫的模型。这种液氮探针可造成致痫病灶伴随脑水肿发生,发作可持续数天,具有可重复性,死亡率较低( <5%) ,可发生自发性癫痫,但动物年龄、系统给药对该模型惊厥阈值的影响还不清楚。
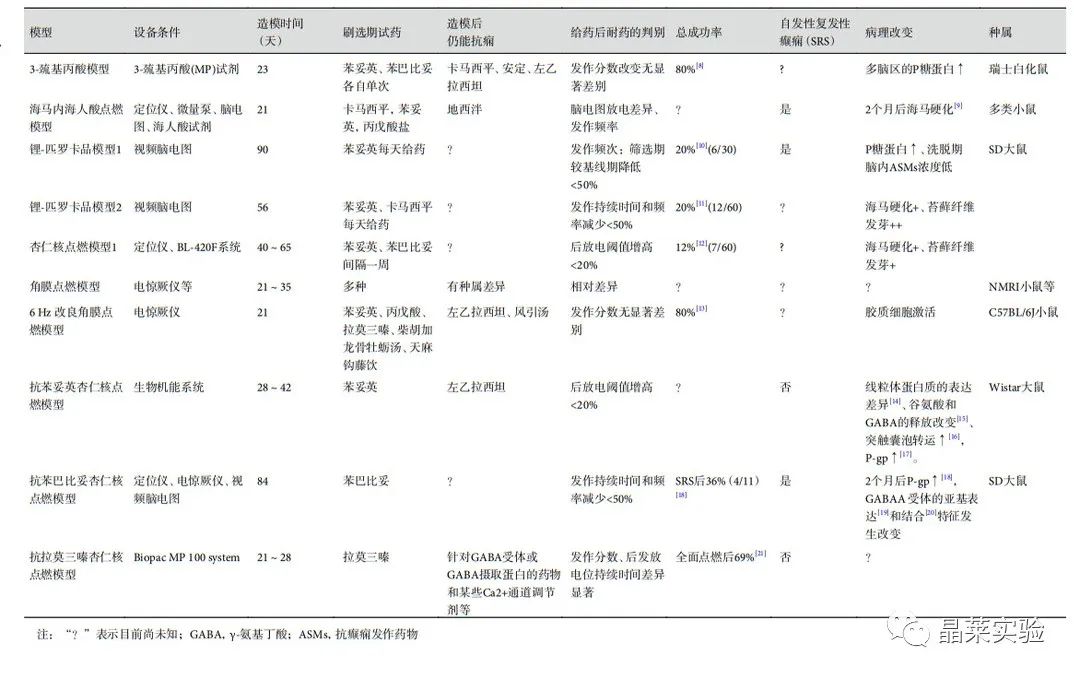
表1、常见动物模型制备

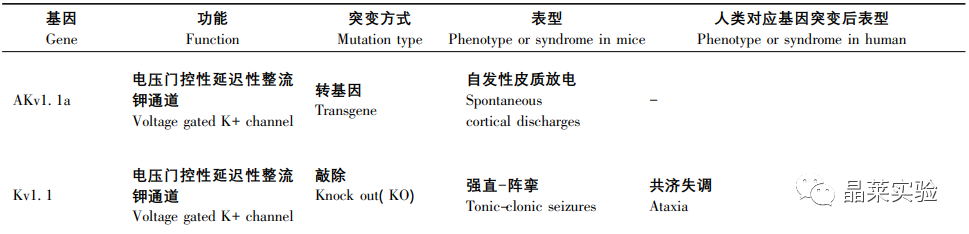
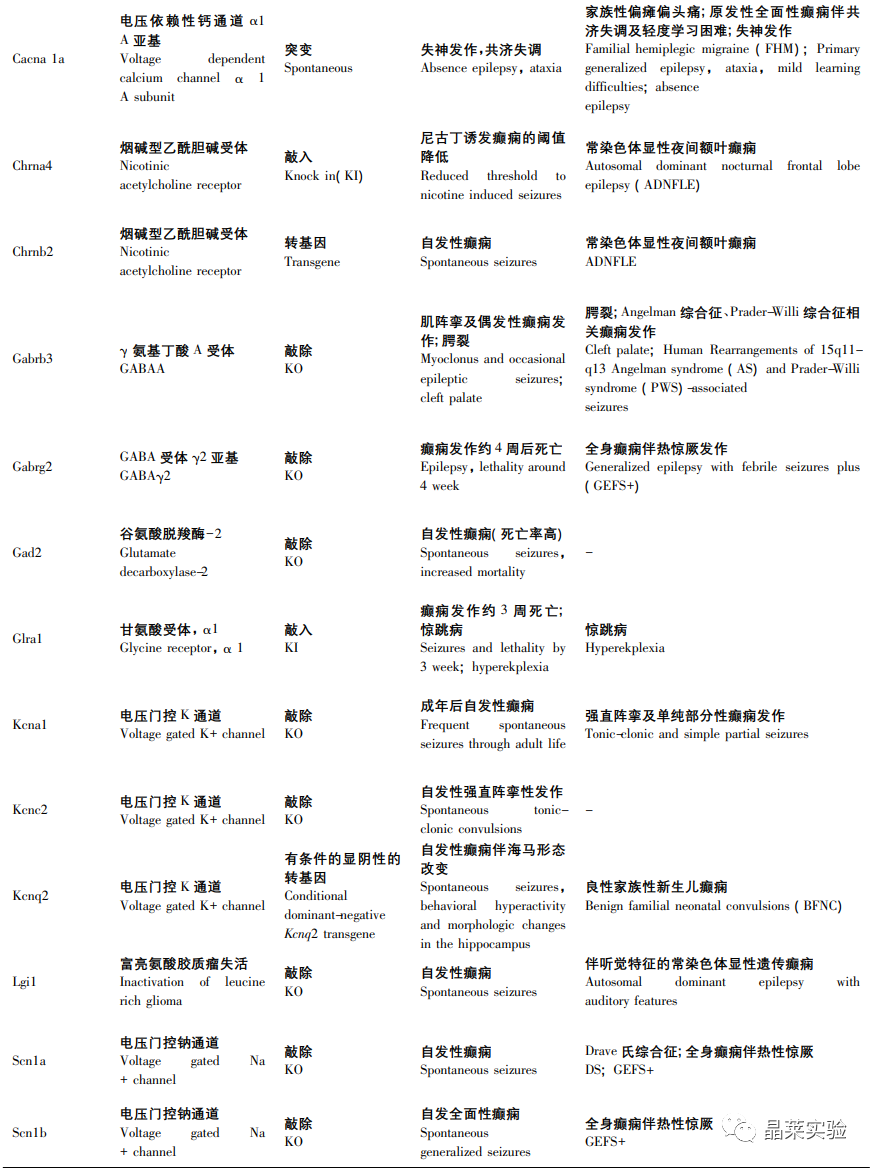
一些神经元烟碱乙酰胆碱受体基因( CHRNA4,CHRNB2,CHRNA2) 和 KCNT1 引起常染色体显性遗传性夜间额叶癫痫和 LGI1 与具有听觉特征的常染色体显性遗传性癫痫的啮齿类动物模型使得遗传因素在局灶性癫痫中的重要作用现已得到充分证实。
而利用遗传性模型来研究人类全面发作也被认为是目前最有希望的途径之一,
主要有光敏性狒狒 Papio Papio 模型、遗传性癫痫易感鼠听源性模型、个体差异较大的癫痫易感沙土鼠( MG) 等模型。
特定的基因表达可能导致任何年龄的动物死亡,如果转基因 DNA 随机插入基因组,在多达 5%的转基因品系中会发生中断或干扰内源性基因的表达,而这种插入突变产生的潜在表型是不可预测的,明显干扰了研究对转基因本身表达产生癫痫的解释。
表2、基因小鼠模型

新生儿惊厥动物模型有助于研究自发性发作的潜伏期和降低癫痫发作阈值,有望用于探究预防癫痫发作的方法,也适宜进行细胞培养用于体外研究。
目前主要有缺氧缺血( hypoxia-ischemia,HI) 和热性惊厥( febrile seizures,FSs) 模型成功复制了新生儿惊厥发作的一些结构异常和认知功能障碍。
1. 外伤
目前创伤后癫痫动物模型都是模仿创伤后晚期癫痫发作,即初始损伤后超过一周发生癫痫,主要用于探究创伤后癫痫发病机制、认知缺陷与细胞死亡、治疗等方面。
流体冲击损伤是创伤后癫痫最广泛使用和研究最深入的模型,可模仿创伤性脑损伤相关的组织病理学,且在伤后1年内表现出持续的神经运动和认知缺陷,但该模型缺乏对治疗药物有效性的预测; 控制性皮质撞击可模仿急性硬膜下血肿、轴突损伤、血脑屏障功能障碍等,数周后癫痫易感性增加,表现为与颞叶癫痫相关的特征,但需要复杂的技术装置; 加速冲击模型相对制造简单且造成损伤严重程度易控制,但再现可靠率低,死亡率高,不能产生自发性发作。
2. 微生物感染
虽然病毒、寄生虫等感染模型有炎症和神经元死亡、高兴奋性和行为性癫痫的证据,可用于相关脑炎治疗药物的检测,但因模型的高死亡率和癫痫活动的变异性,不适于 AEDs 的检测。
3. 脑肿瘤
癫痫发作频率和发生率与肿瘤的位置、病理特征和病变进展有关,因此了解肿瘤性癫痫的病因是准确有效治疗的前提。目前通常将鼠 C6 胶质瘤细胞移植到稳定转染绿色荧光蛋白( GFP) 基因的大鼠的皮质中进行造模,在组织学上类似于人类胶母细胞瘤的弥漫性侵袭性胶质瘤。
4. 脑卒中
脑卒中后痫性发作模型是确定发作关键步骤或途径并制定预防卒中后痫性发作干预策略的关键,目前尚无标准的动物模型,主要因为技术要求高、病变的大小和分布不一、死亡率高。近年来光血栓模型备受关注,其痫性发作发生在光血栓形成数周后,在海马区可发现苔藓状纤维,死亡率相对较低。
在揭示癫痫发生的基本机制、确定药物治疗特定癫痫类型和预防癫痫发展的疗效等方面,这些动物模型发挥了关键的作用。
无论何时使用动物模型,定义一个特定的问题并确保所选模型符合目的,根据目的制造和选择模型才是至关重要的。













