
时间:2021-09-23浏览次数:4563

(一)原理
从供体获取组织细胞的首次培养叫原代细胞培养或初代细胞培养(primary culture)。原代细胞离体时间短,具有二倍体遗传性,在一定程度上能反映体内生长特性,很适合作药物测试、细胞分化和转化等实验研究。在临床应用中,短期原代培养细胞的移植疗效明显高于未经培养的组织细胞。故体外培养的人体各部位细胞,尤其是上皮细胞对于研究各种疾病的发生、发展及防治都具有重要意义。根据不同的实验目的,不同的实验材料,解离或分离细胞的方法和条件各有不同。一般常用方法有二:一是组织块培养法,二是单层细胞培养法。本实验采用胰蛋白酶消化法,对初生乳鼠肺组织进行原代培养。
(二)实验用品
1. 材料:新生乳鼠。
2. 器材:眼科剪、眼科镊、泡器械(直径 15cm )培养皿、动物解剖用的泡沫支架、青霉素瓶、吸管、培养瓶、离心管、废液瓶、倒置显微镜、二氧化碳培养箱、电磁搅拌器。
3. 试剂:Hank’s液、RPMI-1640液、血清细胞培养液、安尔碘、酒精。
(三)无菌操作基本要领和要求
1.操作准备
把实验用品放置于超净台内,打开紫外线杀菌灯和超静台风机,30分钟后关闭紫外线灯。由于紫外线消毒时产生臭氧,对身体有害,故紫外线消毒停止后30分钟才可入室工作。实验溶液恢复至室温后使用,培养细胞和培养用液等避免紫外线照射。
2.洗手:双手经洗手、泡手、酒精消毒,原则上和外科手术相同。在利用超净台工作时,因整个前臂要伸入超净台内,洗刷时一定要清洗到肘部。
3.火焰消毒:在无菌环境进行培养或做其它无菌操作时,首先要点燃酒精灯。以后操作,如安装吸管帽、启开或封闭瓶口等,都需经过火焰烧灼后在火焰近处进行。金属器械在火焰上烧得时间不能过长,以防退火。烧过的金属都要冷却后再使用,以免造成组织损伤。已吸取过营养液的吸管不能再用火焰烧灼,因吸管头中残留营养液能烧焦形成炭膜,再用时会把有害物带入培养液中。消毒火焰要求无色或微蓝色,而红黄色或发黑的火苗,表示燃烧不完全或含有杂质,有害物能混入培养液内。因此酒精灯需用96%的不含杂质的酒精,绝不能使用含有二甲苯和甲醇的酒精。
4.培养操作:进行培养操作时,动作要准确敏捷,但又不必太快,以防空气流动,增加污染机会。不能用手触及已消毒器皿,如已接触,要用火焰烧灼消毒触及部,如不便消毒时,应取备品更换。为便于拿送用品,工作台面上的用品要有合理的布局;原则上应是右手使用的东西放置在右侧,左手用品在左侧,酒精灯置于中央。培养液在用过之后如不再重复使用,应立即封闭瓶口。培养用瓶开口以后,应保持45 度斜位或平放,长时间开口向上直立可增加落菌机会。吸取营养液、细胞悬液及其它各种用液时,均应分别使用吸管,不能混用,以防扩大污染或导致交叉污染。工作中不能面向操作野讲话或咳嗽,以免唾沫把细菌或支原体带入工作台面发生污染。
(四)操作步骤
1.组织块法(以乳鼠肺组织原代培养为例)
(1)取材
将1-3天新生乳鼠,尾巴提起,整个身体浸入75%酒精的烧杯中3秒左右(默数5下),取置灭菌的培养皿中,移入工作台内。小鼠仰位固定在泡沫塑料板上,大头针分别固定鼠头、尾和四肢。安尔碘消毒胸廓部位皮肤。在胸廓正中线中位处,用两把眼科弯镊(第1套器械)夹起皮肤(多夹些),向左右两侧头端撕拉,膈肌部位皮肤向尾端拉,膈肌部位皮肤向尾端拉,皮肤外翻固定,躯干部肌肉暴露(注意!不要使表皮面接触到已暴露出来的胸腹肌)。酒精消毒胸廓后,沿着膈膜剪断胸廓,并将胸骨两侧肋骨剪断(第II套器械)。胸廓暴露后,可见跳动心脏和粉红色肺。将眼科镊弯头端向上(第III套器械),从心脏右上方位插入心肺连接处,轻轻向上用力,将心肺一齐取出,用镊子去除心脏,移入已加Hank's液的青霉素瓶内。
(2)漂洗
用Hank’s液漂洗肺脏表面血污,然后粗剪几下,再用Hank's液漂洗多次后,吸去多余水分。
(3)剪切
组织小块置青霉素瓶一角(上图),眼科直剪用力反复剪切组织块成 1mm3大小,剪切时为保持组织湿润,可以向组织块滴加1-2滴血清培养液。此过程约15-20分钟。
(4)接种
剪切后加少量培养液至 1mm3大小的组织小块中。用吸管头将组织小块移入培养瓶中,小块均匀摆置,块间距 0.3cm 左右,加盖。轻轻翻转培养瓶,瓶接种面向下, 37℃ 、5%CO2培养。1-4小时后,组织小块贴附瓶壁,从瓶侧面加入培养液,再轻轻翻转培养瓶,使液体慢慢覆盖组织小块,静止培养,逐渐从组织块周边生出新细胞。
2.消化法(以0.25%胰蛋白酶为例,pH 7.4-8.0为例)
(1)(2)(3)步同组织块法
(4)消化
用Hank's液将剪刀面组织小块冲入青霉素瓶内,然后将瓶内小组织块用Hank's液移入离心管中,低速离心(500-800转),7分钟。用吸管去除上清液,加入沉淀量的5-8倍0.25%胰蛋白酶液,混匀后加入磁棒并套好离心管塞。离心管放入电磁搅拌器上的 37℃ 水浴杯内。随消化时间的增加,组织块颜色逐渐变白,分离细胞逐渐增多,消化液混浊,消化合适时,常见消化液中有一团松散的白色絮状物(这是因为刚分离单细胞的膜表面有粘性,磁力搅拌作用使它们相互松散结合在一起)或消化液呈白色均匀的浑浊物。此时要及时终止消化。取出离心管。
(5)制备消化细胞悬液
离心管外壁和管口处经酒精消毒后进入超净台内。管口火焰消毒,Hank's液加至10ml。吸管插入管底,吸管头反复轻轻吹打松散组织,使其顺利地通过吸管口,分散成单细胞和小细胞团状态。离心管直立静置片刻,未消化的组织块自然沉降(可加消化液再消化)。将细胞悬液移至另一离心管(管内先加1ml血清细胞培养基)中,补加Hank's液至10ml,细胞混匀后低速离心(速度、时间同前)。去上清液。
(6)接种
加20%血清细胞培养液,细胞混匀计数,调整细胞浓度为5.0×105/ml的密度接种到培养瓶,移入 37℃ ,5%CO2温箱中培养。
(四)结果
1.组织块法培养的细胞观察
在倒置显微镜下,经24小时培养的组织块边缘有少量梭形或长条形细胞游离出来,随着培养时间延长,组织块周围的细胞数量越来越多,呈放射状向外扩展,最边缘的细胞能够通过变形运动向外延伸,细胞密度较大时才连成片,反之,则连接成网状。这些细胞的核明显,呈椭圆形。胞质均匀,透明度大,靠近组织块的细胞体积较小,离组织块较远的区域细胞体积较大。
2.胰蛋白酶消化法培养的细胞观察
用倒置显微镜观察发现,刚接种于培养瓶中时,细胞是圆形、悬浮的。24h后,多数细胞附着于培养瓶底部(贴壁),胞体伸展,常向外伸出2-3个长短不同的突起,由于突起数目不同,细胞形态有梭形、扇形或星形。细胞边缘不整齐、胞浆透亮。细胞核呈椭圆形,核仁明显。
(五)注意事项
1.吸液体前,瓶口和吸管火焰消毒。吸液体时,听不到两者的碰撞声。
2.离心管入台前,做好管口、管壁消毒。
3.实验者离开超净台时,要随即用肘部关闭工作窗。
4.器械用后用酒精棉球擦去血污,泡入另一个皿中,器械浸泡时剪刀口要叉开放,镊子弯头要向下放,皿加盖继续消毒。
5.器材使用时既要注意消毒,又要防止烫伤、烫死细胞。火焰消毒的吸管一定要经Hank's液冷却和湿润管内壁(这是因为刚分离的组织细胞易粘在管壁上)。
6.超净台内温度、湿度较大,夏天工作台内散热慢,细胞悬液混匀、接种时,离火焰要稍远些。
7.组织块剪切时,用吸管头将组织块细胞推向青霉素瓶一角,然后将有组织块的瓶面翻向上方,吸去流向对侧的多余水分。多余水分若不除去,则组织块剪切不细,消化后细胞悬液清亮(细胞数少)并可见消化液中有线性絮状物漂浮。
原代细胞分离培养与鉴定(鉴定可提供流式细胞仪检测、免疫细胞化学、RT-PCR 、蛋白免疫印迹等多种方法检测)。

● 细胞传代代数低(一般4代),细胞状态好,无污染;
● 可以提供多种原代培养的细胞。
1、详细说明进行原代细胞培养的组织,并确定组织是由客户提供还是本公司提供;
2、尽可能提供该原代细胞的培养条件,或者由本公司摸索培养条件;
3、对于一些常见的原代培养组织,因为保存运输的不便可能会降低原代培养的成功率,建议客户选择由本公司提供相应的组织。
晶莱生物服务流程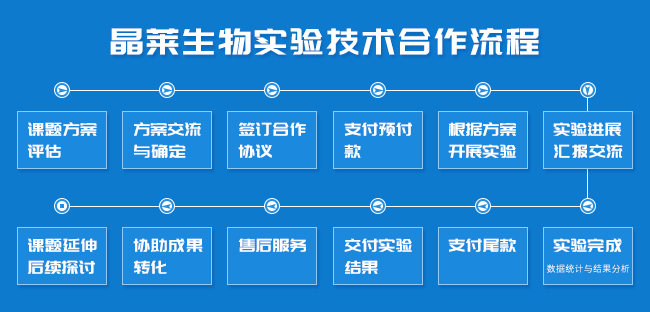
晶莱生物实验服务项目
| 动物实验 | 细胞生物学 | 病理实验 |
| 消化系统模型 | 细胞培养 | 病理染色 |
| 胃酸分泌模型 | 普通细胞株 | HE染色 |
| 脓毒症模型 | 细胞缺氧培养 | 油红O染色 |
| 胃溃疡模型 | 细胞培养+支架 | 番红固绿染色 |
| 胰腺炎模型 | 干细胞培养 | Masson染色 |
| 肝纤维化模型 | 原代细胞分离/提取/培养 | 天狼猩红染色 |
| DIO肥胖模型 | 细胞转染/病毒感染 | PAS糖原染色 |
| 胆结石模型 | Trans well共培养 | 阿利新蓝染色 |
| 结肠炎(UC)模型 | 细胞增殖 | 甲苯胺蓝染色 |
| 脂肪肝模型 | 细胞计数 | 尼氏染色 |
| 急性肝损伤模型 | 生长曲线测定 | LFB髓鞘染色 |
| 免疫、代谢系统疾病模型 | 存活曲线测定 | 普鲁士蓝染色 |
| 骨质疏松模型 | ccK-8增殖检测 | VG染色 |
| 糖尿病模型 | MTT增殖检测 | EVG染色 |
| 高尿酸血症模型 | CFSE检测增殖-流式检测 | VonKossa染色 |
| 呼吸系统模型 | BrDU检测-免疫荧光法 | 刚果红染色 |
| 肺纤维化模型 | 细胞凋亡 | 苏丹黑B染色 |
| 慢性肺阻塞模型 | Annexin V/PI流式检测细胞凋亡 | Trap染色 |
| 急性肺损伤模型 | WB检测凋亡相关蛋白 | 抗酸染色 |
| 哮喘模型 | 透射电镜观察凋亡小体 | 革兰氏染色 |
| 肺栓塞模型 | Tunel染色(POD法,DAB显色) | AB-PAS染色 |
| 支气管炎模型 | Tunel(荧光法,含试剂盒) | 亚甲基蓝染色 |
| 泌尿生殖系统模型 | DNA ladder法 | 苯胺蓝染色 |
| 慢性肾衰模型 | 细胞周期 | 荧光 DAPI染色 |
| 急性肾衰模型 | 细胞显微计数 | 普鲁士蓝染色 |
| 肾间质纤维化模型 | PI染色 | 间苯二酚碱性品红染色 |
| 肾结石模型 | BrdU渗入法 | 银染 |
| 肾炎模型 | 免疫荧光染色 | 黑色素染色 |
| 子宫内膜异位症模型 | PI流式检测细胞周期 | 镀银染色 |
| 心血管系统模型 | 细胞运动 | PASM 六胺银染色 |
| 冠心病模型 | Transwell检测细胞迁移 | VG染色 |
| 心肌梗死模型 | Transwell检测细胞侵袭 | 富尔根染色 |
| 心脏骤停模型 | 细胞划痕 | 亚甲基蓝染色 |
| 慢性心力衰竭模型 | 细胞克隆 | 碘-碘化钾染色 |
| 动脉粥样硬化模型 | 集落形成法/稀释铺板方法 | Goldner三色法染色 |
| 白血病模型 | 软琼脂克隆法 | PAS-萘酚磺S染色 |
| 高血压模型 | 毛细管克隆法 | 改良苯酚品红染色 |
| 神经系统模型 | 体外实验血管生成 | 网状纤维染色 |
| 脑卒中模型 | 磁珠分选细胞 | β-半乳糖苷酶染色 |
| 栓塞性脑梗死模型 | 流式分选细胞 | 镀银染色 |
| 脑出血模型 | 开机费 | movat五色染色 |
| 脑损伤模型 | 单色 | 维多利亚蓝染色 |
| 脊髓损伤模型 | 双色 | 免疫组化 |
| 帕金森模型 | CBA多细胞因子流式检测 | 免疫组化预式 |
| 老年痴呆模型 | 组织/血液细胞制备 | 免疫组化正式 |
| 应激模型 | 组织单细胞制备 | 免疫荧光(石蜡-单标) |
| 骨骼疾病模型 | 中性粒细胞提取 | 免疫荧光(石蜡-双标) |
| 骨折模型 | 其他样本细胞制备(如血液等) | 免疫荧光(石蜡-三标) |
| 骨缺损模型 | 外周血PBMC分离 | 免疫荧光(冰冻-单标) |
| 风湿免疫性关节炎模型 | 线粒体组学 | 免疫荧光(冰冻-双标) |
| 骨关节炎模型 | 线粒体膜电位检测-流式法 | 制片前处理 |
| 五官疾病模型 | 线粒体膜电位检测-免疫荧光法 | 石蜡组织包埋 |
| 眼科疾病模型 | 线粒体ROS生物含量检测--流式 | 特殊包埋(细胞、材料、眼球等) |
| 鼻腔疾病模型 | 线粒体ROS生物含量检测--免疫荧光 | 软化(肝硬化、皮肤结痂、植物等) |
| 皮肤疾病模型 | 线粒体通透性转换孔(mPTP) | 骨组织脱钙(小) |
| 皮肤损伤模型 | 溶酶体免疫荧光法 | 骨组织脱钙(大) |
| 肿瘤疾病模型 | 线粒体+溶酶体共定位 | 骨组织EDTA脱钙(小) |
| 原位瘤模型 | 内质网 | 骨组织EDTA脱钙(大) |
| 转移瘤模型 | 线粒体钙瞬时变化检测-流式 | 石蜡白片 |
| 皮下植瘤模型 | ATP检测 | 细胞爬片 |
| ADP检测 | ||
| AMP检测 | ||
| 流式 | DNA/RNA半定量检测 | 基因编辑工具 |
| 组织细胞悬液处理 | pcr检测mRNA | 合成(3保1)片段/质粒/引物合成 |
| 细胞处理 | microRNA检测 | 质粒载体构建 |
| 血液标本处理 | LncRNA表达量的检测 | 过表达腺病毒载体构建包装 |
| 细胞刺激培养 | CirRNA表达量的检测 | shRNA腺病毒载体构建包装 |
| 单色检测 | 凝胶电泳 | 过表达慢病毒载体构建包装 |
| 双色检测 | 基因合成 | shRNA慢病毒载体构建包装 |
| Annexin V/PI凋亡 | <300 | 过表达腺相关病毒载体构建包装 |
| 细胞周期 | 300-1,500 | shRNA腺病毒载体构建包装 |
| 1500 - 5000 | 稳转细胞株 | |
| >5000 | ||
| 特殊序列 | ||
| ELISA | WB | qPCR |
| 组织匀浆处理 | 蛋白提取及定量一 | RNA抽提 |
| ELISA(不含试剂盒)48T/kit | WB检测一(10孔膜/指标) | mRNA引物设计及合成 |
| ELISA(不含试剂盒)96T/kit | 灰度值分析及作图一(10孔膜/指标) | miRNA引物设计及合成 |
| ELISA(含国产试剂盒)48T/kit | 蛋白提取及定量二 | LncRNA引物设计及合成 |
| ELISA(含国产试剂盒)96T/kit | WB检测二(15孔膜/指标) | CircRNA引物设计及合成 |
| 灰度值分析及作图二(15孔膜/指标) | mRNA RT-qPCR | |
| miRNA RT-qPCR | ||
| LncRNA RT-qPCR | ||
| CircRNA RT-qPCR |
