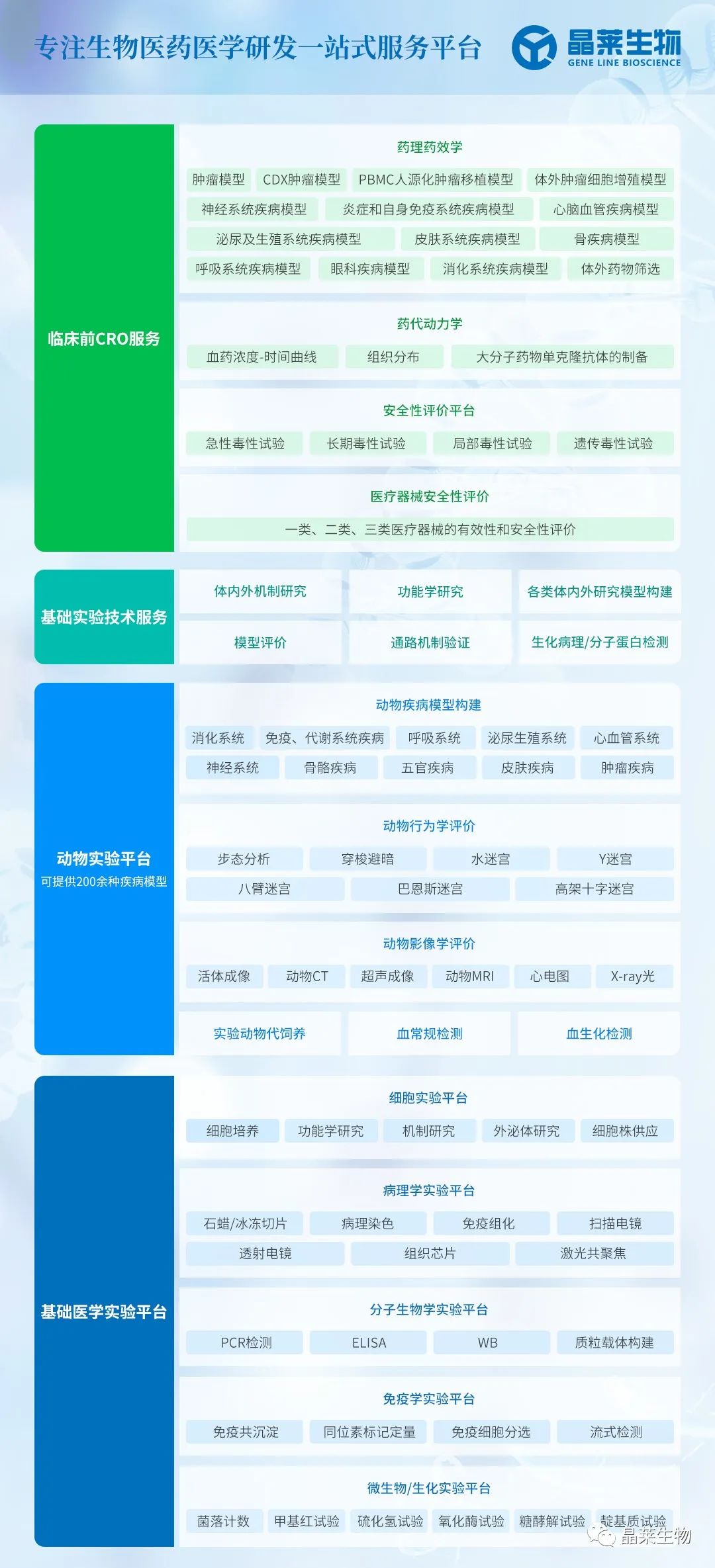
细胞外泌体摄取实验方案(DiD荧光标记)——基于膜融合示踪技术的实验流程
时间:2025-03-17 阅读:673
1. 核心原理
采用DiD(DiIC18(5)-DS,CAS 127274-91-3)脂溶性荧光探针标记外泌体膜结构。该探针具有以下特性:
膜特异性:通过疏水作用嵌入脂质双分子层(激发/发射波长644/663 nm)。
环境敏感型荧光:标记后量子产率提升20倍(从水相0.01至膜结合态0.21)。
低毒性:工作浓度下细胞存活率>95%(MTT法验证)。
2. 关键设计进
外泌体质量控制:增加NTA粒径分析(80-150 nm)、TEM形态学验证、Western blot检测CD63/TSG101/Alix标志物。
标记效率量化:通过荧光分光光度计测定DiD标记外泌体的荧光强度(Ex/Em=644/663 nm),计算标记效率(μg DiD/mg外泌体蛋白)。
动态监测优化:引入活细胞动态成像系统(37℃, 5% CO₂维持),实现时间分辨率达5分钟级的实时观测。
1. 生物材料
细胞系:人源肿瘤细胞(如MCF-7)、原代巨噬细胞(BMDM)。
外泌体来源:超速离心法(100,000×g, 4℃, 70 min)联合密度梯度离心纯化。
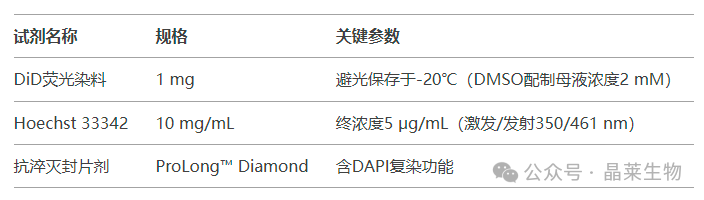
2. 试剂系统
3. 仪器配置
超分辨共聚焦显微镜(Nikon A1R HD25,配备60×油镜)。
活细胞成像系统(PerkinElmer Opera Phenix)。
超速离心机(Beckman Coulter Optima XPN-100)。
1. 外泌体标记与表征
① 标记反应体系:
外泌体悬液(100 μg蛋白) + DiD母液(终浓度5 μM) → 37℃避光震荡孵育4 h(转速200 rpm) → 超速离心(120,000×g, 4℃, 90 min)去除游离染料 → 过PD-10脱盐柱(Cytiva)进一步纯化。
② 质量控制:
BCA法测定蛋白浓度(标记后回收率≥80%)。
ZetaView纳米颗粒分析仪检测粒径分布(PDI<0.2)。
荧光强度标准化:以BSA-DiD标准曲线校准。
2. 细胞处理与摄取实验
① 细胞铺板:
共聚焦专用培养皿(MatTek P35G-1.5-14-C)。
接种密度:5×10⁴ cells/cm²(依细胞类型调整)。
贴壁时间:16 h(确保细胞处于对数生长期)。
无血清培养基稀释DiD-外泌体至工作浓度(梯度设置:10-200 μg/mL)。
37℃共孵育时间梯度(0-24 h,间隔2 h动态监测)。
竞争抑制对照:添加肝素(10 μg/mL)阻断网格蛋白通路。
4% PFA固定15 min → 0.1% Triton X-100透膜5 min。
Hoechst 33342染色(5 μg/mL, 10 min)。
抗淬灭封片:ProLong™ Diamond封片剂 。
② 外泌体摄取:
③ 样本固定与染色:
3. 图像采集与定量分析
① 显微成像参数:
DiD通道:640 nm激光(5%功率),700-750 nm发射滤片
DAPI通道:405 nm激光(2%功率),425-475 nm发射滤片。
Z-stack扫描(步距0.5 μm),3D重构消除焦点漂移
② 定量方法:
ImageJ FIJI软件分析:ROI内DiD荧光强度积分密度(IntDen)。
流式细胞术交叉验证:Accuri C6检测DiD+细胞比例。
共定位分析:计算DiD信号与溶酶体探针(LysoTracker Green)的Manders系数。
1. 标记特异性验证:
阴性对照:未标记外泌体 + 游离DiD染料。
阳性对照:DiI标记外泌体(激发/发射549/565 nm)。
2. 动态范围优化:
确定线性检测范围:外泌体浓度与荧光强度R²>0.98
光漂白校正:Time-lapse成像时添加抗淬灭剂(如Oxyrase)。
3. 膜完整性检测:
透射电镜验证:标记后外泌体膜结构完整。
Annexin V-FITC共染:检测膜磷脂酰丝氨酸外翻率<5%。
1. 摄取通路解析:
网格蛋白抑制剂(Pitstop 2,终浓度30 μM)。
小窝蛋白抑制剂(Filipin III,终浓度1 μg/mL)。
巨胞饮抑制剂(EIPA,终浓度50 μM)。
2. 功能验证实验:
siRNA敲低靶基因(如Rab5/Rab7)。
外泌体内容物示踪:加载CFSE标记的miRNA模拟物。
关于晶莱