【五分钟讲实验】常用的骨髓间充质干细胞( BMSCs)分离、纯化方法你掌握了吗?
时间:2023-11-13 阅读:1064骨髓间充质干细胞( BMSCs)是在哺乳动物骨髓基质中广泛存在的一类多能基质干细胞,BMSCs因为具有强大的治疗潜能已成为广大研究人员关注的焦点。
BMSCs属于全能型间质干细胞,基于其各种特性,BMSCs广泛用于抗肿瘤基因治疗、造血干细胞移植、组织损伤修复和自身免疫疾病。
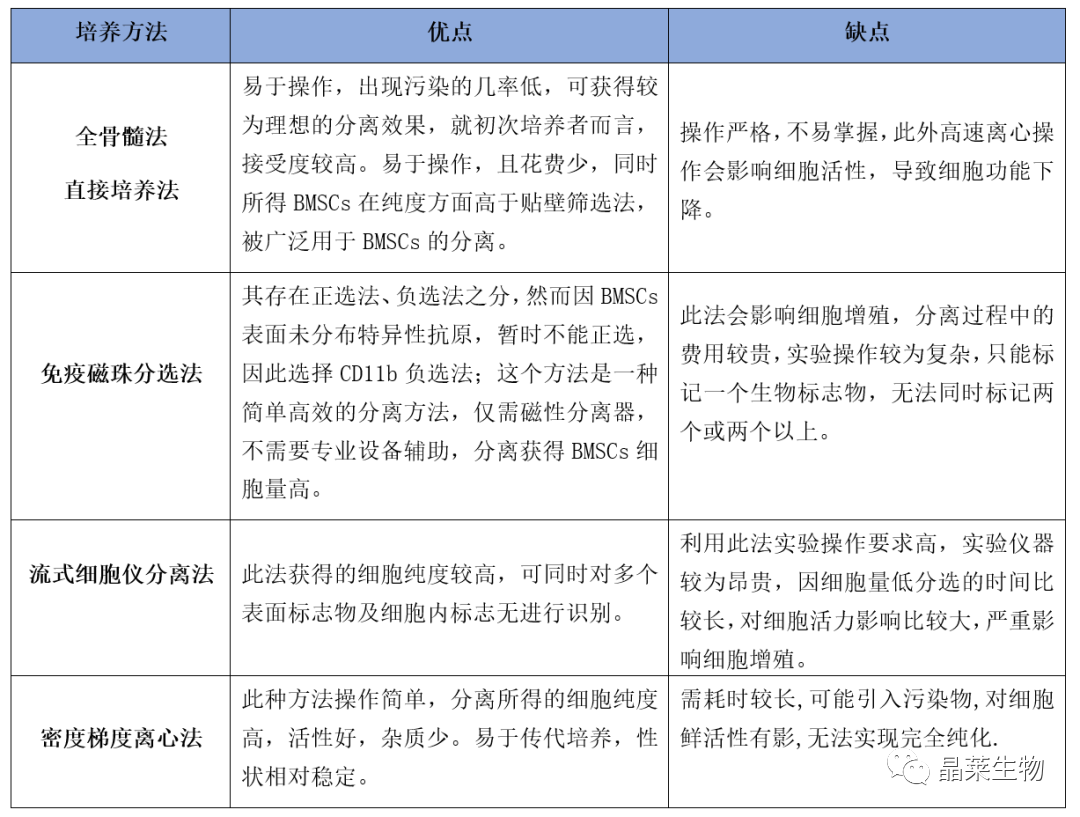
现今,在分离、纯化大鼠BMSCs方面,可通过诸多途径来分离BMSCs,应用广泛的包括贴壁筛选、密度梯度离心与骨组织消化法。近年来,还出现了新的方法,如免疫磁珠分选法、流式细胞仪分离法与特殊培养板筛选法。
各类分离、纯化BMSCs方法对比
全骨髓培养法
1. SD大鼠BMSCs分离
通过全骨髓细胞悬液贴壁法完成BMSCs的分离培养,使用颈椎脱臼法将SD大鼠处死,接着马上通过75%乙醇(ET)浸泡大鼠。
取出大鼠后使用碘酒和酒精棉球擦拭四肢进行消毒处理。使用灭菌消毒后的镊子和剪刀将大鼠股骨和胫骨分开,去除肌腱及肌肉,利用PBS反复冲洗干净;随后将股骨和胫骨浸泡在DMEMF-12培养基中,剪掉胫骨、股骨的干骺端,用5号空针针头插入骨髓腔,用DMEM培养液从干骺端和另一端骨髓反复冲洗多次,借助移液器对培养皿中骨髓冲洗液行反复吹打,消除细胞团,得到单细胞悬液;在室温下对骨髓细胞悬液离心,1000rpm,离心5分钟,弃上清,再将沉淀稀释于含15%胎牛血清(FBS)的DMEMF-12培养液中。
预先制备DMEM/F12培养液(内含15%FBS),对分离得到的骨髓细胞悬液进行计数,确保细胞浓度在1×10^6个/mL,将分离所得BMSCs实施原代培养,把培养瓶移至37℃、5%CO2恒温培养箱内。
第2d借助显微镜查看BMSC的状态,清理掉培养瓶内旧细胞培养液,通过PBS溶液实施2遍或3遍洗涤,再添加新鲜培养液接着培养,如此能够清理掉培养瓶内未贴壁细胞。以后每2-3天对细胞状态进行观察,根据实际情况更换一次培养基,BMSCs一般10天左右细胞生长融合。
BMSCs 的生长情况及形态
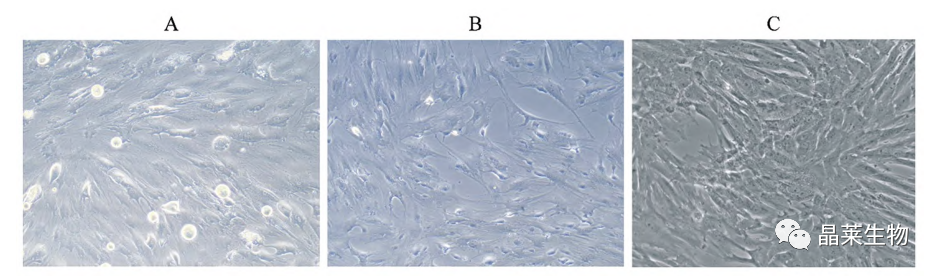
待呈80%时细胞生长密度,进入传代培养,期间通过胰酶(0.25%)消化,实施1:2细胞传代,3-5d开始1次传代。
接种BMSCs:准备对数生长期细胞,使细胞浓度呈2×10^4个/mL,进行接种培养,在37℃,5%CO2培养环境下培养至细胞密度到60-70%,弃掉上清,加入成骨诱导分化培养基;细胞分化诱导:每2-3天更换成骨诱导培养基,继续在37℃,5%CO2培养环境下培养14-21天,并注意观察细胞形态变化。根据细胞钙盐结晶析出和钙质结节形成的情况,决定终止细胞诱导的时间,进行染色鉴定。
细胞固定:将培养基吸除掉,通过适量1×PBS实施1遍清洗,弃去后取适量4%中性甲醛溶液覆盖培养器皿底面,室温固定30-60min,回收固定液,用PBS清洗残留固定液;
ARS染色:培养器皿底面覆以ARS染液,经过3-5min,回收染液,用PBS清洗残留染液,并加入适量1×PBS避免细胞干燥;
诱导评估:镜检观察、图像采集和诱导评估。诱导成功时,钙质结节会与茜素红染料结合后呈现红色或橘红色。
4. BMSCs成脂诱导与鉴定
接种BMSCs:取对数生长期的细胞,调整细胞浓度为2×10^4个/mL,进行接种,37℃,5%CO2培养环境下培养细胞密度至90-100%,弃掉上清,加入成脂诱导分化培养基诱导液。细胞分化诱导:于37℃、5%CO2环境中进行3d培养,再替换成成脂诱导分化培养基诱导液,经过1d培养,接着改用成脂诱导分化培养基维持液,再进行3d培养。按照以上换液频率诱导14-21天,并注意观察细胞形态变化。根据细胞诱导形成的脂滴数量和大小,决定终止细胞诱导的时间,并进行染色鉴定。
细胞固定:将培养基吸除掉,通过适量1×PBS实施1遍清洗,弃去后取适量4%中性甲醛溶液覆盖培养器皿底面,室温固定30-60min,弃去固定液再使用1×PBS清洗两次。
油红O染色:取生理盐水或1×PBS与油红O原液配制油红O工作液(油红O原液:生理盐水=3:2),现用现配。向清洗干净的诱导孔内加入适量工作液,静置染色30min;吸走油红O工作液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥;
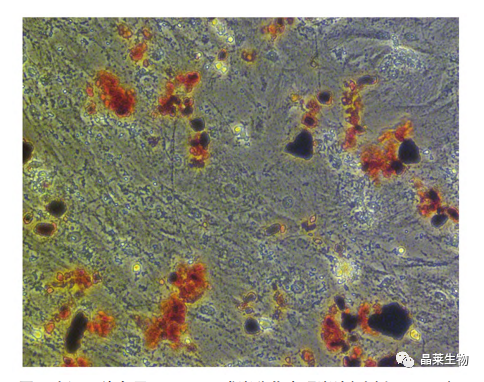
诱导评估:显微镜下观察成脂染色效果,并进行图像采集和诱导评估;诱导成功时,脂滴会与油红O染料结合后呈现红色或橘红色。
① 准备细胞:对培养后的细胞行离心处理(1000rpm,5min)弃去上清,以Buffer溶液重悬,注意观察细胞的分散程度,是否有团块,若有团块,需静置3-5min,弃去团块,并再次静置3-5min,继续观察细胞分散程度,若仍有团块,那么应重复以上操作,添加一定量PBS实施1遍洗涤,将上清倒掉;
② 混匀细胞,对待测定细胞量展开求解,同时借助细胞计数仪统计细胞悬液内细胞量,稀释到所需的细胞数,细胞重悬到5×10^6--10×10^6/mL之间;
③ 取100μL的细胞于EP管或流式管内,按量加入抗体,加入抗体时必须和细胞保持充分的混合,可在震荡仪上稍微混匀。在4℃冰箱孵育30min;
④ 吸取1.5-2mLBuffer溶液,加入流式管内,重悬细胞,1000rpm离心4min后弃去上清;
⑤ 再次重悬细胞,离心后留细胞团。吸取100μLBuffer溶液,加入流式管内,重悬细胞;
⑥ 避光吸取二抗,加入流式管内,加入抗体时必须和细胞保持充分的混合,可在震荡仪上混匀(避光)。4℃进行孵育,计时30min;
⑦ 吸取1.5-2mLBuffer溶液,加入流式管内,小心吹打,使彻底混合,于1000rpm下实施离心处理,经过4min,把上清除掉。
⑧ 吸取400μLBuffer溶液,加入流式管内,轻轻吹打混匀,用滤网过滤细胞,上机检测。
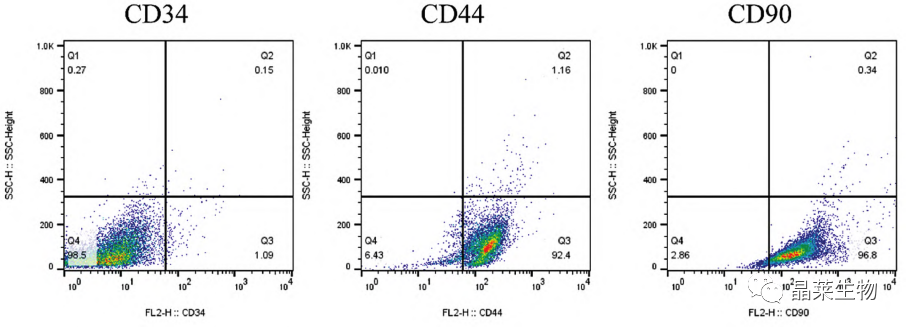
鉴别的标准为借助FCM对CD90、CD105与CD73、的阳性率展开测定,或为CD45、CD34、CD11b或CD14、CD19或CD79α、HLA-DR显示阴性。
应用最广泛的染色手段是ARS染色法,ARS染色与主要调控基因BMP2,Runx2表达证实BMSCs有潜在成骨分化能力。
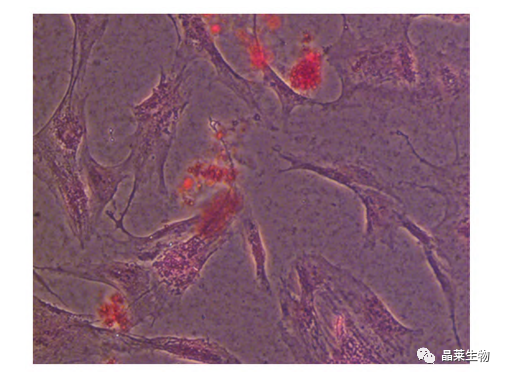
应用最广泛的染色手段是ORO染色法,经由ORO染色与PPARγ标志基因的表达,对BMSCs具备成脂分化活性加以明确。
密度梯度离心法
1. 大鼠BMSCs的分离和培养
大鼠BMSCs的分离:用颈椎脱臼法将SD大鼠处死,然后立即将其浸泡在75%酒精里。碘酒擦拭四肢,再用酒精棉球擦拭,无菌条件下用灭菌消毒后的镊子和剪刀分离出大鼠股骨和胫骨,PBS溶液冲洗两遍。从中间剪断股骨和胫骨,用2ml无菌注射器吸取DMEM/F12溶液冲出骨髓细胞多次,再用针头吹打,将骨髓细胞用吸管吸入到离心管内,离心5min,把上清液移除,用PBS溶液重新使骨髓细胞悬浮。慢慢的向离心管中加入细胞悬液,离心管容量为15ml,此离心管内预先装5ml细胞分离液,保持细胞悬液在淋巴细胞分离液上层,淋巴细胞分离液可将骨髓细胞分层,一定要注意液面不可以被搅动,分离液与细胞悬液的分层保证不被破坏。
将装有细胞混悬液和淋巴细胞分离液的离心管离心20min,完成离心操作后的溶液会有四层的分层,吸取中间骨髓基质细胞层,即颜色为为白色的浑浊状层,最后用PBS溶液清洗三次。
大鼠BMSCs的培养:向培养瓶中添加胎牛血清与DMEM/F12溶液,细胞浓度为10^6/ml,将培养瓶放置于37℃、5%CO2恒温培养箱中进行细胞培养24h后将培养瓶中的细胞培养液弃去,用PBS溶液冲洗2~3次,然后加入培养液继续培养,目的是去除培养瓶中未贴壁的细胞。以后每3d半量换液1次,一般10d左右细胞生长融合。用0.25%的胰酶消化培养瓶中的贴壁细胞,然后1:2进行细胞传代,一般3~5天进行1次传代,选取第三代细胞进行之后的实验过程。
用6孔板培养细胞,待细胞生长达到60%~70%,弃掉旧培养基,用0.25%胰酶消化细胞,收集到离心管内。1000rpm离心5min,沉淀细胞。然后对细胞进行沉淀。但是对于一些特定的细胞,如果这些细胞沉淀的不充分,离心时可以适当的延长离心时间或使离心力变大。小心的吸去离心管中的上清液,可以残留约50μl的培养基。加入预冷的PBS溶液约1ml来重悬细胞,再次离心用来沉淀细胞。然后再次重复上述步骤,重悬细胞后调整细胞密度至2×10^7/ml。
轻轻的弹击离心管底部以适当的分散细胞,避免细胞凝集成团。在每个流式检测管中加入50μl稀释后的R-CD29-PE/R-CD44-PE和R-CD3leFluor660/R-CD45eFluor660抗体。同时设置空白管,在空白管加入50μlStainingBuffer。在每个流式检测管中分别加入50μl的细胞悬液,细胞数量约为10^6,并且将细胞轻轻地混匀,不要太用力。将流式检测管进行冰浴或在4℃冰箱中避光孵育20min。冰浴或者孵育完成后,加入StainingBuffer(每个流式检测管中分别加1ml)。转速为1000rpm、4℃离心5min,然后弃去离心管中的上清液,用PBS溶液重复洗涤过程3次。最后100μl重悬细胞后上流式细胞仪进行检测,共检测四种细胞表面抗原 CD29、CD31、CD44、CD45的表达。
参考文献:
1.YANGChun-li,LUJin-zhi,LIUBei-bei,XIANGMeng-ni,DAIRong-fen,XIONGZheng-hua,HANXuesong,PrimaryCultureandIdentificationofBoneMarrowMesenchymalStemCellsfromRat*.ProgressinModernBiomedicineVol.23NO.18SEP.2023
2.BAIXiujuan,LIYifan,SHIXiaobing,SHANGYanchang,JIANGLei,DepartmentofNeurol-ory,TheSecondMedicalCenter&National Clinical Research Centerfor Geriatric Diseases,ChinesePLA GeneralHospital,Beijing100853,China.
3.许蕾,韩建国,李家锋.人BMP-2体外定向诱导犬BMSCs向成骨方向分化的实验研究[J].泰山医学院学报,2015,(9):971-974
4.李娜,代晓霞.Runx2在骨形成中的作用及调控[J].国外医学:医学地理分册,2018,39(4):353-356
5.LeeSJ,KangSW,DoHJ,etal.Enhancementofboneregeneration,bygenedeliveryofBMP2/Runx2bicistronicvectorintoadipose[1]derivedstromalcells[J].Biomaterials,2010,31(21):5652-5659
6.LiY,JinD,XieW,etal.PPAR-γandWntRegulatethe DifferentiationofMSCsintoAdipocytesandOsteoblastsRespectively
[J].Currentstemcellresearch&therapy,2018,13(3):185-192
关于晶莱
关注公众号,了解更多!