
时间:2020-12-25浏览次数:3353
脊髓损伤模型种类繁多,各有其优缺点,在应用时应根据具体实验研究目的和条件作出科学的选择。目前,国内脊髓损伤实验研究最常选用的动物是大白鼠、兔、猫、犬。体型较大的动物在实际的实验操作中存在如下不利因素:手术操作步骤相对复杂,切口容易感染,容易死于术后的脊髓损伤并发症,一定程度影响了实验结果。大鼠作为一种价格便宜、容易饲养的动物,作为制作脊髓损伤模型还有如下特点:再现性好;临床相关性好;与人类高度同源性;重复性强;适应范围广;操作简单;死亡率低等。
大鼠脊髓损伤(全断)动物模型的建立:
使用眼科剪直接剪断大鼠胸椎T10处脊髓的方法建立大鼠脊髓损伤模型,实验动物术前6h禁食;
实验器材:
弯镊1把、中号手术剪1把、眼科剪1把、止血钳1把、自制辅助弯钩、4-0缝线、缝合针、医用碘伏、干棉球、棉签、青霉素钠等。
造模过程:
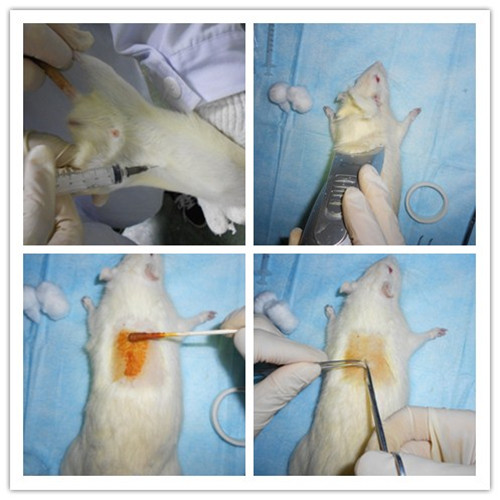
大鼠称重,采用7%水合氯醛(0.5ml/100g)腹腔注射麻醉动物,电动剃毛器剃背部毛发,取动物俯卧位固定于手术板上,医用碘伏消毒手术区皮肤。大鼠胸椎T10节段定位:触及大鼠背部,找到胸椎最高点,往上数3个棘突对应的椎体位置即为胸椎T10节段;
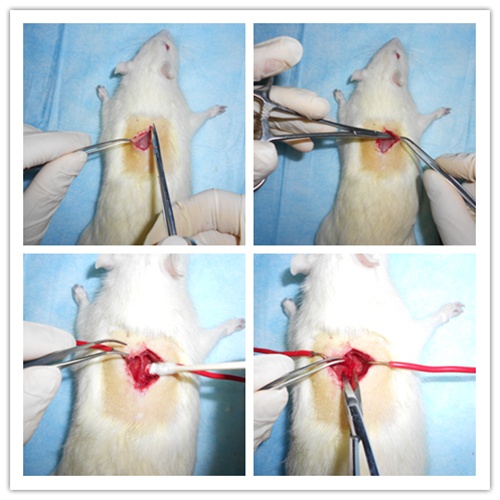
在T9~11节段对应背部行正中直切口,止血钳钝性分离开口皮肤与肌肉层之间的黏膜。辅助固定钩拉开两侧皮肤,充分暴露手术区肌肉视野,眼科剪于中线(棘突边缘)两侧肌肉行直切口。如果有少量出血,使用棉签清洁手术区,眼科剪剪掉T9~11节段区域棘突及其他少量多余肌肉组织,充分暴露T9~11节段椎板。
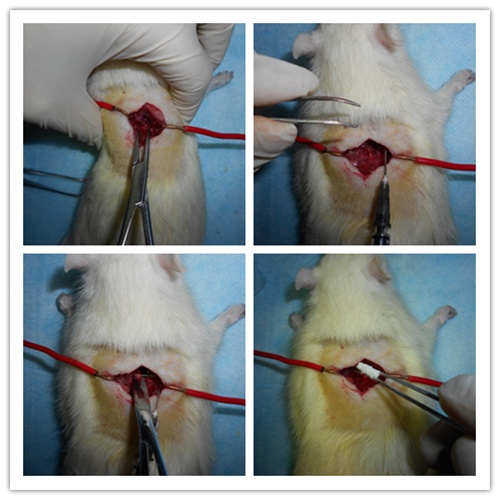
左手握住大鼠腋下两侧固定大鼠并使其脊柱稍往上提,右手持止血钳咬除T10节段椎板,暴露T10节段脊髓。使用自制辅助弯钩(1ml注射器制作)伸入暴露的T10节段脊髓下方,稍向上挑起脊髓。使用眼科剪完全剪断挑起的T10节段脊髓,但要小心操作,不要伤到其他组织,伤口处洒少量青霉素钠消炎。
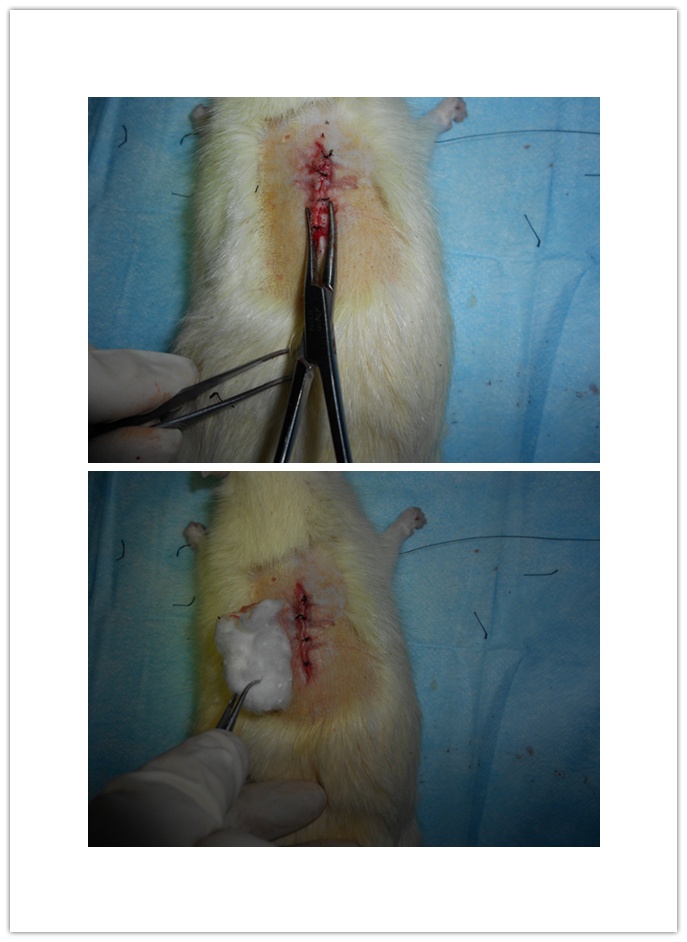
缝合内层肌肉和创口皮肤(逐层缝合),止血钳夹闭缝合处皮肤,酒精棉球,干棉球擦净创口周围血迹并消毒,将大鼠俯卧位放回笼中,正常饮食饲养。
术后护理:
模型构建成功后,大鼠出现后肢功能障碍且不能自主排尿,所以后期每天需要人工辅助其排尿,并使用75%酒精喷洒消毒,此护理过程需要花费大量时间。术后第二天,如果伤口愈合情况良好,可以对模型大鼠进行人工辅助排尿。
操作方法:
实验人员双手戴上棉布厚手套,左手以麻醉大鼠的手法抓取固定大鼠(但是需注意不要过度用力,以免挤压到背部伤口或大鼠胸腔),右手手掌托住大鼠腹背部,右手食指摸索找到膀胱,适当用力挤压膀胱,尿液就会从尿道流出。术后需每天排尿一次,并使用75%酒精在尿道附近喷洒消毒,卫生纸擦拭干净尿道周围污渍。如果护理情况良好,一般术后一周,大鼠会恢复自主排尿功能。前期护理过程中,大鼠可能会尿血,属正常现象。
上一篇:帕金森疾病
下一篇:Rat心肌缺血再灌注模型