医学文献讲解:“用项目管理思维看文献”之《Selene治疗恶性腹水的研究思路剖析》
时间:2021-10-18 阅读:2255香菇多糖功能化硒纳米颗粒通过TLR4/TRAF3/MFN I途径靶向肿瘤细胞线粒体

期刊:Theranostics
影响因子:8.579
发表时间:2020
恶性腹水是大肠癌、卵巢癌等恶性肿瘤进展过程中的临床并发症,严重影响患者生存质量和预后、平均生存时间短,其治疗一直是临床难题。恶性腹水目前尚无有效的治疗方法。
香菇多糖(LNT)是从香菇中提取的一种特殊类型的β -葡聚糖,具有广泛的生物和生理活性。在我国临床上应用LNT治疗恶性腹水,安全性高,但效率低。
硒(Se)由于其优异的生物活性和低毒性,在癌症治疗中具有潜在的应用前景。此外,硒纳米颗粒(SeNPs)的生物相容性和有效性优于无机和有机硒化合物。然而,SeNPs在恶性腹水中的作用尚未见报道。
虽然SeNPs可以影响线粒体功能,但纳米粒子主要在溶酶体中降解,可能导致细胞焦亡和坏死,由焦亡和坏死引起的炎性细胞因子可能会降低腹水治疗的疗效。
至此,开发一种能够选择性进入线粒体并从溶酶体中逃逸的新型功能化SeNPs是治疗恶性腹水的重要策略。本文研究评估香菇多糖(LNT)功能化硒纳米颗粒(Selene)对恶性腹水的影响。进一步探讨了Selene对肿瘤细胞线粒体的靶向作用机制。
研究框架分析
一、香菇多糖(LNT)功能化硒纳米颗粒(Selene) 制备与表征
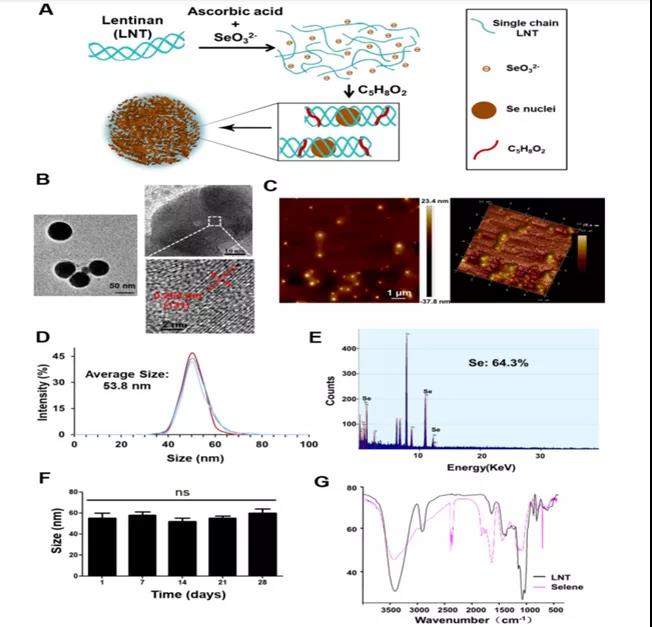
A.香菇功能化硒纳米颗粒(Selene)的合成过程。
B-C. Selene的TEM、AFM图像:分散球形颗粒。
D. Selene的粒度分析:粒径为53.8nm。
E. Selene的EDX检测:NPs主要组成是Se。
F. Selene在生理盐水(0.9% NaCl)中室温稳定性检测:28天。
G. Selene的FTIR光谱:NPs制备交联成功 。
小结:获得了大小及分散均匀、稳定性良好的球形纳米颗粒- Selene。
二、体内腹水模型构建
EAC、OVCAR-3诱导腹水模型,评价Selene对恶性腹水的作用。
01
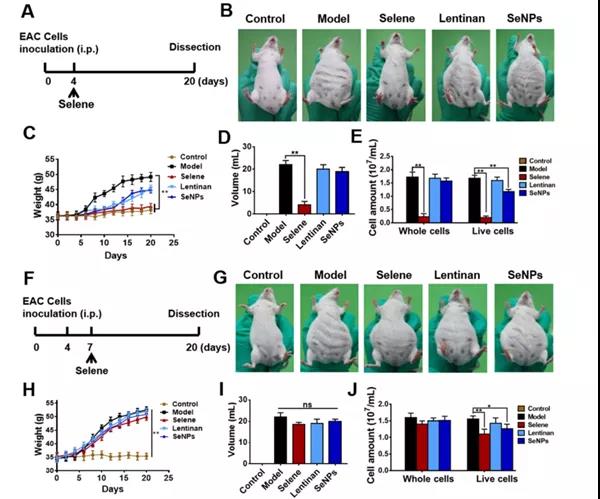
A.模型建立及给药示意图:当小鼠开始出现腹水时,从建模后的第4天开始用Selene、香菇多糖或SeNPs治疗小鼠。
B.各组小鼠的分组与代表性图像。
C-E .各组体重、腹水体积、腹水中癌细胞数。
小结:Selene、SeNPs对腹水进行有效抑制。
F.模型建立及给药示意图。造模后第7天开始给予Selene治疗,出现大量腹水。
G.不同组小鼠的分组与代表性图像。
H-J.各组体重、腹水体积及腹水中癌细胞数量的变化。
小结: Selene、SeNPs对腹水并无有效抑制。
02
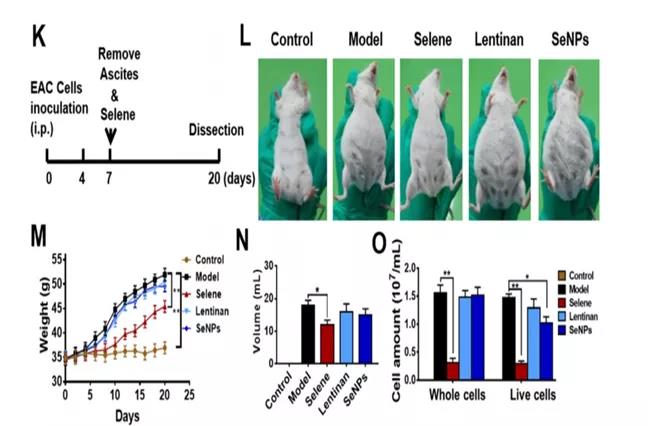
K:模型建立及给药示意图;造模后第7天移除小鼠腹水后给予Selene治疗。
L:各组小鼠的分组与代表性图像。
M-O:各组体重、腹水体积、腹水中癌细胞数量的变化。
小结:
-Selene对EAC诱导的腹水有抑制作用。
-给药最佳时间因应为腹水首次出现时(当出现大量腹水时,应在给药前移除腹水)。
03
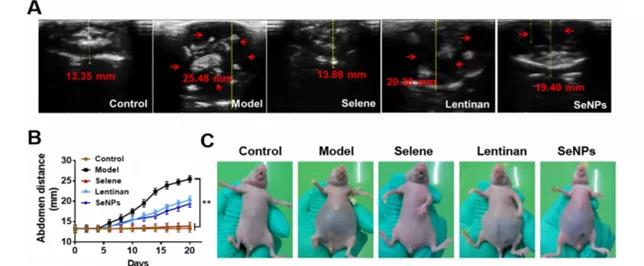
A、B:B超检测OVCAR-3诱导腹水体积变化:Selene处理组对腹水进行有效抑制(最显著)。
C: 不同组小鼠的分组与代表性图像。
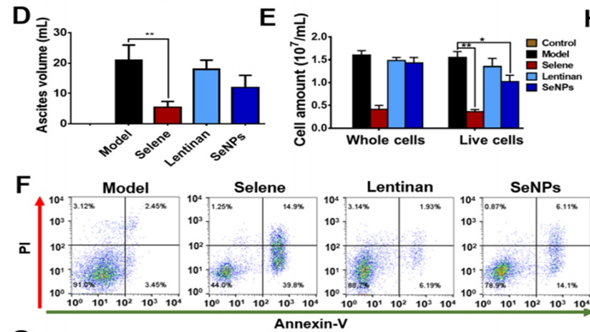
D、E: 腹水体积及腹水中癌细胞数量:Selene处理组对腹水进行有效抑制。
F:腹水中癌细胞流式细胞凋亡检测结果:Selene处理组细胞凋亡水平最高。
小结: Selene处理组对腹水具有明显抑制作用
04
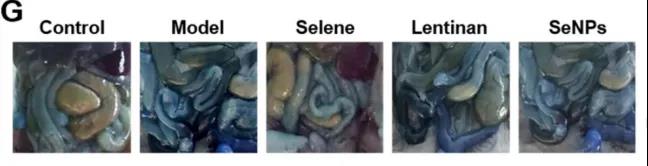


G.肠和腹壁埃文斯蓝染料渗漏的照片(腹腔血管的渗漏):尾静脉注射。
H.离心法前后抽吸腹水照片。
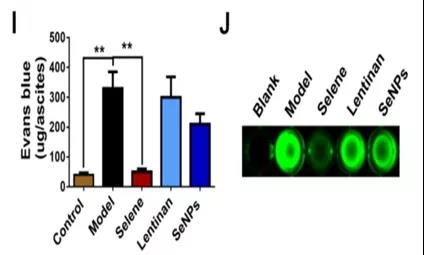
I.各组腹水埃文斯蓝含量比较。
J.每个样本20 mL腹水中Fitc葡聚糖强度的照片尾静脉注射。
K. Selene处理组与模型组细胞因子抗体芯片分析结果。
小结:
-Selene对卵巢癌细胞引起的体内腹水有抑制作用。
-Selene降低了炎症因子的表达。
三、分析Selene在肿瘤细胞中的分布及评价Selene对线粒体功能和细胞凋亡的影响
01
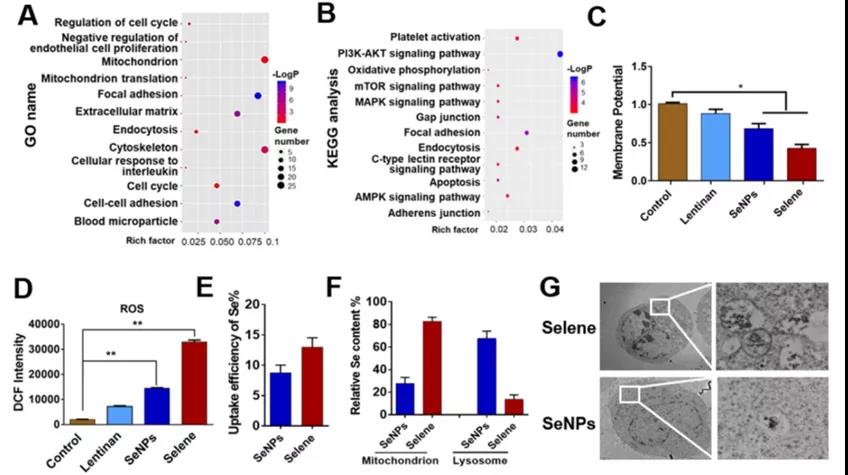
A、B:Selene处理组的蛋白组分析结果与对照组比较。
利用GO和KEGG数据库对差异表达
蛋白进行分析,探讨Selene对腹水抑制的主要功能和影响信号通路。
C、D:Selene处理细胞的线粒体膜电位及ROS检测结果:Selene 、SeNPs 明显变化。
E:Selene和SeNPs在OVCAR-3细胞中的摄取效率:Selene 高于 SeNPs 。
F:OVCAR-3细胞线粒体和溶酶体中相对硒含量。
G:透射电镜检测细胞超薄切片:粒子摄入情况。
小结:
-Selene对内吞、凋亡、线粒体等主要功能和信号通路均有影响
-OVCAR-3细胞摄取Selene多于SeNPs
-线粒体中:Selene多 -溶酶体中: SeNPs多
02
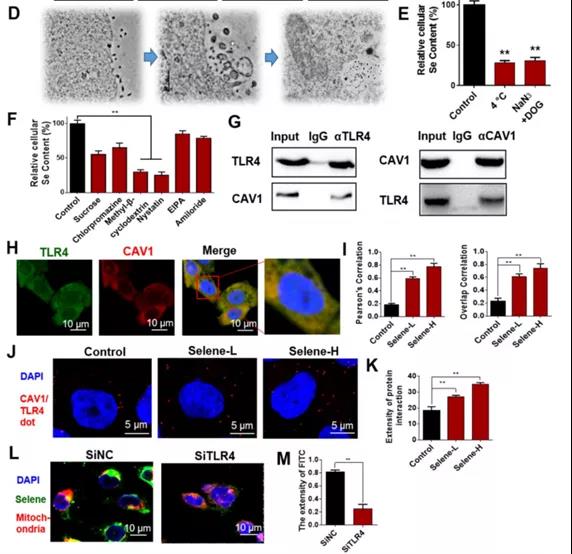
H: Selene/SeNPs与溶酶体的共定位结果。
I: Selene/SeNPs与线粒体的共定位结果。
Selene多位于线粒体、SeNPs多位于溶酶体
J: OVCAR-3细胞的SEM图像:凋亡/焦亡。K: Western blot检测caspase 1和3的表达。
L: Selene和SeNPs处理细胞ATP水平的结果。
M和N: 对Selene和SeNPs处理的细胞Caspase 1和Caspase 3活性的影响。
O: 各组IL-1β含量:SeNPs组高。
小结:
-Selene主要诱导凋亡
-SeNPs主要诱导焦亡
Selene可影响OVCAR-3细胞线粒体功能,诱导细胞凋亡
四、Selene靶向肿瘤细胞的途径
01
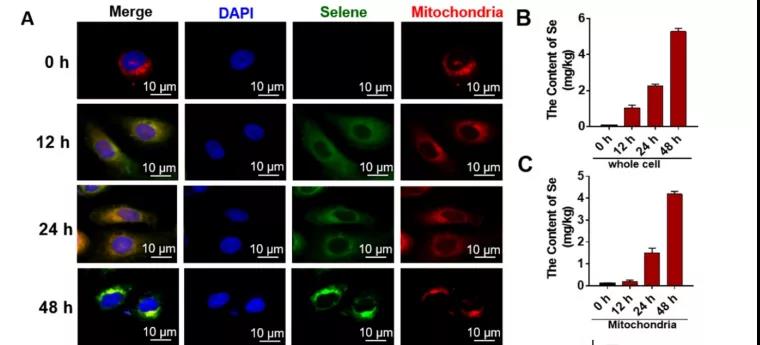
A: 不同时间点细胞中Selene积累的免疫荧光结果;
B、C: 采用ICP - MS检测全细胞
和线粒体中Se含量;
小结:随时间的延长、 Selene积聚越多。
02
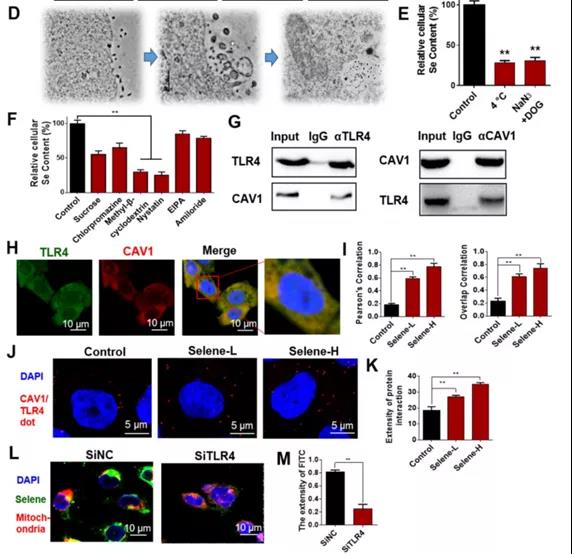
D:透射电镜检测Selene处理的细胞超薄切片结果
-可能通过内吞途径实现靶向
E:低温(4℃)和能量消耗剂(NaN3 +脱氧葡萄糖)处理后细胞硒含量
-Selene通过(能量依赖的)内吞作用进入细胞
F:用网格蛋白介导的内吞抑制剂(蔗糖和氯丙嗪)、小泡介导的内吞抑制剂(MβCD和制霉菌素)和巨胞饮抑制剂(EIPA和阿米洛利)处理的细胞中硒含量
-小泡介导的内吞为主
G:CO-IP检测TLR4和CAV1的共定位
H和I:TLR4和CAV1免疫荧光双标记结果/IF
J和K:Duolink PLA 检测TLR4和CAV1的共定位
L和M:免疫荧光检测Selene siTLR4处理后线粒体的共定位结果明显下降
小结:Selene通过小泡介导的内吞途径靶向线粒体
五、Selene靶向线粒体的作用途径(体内+体外)
01
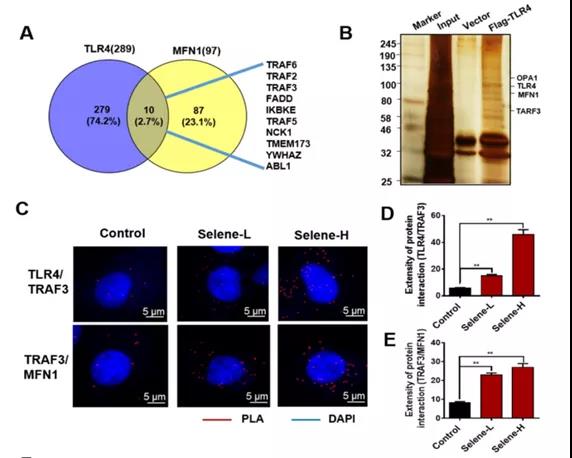
A: FpClass数据库分析TLR4和MFN1之间存在潜在桥联蛋白
B: 通过银染色检测以鉴定与TLR4相互作用的蛋白-TRAF3
C-E: Selene处理后TLR4/TRAF3和TRAF3/MFN1的Duolink PLA的共定位表达
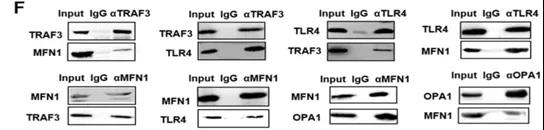
F: CO-IP检测TLR4/TRAF3/MFN1之间具有相互作用
小结:Selene在线粒体中特异性富集,
通过TLR4/TRAF3/MFN1蛋白复合物介导的膜融合。
02
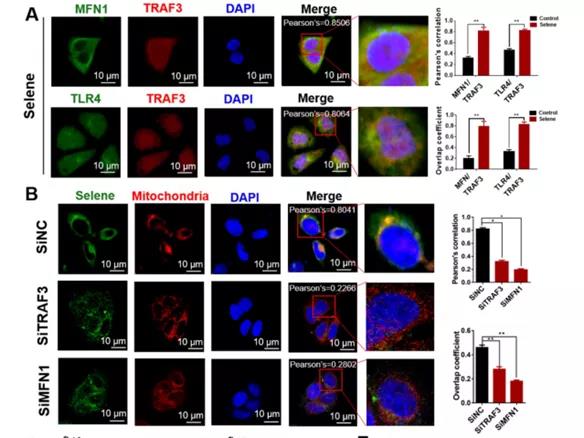

A: 通过OVCAR-3细胞免疫染色分析MFN1/TRAF3和TLR4/TRAF3的共定位。-Selene促进共定位。
B: TRAF3和MFN1敲低后,Selene和线粒体在OVCAR-3细胞中的定位。
-Selene和线粒体在OVCAR-3细胞中的定位水平下降。
C-D: ICP-MS检测TRAF3和MFN1敲除的OVCAR-3细胞中全细胞和线粒体中的硒含量。
-TRAF3和MFN1主要影响了Selene进入线粒体的过程。
小结:
体内实验进一步证明,TLR4与TRAF3敲除后,腹水体积、细胞凋亡水平相较于对照组无明显变化。
Selene通过TLR4/TRAF3/MFN1途径在线粒体中特异性富集。
六、总结
文献总结
●Selene可通过TLR4/TRAF3/MFN1途径靶向肿瘤细胞线粒体,诱导肿瘤细胞凋亡,抑制腹水炎症因子分泌。
●Selene对恶性腹水有较好的治疗效果,可作为临床治疗恶性腹水的药物。
●TLR4/TRAF3/MFN1是纳米粒子的线粒体靶向分子途径,为开发线粒体靶向抗癌纳米药物提供了理论基础。















