国自然热点 “免疫代谢&肿瘤微环境” 研究文献解读之 星形胶质细胞对肿瘤微环境的免疫代谢调节驱动胶质母细胞瘤致病性
时间:2023-09-25 阅读:681Astrocyte immunometabolic regulationof the tumour microenvironment drivesglioblastoma pathogenicity
星形胶质细胞对肿瘤微环境的免疫代谢调节驱动胶质母细胞瘤致病性

期刊:BRAIN
发表时间:2022
影响因子:13.501
研究背景
多形性胶质母细胞瘤(GBM)是脑胶质瘤的一种,是最常见的原发性恶性脑肿瘤,尽管针对GBM的多模态综合治疗(手术、放疗、系统化疗),在近年取得很大进步,但是GBM治疗效果依然很差,其5年总体生存率仅为5.6%。靶向治疗及免疫疗法,是更有效、更容易耐受的治疗GBM的治疗方式。(临床疾病)
肿瘤细胞所在的细胞环境称为肿瘤微环境(TME),由一个复杂的网络组成,肿瘤在复杂的组织依赖环境中发展,生长、转移都受到肿瘤微环境调节。与肿瘤细胞不同,肿瘤微环境中的非肿瘤细胞在遗传上是稳定的,是一个有吸引力的治疗靶点,具有较低的耐药性和肿瘤复发风险。(治疗策略)
星形胶质细胞是中枢神经系统中最丰富的细胞。它们在发育和体内平衡过程中执行基本功能,例如参与维持血脑屏障,存储和分配神经元的能量底物以及支持神经细胞和突触的发育。星形胶质细胞还可以通过多种机制控制中枢神经系统炎症和神经变性,包括神经毒性、小胶质细胞活性的调节、炎症细胞募集到中枢神经系统,甚至通过其代谢级联反应调节。肿瘤相关星形胶质细胞(TAAs)最近被认为参与了原发性和继发性脑肿瘤微环境塑造过程,然而,反应性星形胶质细胞在GBM致病性中的作用知之甚少。(靶点)
文献科学问题
1.星形胶质细胞是否为肿瘤微环境塑造关键因素?
2.反应性星形胶质细胞塑造肿瘤依赖性生长微环境的机制?
3.肿瘤微环境塑造,有哪些细胞参与,改变了细胞什么行为?具体的调控过程,有哪些治疗靶点?
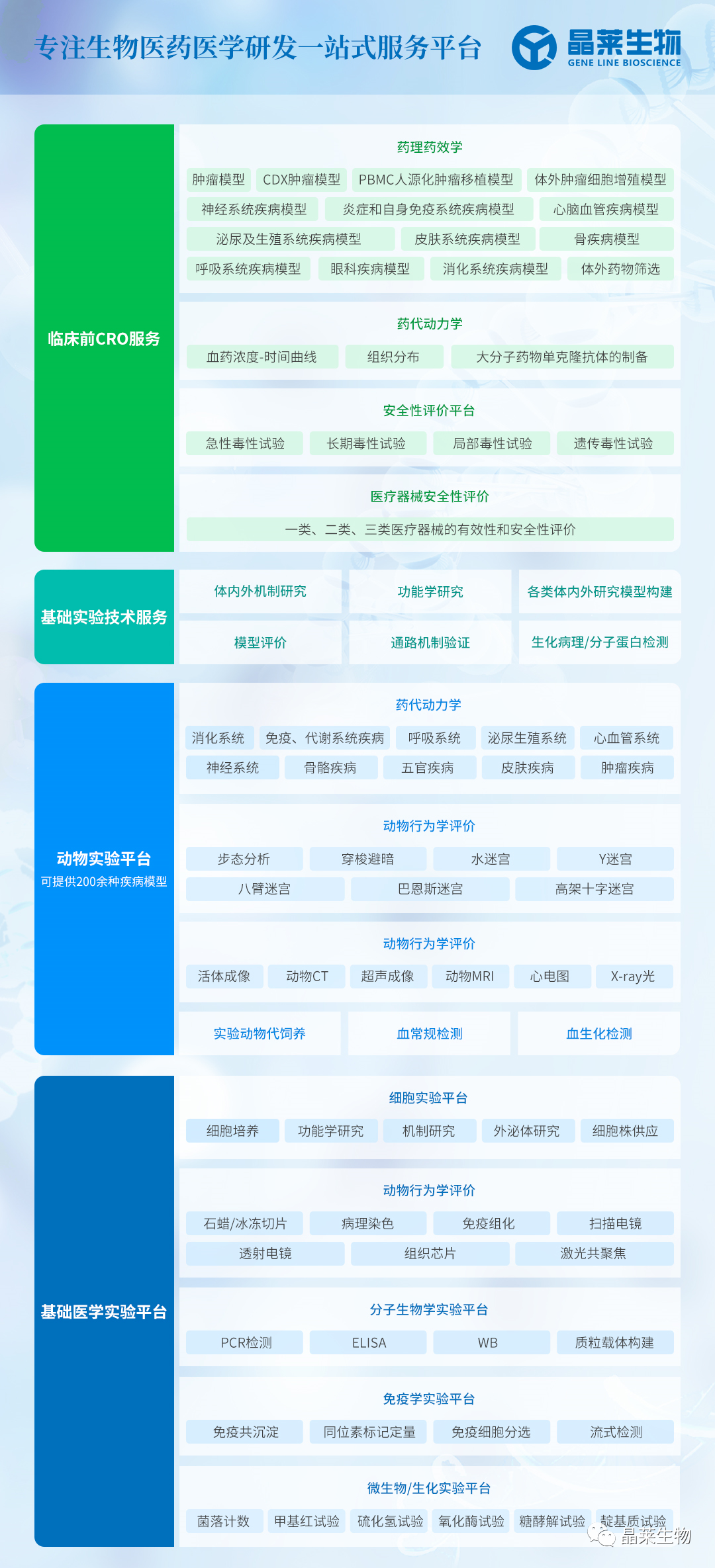
文献框架&研究路线

研究结果及分析
1. 1 小鼠胶质母细胞瘤周围存在大量星形胶质细胞浸润
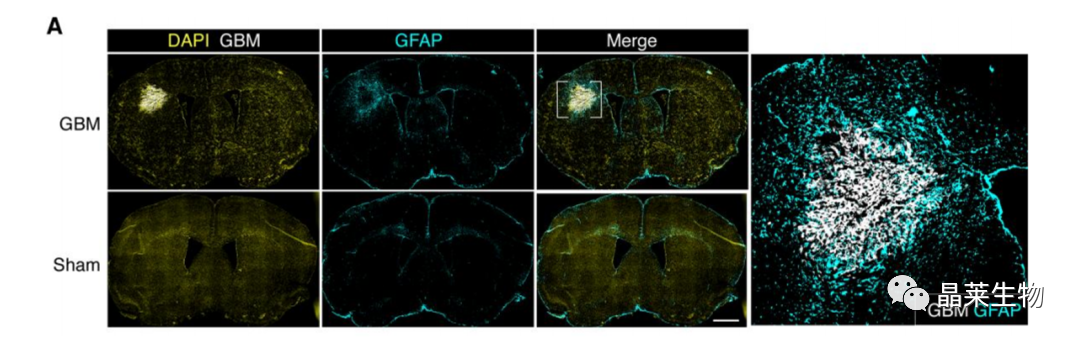
(A)正常小鼠或原位脑胶质瘤小鼠脑组织,星形胶质细胞(GFAP,青色)、脑胶质瘤(GFP-GL261,白色)和细胞核(DAPI,黄色)的代表性免疫荧光图像。
1. 2 体内实验验证星形胶质细胞耗竭后抑制胶质瘤生长
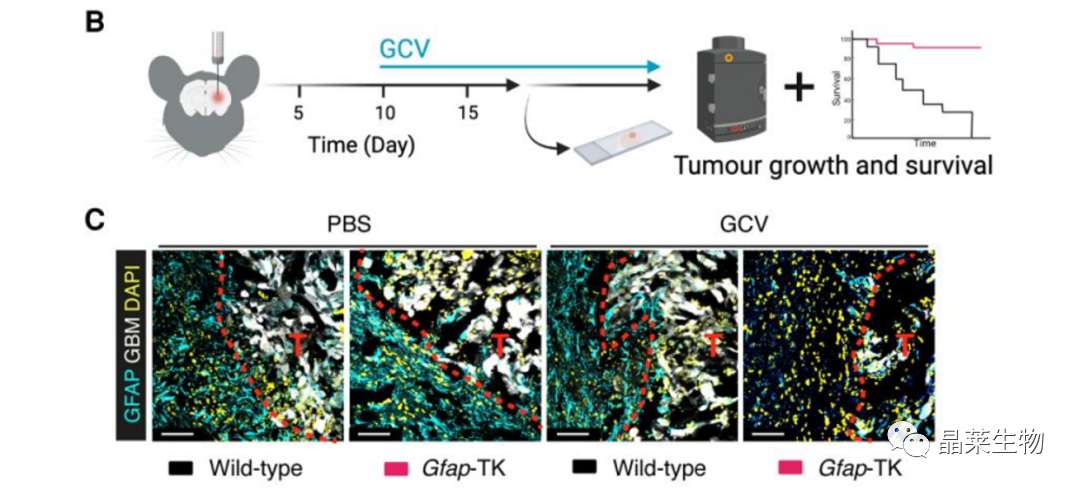
(B–G)野生型(WT)或Gfap-TK小鼠,用GCV处理耗竭星形胶质细胞。
(C)通过GFAP(青色)和细胞核染色(DAPI,黄色)检测肿瘤边缘反应性星形胶质细胞耗竭、胶质母细胞。
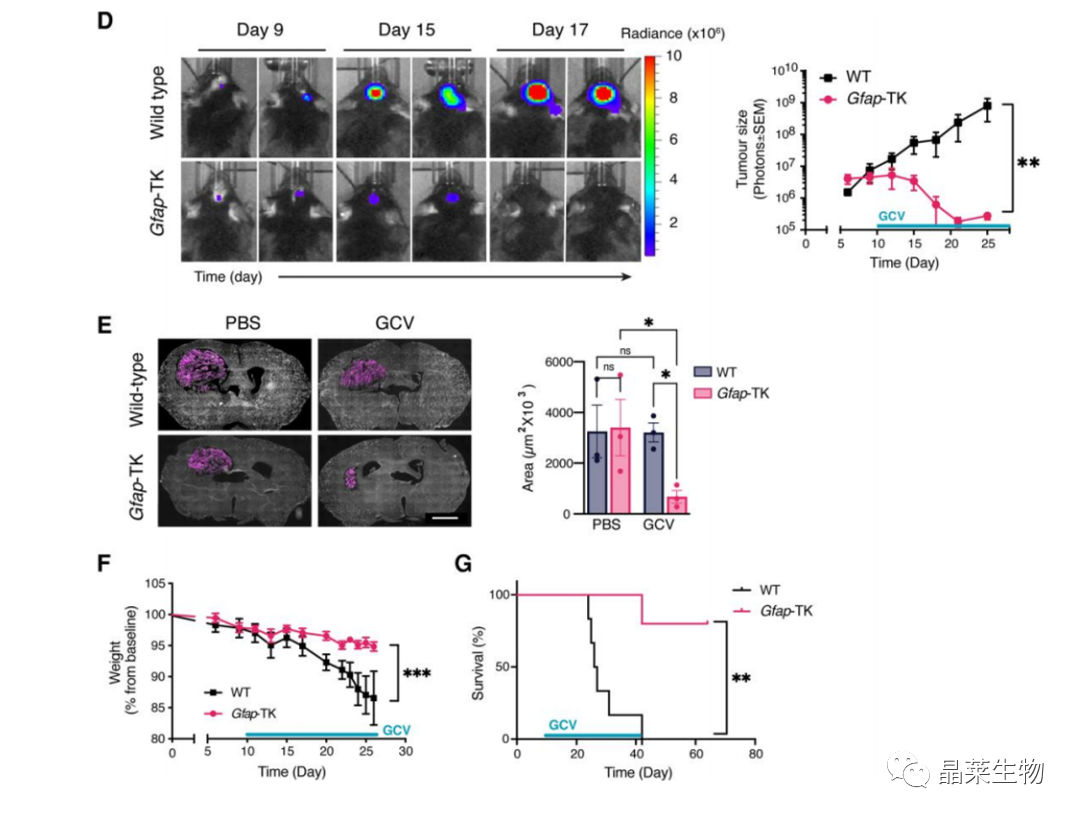
(D)活体成像监测野生型或Gfap-TK星形胶质细胞耗竭小鼠的肿瘤生长情况。
(E)病理检测肿瘤生长情况。
(F)小鼠体重。
(G)生存期。
结论:星形胶质细胞耗竭减缓胶质瘤生长。
2.1 构建RiboTag小鼠,对比野生型小鼠和胶质瘤小鼠来源星形胶质细胞中基因表达差异情况
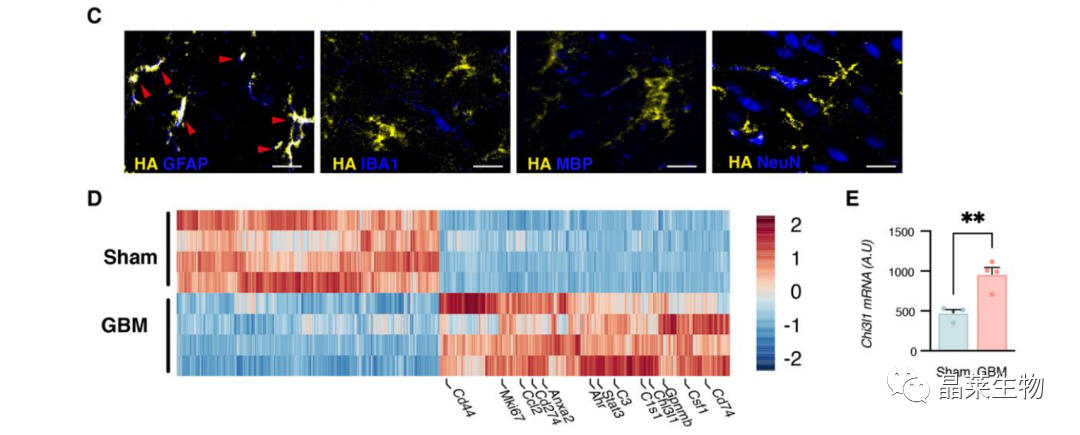
(C)GfapCRE:Rpl22HA小鼠的代表性免疫荧光图像,显示核糖体相关HA标签(黄色)与星形胶质细胞(GFAP),少突胶质细胞(IBA1)或神经元细胞(MBP或NeuN共定位情况。
(D)野生型小鼠和胶质瘤小鼠来源星形胶质细胞中基因表达热图,筛选出3884个表达差异基因。
2.2 测序筛选的差异基因进行qPCR验证
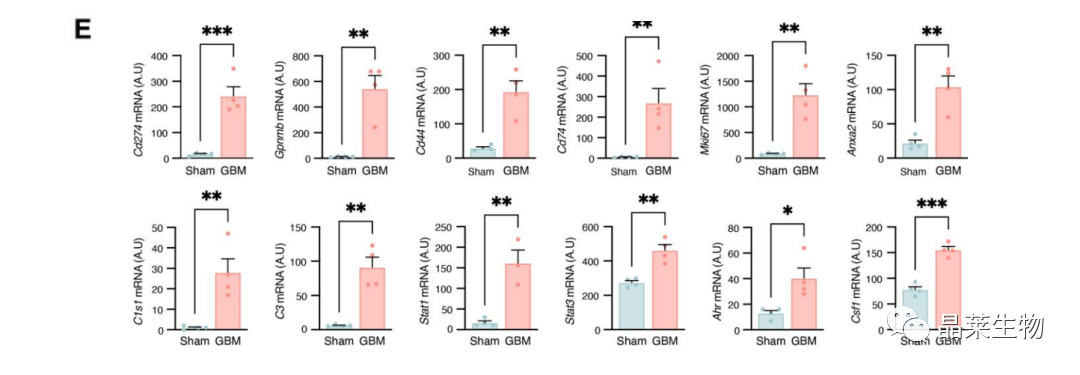
(E)核糖标签分离的星形胶质细胞mRNA样本qPCR检测。
2. 3 星形胶质细胞促癌表型通路主要富集于免疫调节,代谢,增殖相关通路
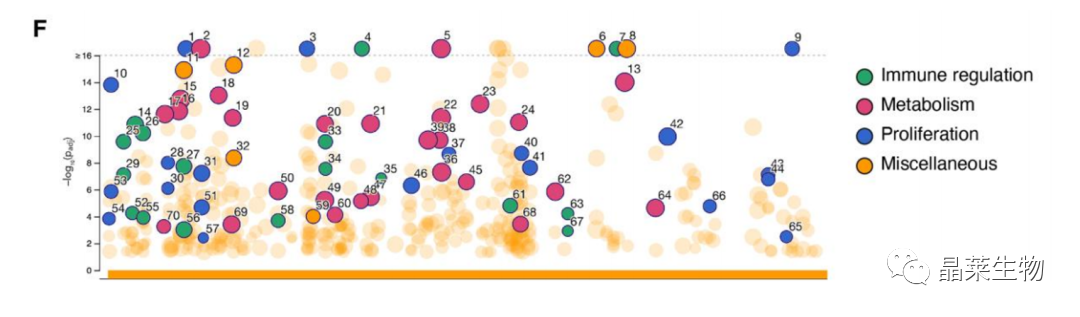
(F)对比野生型小鼠和胶质瘤小鼠来源星形胶质细胞中上调的基因曼哈顿图。
结论:星形胶质细胞促癌表型通路主要富集于免疫调节,代谢,增殖相关通路。
3.1 趋化因子表达情况检测
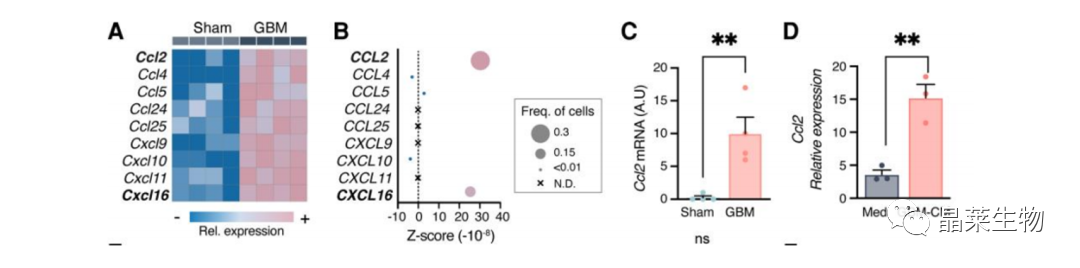
(A)正常或胶质瘤小鼠的星形胶质细胞中不同表达趋化因子。
(B)生信分析GBM患者TAA中趋化因子表达情况。
结论:星形胶质细胞高表达趋化因子,预示星形胶质细胞可募集各类型细胞浸润。
3.2. 星形胶质细胞促进小胶质细胞迁移
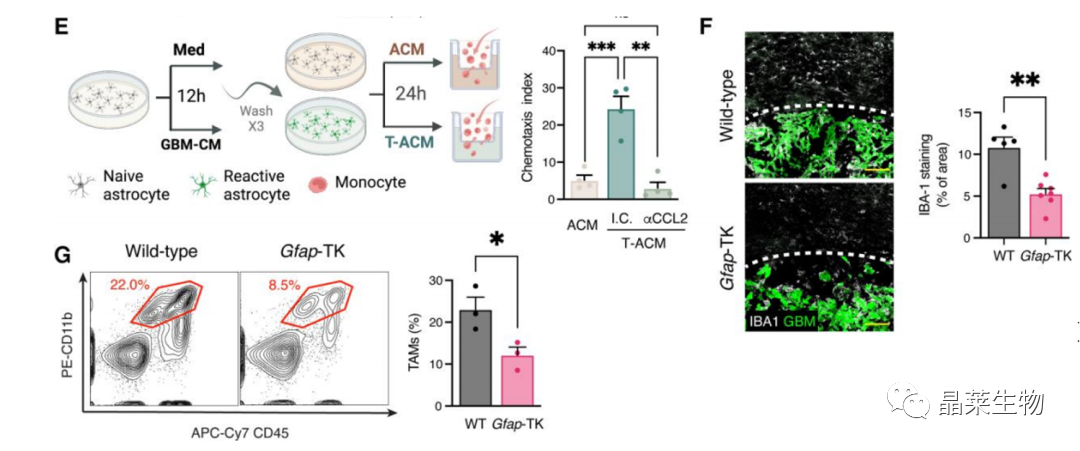
(E、G)用完全培养基或GBM-CM刺激星形胶质细胞2小时,酶处理消化胶质瘤细胞,与单核细胞共培养,检测单核细胞迁移率。
(F)正常小鼠或Gfap-TK星形胶质细胞耗竭小鼠,小胶质细胞(IBA-1)定位。
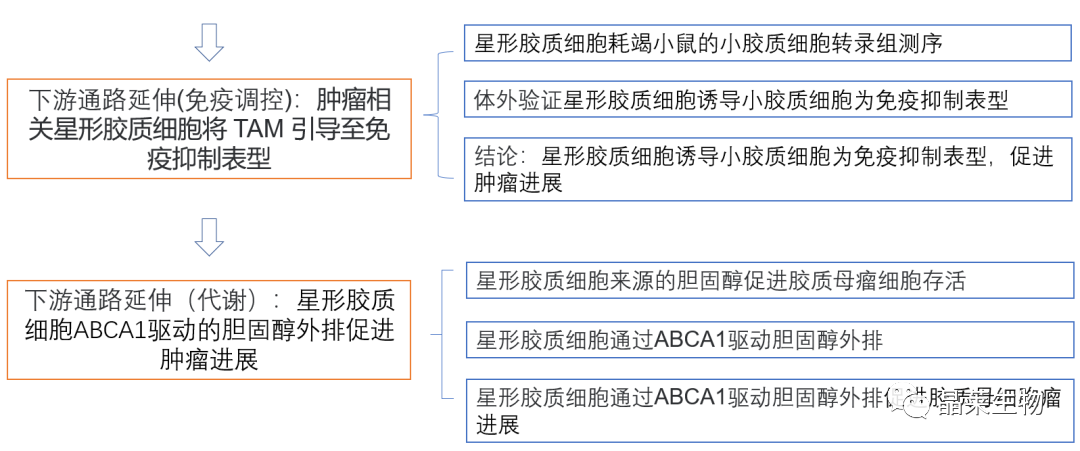
4.1 肿瘤相关巨噬细胞转录组测序
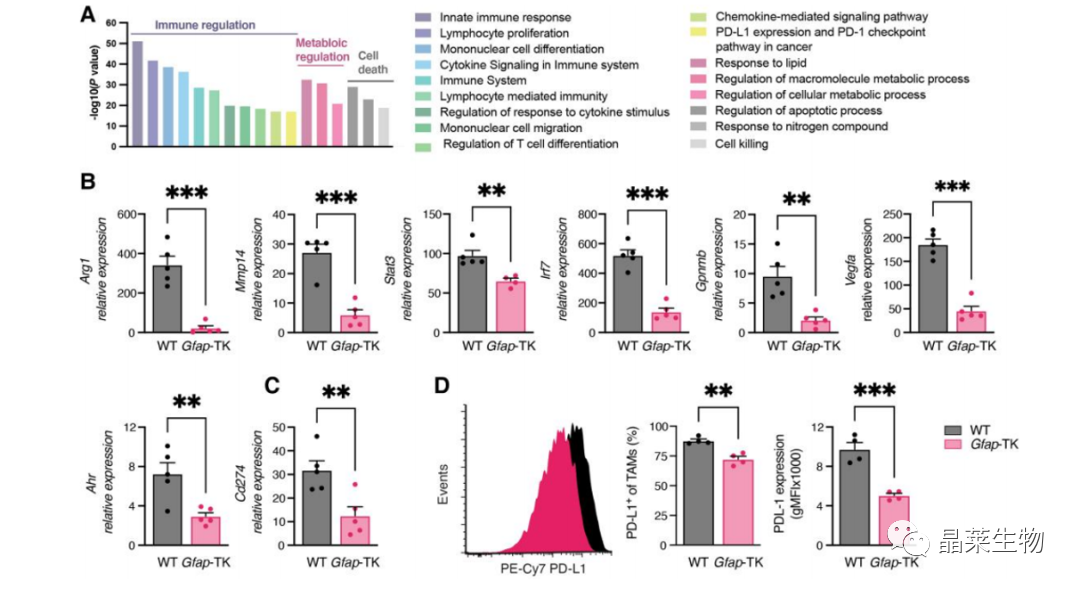
(A,D)从正常小鼠、Gfap-TK星形胶质细胞耗竭小鼠中分离小胶质细胞转录组测序,星形胶质细胞耗竭后,免疫抑制相关通路表达下调,证明肿瘤相关星形胶质细胞发挥了诱导小胶质细胞为免疫抑制表型作用。
4.2 体外验证星形胶质细胞诱导小胶质细胞为免疫抑制表型
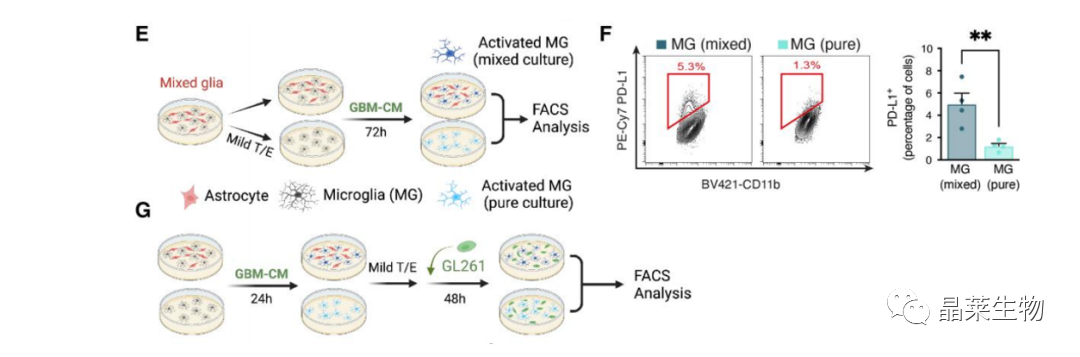
(E、G)胰蛋白酶/ EDTA处理消化星形胶质细胞,仅留下附着在板上的小胶质细胞,用GL261条件培养基(GBM-CM)处理培养物72小时。
(F)流式检测高表达PD-L1小胶质细胞百分比。
5. 1 星形胶质细胞来源的胆固醇促进胶质母瘤细胞糖酵解
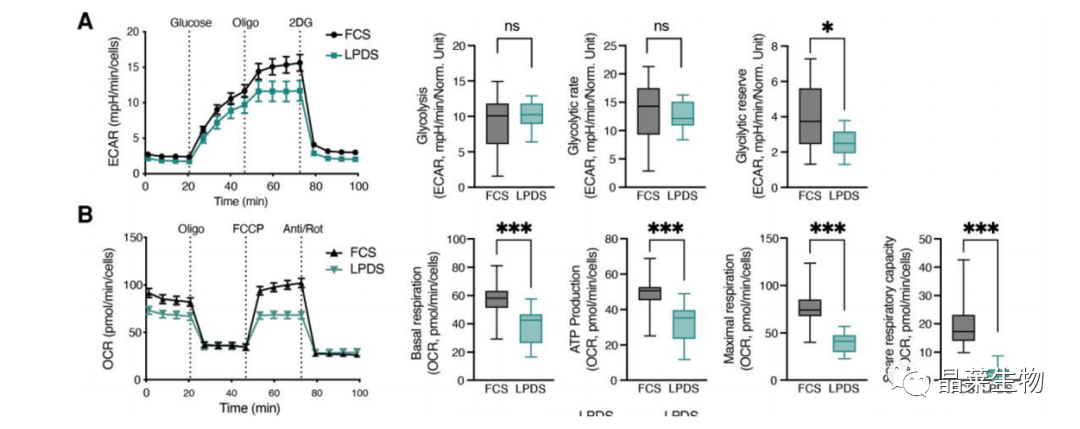
(A、B)全血清(FCS)或脂蛋白剥夺血清(LPDS)干预GL261胶质瘤细胞的ECAR和OCR的实时变化对比,从ECAR读数中提取糖酵解、糖酵解能力和糖酵解储备,在OCR的基础上测定基础呼吸、ATP产生、最大呼吸和备用呼吸能力。
5. 2 星形胶质细胞来源的胆固醇支持胶质瘤存活
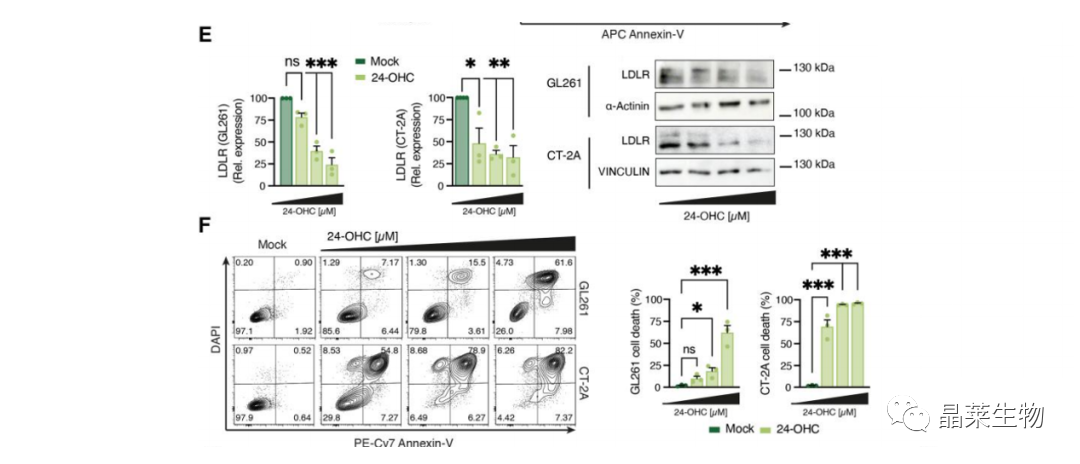
(E 和 F) 内源性 LXR 激动剂(2-OHC)处理内耗内源性胆固醇,检测胆固醇受体LDLR 表达,细胞死亡率。
6.1 星形胶质细胞ABCA1驱动的胆固醇外排促进肿瘤进展
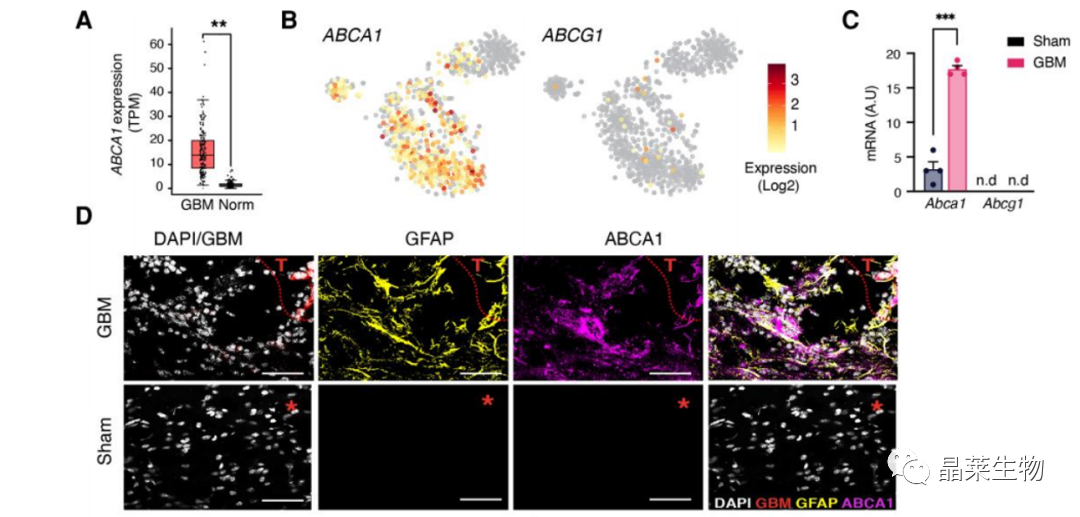
(A-B)TCGA数据生信分析,ABCA1胆固醇转运基因在GBM患者的CNS中高表达。
(B)ABCA1在小鼠GBM肿瘤表达,不表达ABCG1。
(C)Abca1表达的qPCR分析,如图2所示。
(D)正常或胶质瘤小鼠的ABCA1免疫荧光代表性图像。
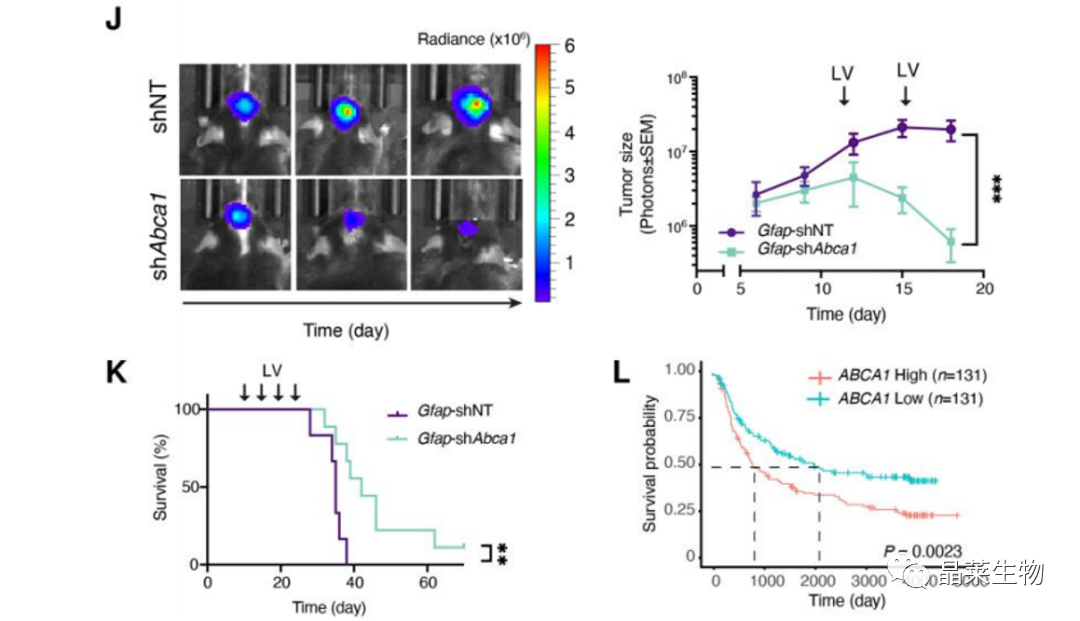
(J)正常小鼠,注射sh-ABCA1病毒GL261胶质瘤小鼠活体成像图像,右侧显示了肿瘤大小的定量。
(K)Kaplan-Meier生存曲线评估各组小鼠的总生存率。
文献结论
反应性星形胶质细胞的消耗能使小鼠的多形性胶质母细胞瘤进展消退并延长动物存活期。星形胶质细胞通过CCL2调节肿瘤相关巨噬细胞(TAM)向TME募集,并通过促进TAM中的促肿瘤表型(部分通过CSF1的释放)来支持肿瘤。
星形胶质细胞衍生的胆固醇促进神经胶质瘤细胞生存,因此,靶向TAA的胆固醇外排会抑制肿瘤生长。
文献总结
创新点:
1. 揭示了星形胶质细胞控制多形性胶质母细胞瘤(GBM)致病性的机制,星形胶质细胞通过CCL2调节肿瘤相关巨噬细胞(TAM)向肿瘤微环境(TME)募集,并通过ABCA1驱动的胆固醇外排促进胶质母细胞细胞存活促进肿瘤进展。
2. 发现了多个候选治疗靶点,在小鼠体内验证了星形胶质细胞自杀疗法,靶向抑制TAA的胆固醇外排,能抑制多形性胶质母细胞瘤进展,为胶质母细胞瘤治疗提供了新的治疗思路。
文献涉及的实验技术
参考文献:
Astrocyte immunometabolic regulation of the tumour microenvironment drives glioblastoma pathogenicity
Rita Perelroizen, Bar Philosof, Noga Budick-Harmelin, Tom Chernobylsky, Ariel Ron, Rotem Katzir, Dor Shimon, Adi Tessler, Orit Adir, Anat Gaoni-Yogev ... Show more
Brain,Volume145,Issue9,September2022,Pages3288–3307, https://doi.org/10.1093/brain/awac222
关于晶莱
关注公众号,了解更多!