【五分钟讲文献】国自然热点 “miRNA & lncRNA ” 之NUCKS1通过上调天冬氨酸的合成,促进了骨肉瘤的发展与转移
时间:2023-08-21 阅读:991NUCKS1, a LINC00629-upregulated gene, facilitated osteosarcoma progression and metastasis by elevating asparagine synthesis
NUCKS1通过上调天冬氨酸的合成,促进了骨肉瘤的发展与转移

期刊:Cell Death and Disease
发表时间:2023年7月17日
影响因子:9.0
研究背景
骨肉瘤(OS)是最常见的恶性骨肿瘤,主要影响年轻,成长的青少年。然而,在50岁或以上患有佩吉特病的人中,它也有第二个发病率高峰。局限性骨肉瘤因手术和多药化疗肉瘤患者的5年相对生存率为60-70%。然而,在转移发生后,5年生存率下降到20%以下。因此,揭示骨肉瘤转移的机制和识别新的靶点对骨肉瘤的治疗至关重要。
NUCKS1位于人类染色体1q32.1上,属于高迁移率族蛋白,存在于各种脊椎动物细胞类型和组织中。NUCKS1是细胞周期蛋白依赖性激酶、酪蛋白激酶2(CDK2)、DNA损伤反应(DDR)激酶ATM和DNA活化蛋白激酶(DNA-PK)的磷酸化底物。据报道,NUCKS1在许多癌症中发挥着致癌作用,包括宫颈鳞状细胞癌、乳腺癌、肺癌、结肠直肠癌、胃癌和肝细胞癌。然而,其在骨肉瘤中的作用和调节机制尚不清楚。
天冬氨酸合成酶(ASNS)催化天冬氨酸和谷氨酰胺转化为天冬酰胺和谷氨酸。临床上,ASNS功能障碍与儿童急性淋巴细胞白血病(ALL)和天冬酰胺合成酶缺乏症(ASD)相关。ASNS和天冬酰胺对许多实体肿瘤也至关重要。例如,ASNS通过调节β-连环蛋白的稳定性来增加并促进细胞转移。强制表达ASNS可降低营养应激下肺癌细胞凋亡和细胞周期阻滞。下调ASNS基因抑制了乳腺癌和胃癌细胞的细胞增殖。在结直肠癌中,SOX12通过上调ASNS表达来促进细胞增殖和转移。虽然有报道称ASNS对几种肿瘤的进展至关重要,但其在骨肉瘤中的作用和潜在机制仍不清楚。
技术路线
研究结果及分析
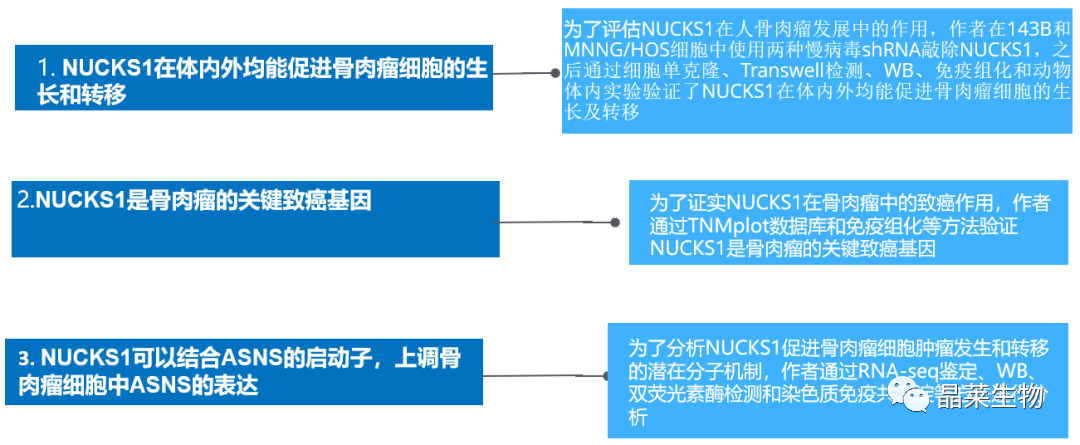
1. NUCKS1在体内外均能促进骨肉瘤细胞的生长和转移
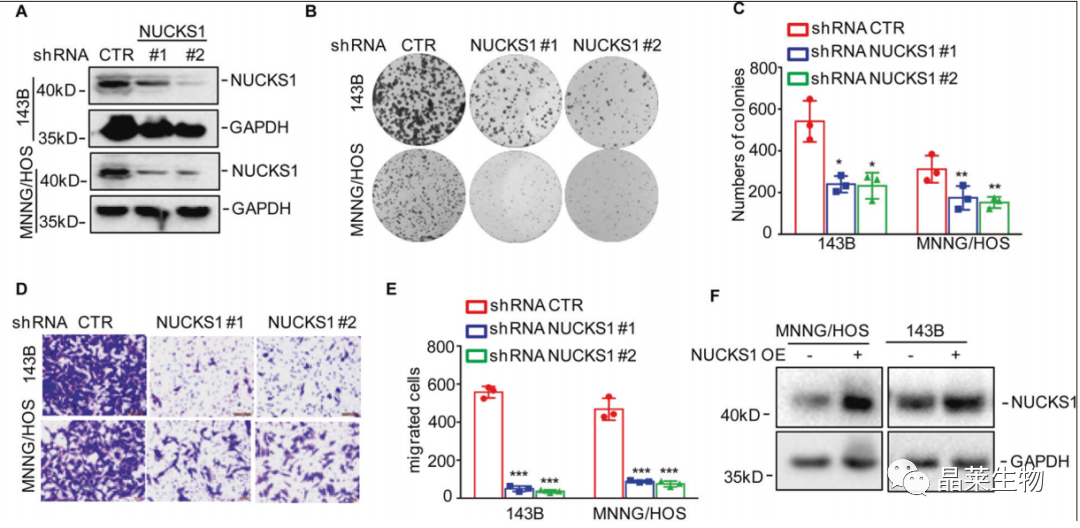
A. 通过WB检测结果显示:与对照组相比,shRNA组中NUCKS1的表达量明显降低;
B和C. 通过细胞集落形成实验,与对照组相比,抑制NUCKS1的表达显著减少了菌落的数量;
D和E. 通过Transwell检测,nucks1缺失细胞的迁移程度明显低于对照组细胞;
F.通过WB检测验证过表达NUCKS1。
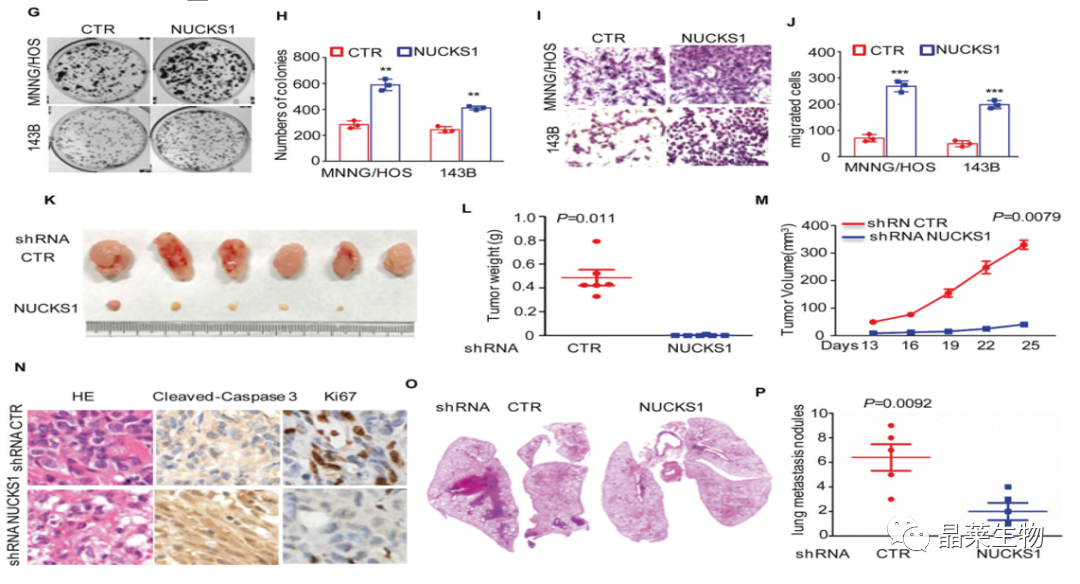
G-J. 通过细胞集落形成实验和免疫组化结果表明NUCKS1表达的升高促进了细胞的增殖和迁移;
K-M. 通过动物实验结果表明NUCKS1基因敲除的143B细胞显著抑制了肿瘤的形成;
N. 通过免疫组化结果表明NUCKS1基因的下调降低了ki-67阳性细胞的百分比,增加了caspase3阳性细胞的比例;
O和P.通过动物实验和HE染色结果表明敲除NUCKS1的细胞转移病变数量显著减少。
NUCKS1在143B和MNNG / HOS细胞中被敲倒。通过蛋白质印迹法检测NUCKS1的表达水平。
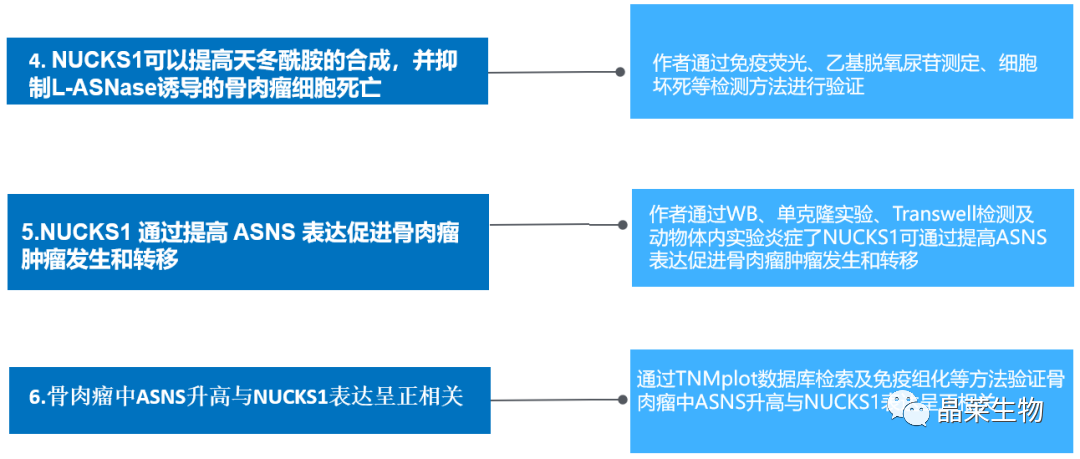
2.NUCKS1是骨肉瘤的关键致癌基因
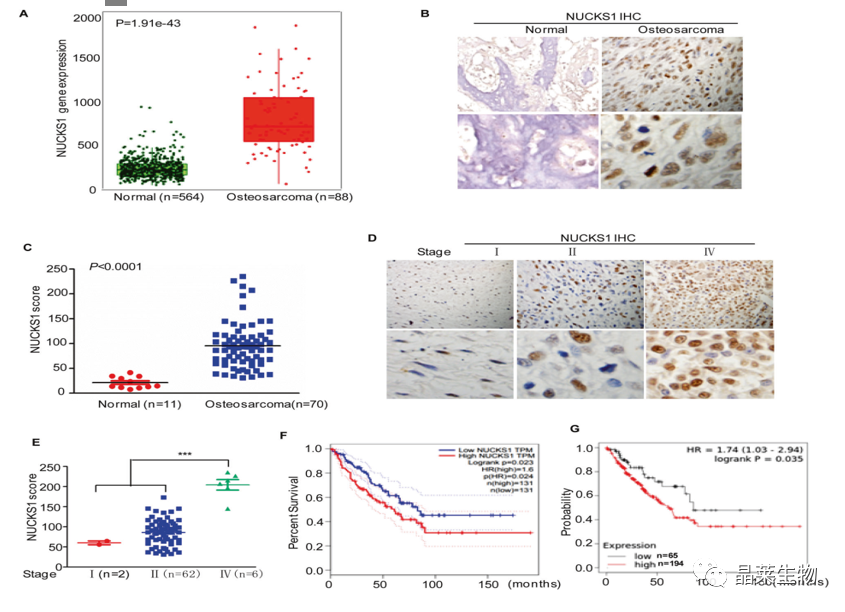
A. 在TNMplot数据库中,与正常组织相比,骨肉瘤中NUCKS1的表达明显增加;
B和C. 通过免疫组化检测结果表明骨肉瘤组织中NUCKS1的表达量高于正常骨组织;
D和E. 通过免疫组化结果显示,NUCKS1的表达与骨肉瘤的分期呈正相关;
F和G. 通过数据库分析,NUCKS1表达水平高的骨肉瘤患者生存率低于NUCKS1水平较低的患者。
这些数据强烈表明NUCKS1是骨肉瘤的关键癌基因。
3. NUCKS1可以结合ASNS的启动子,上调骨肉瘤细胞中ASNS的表达
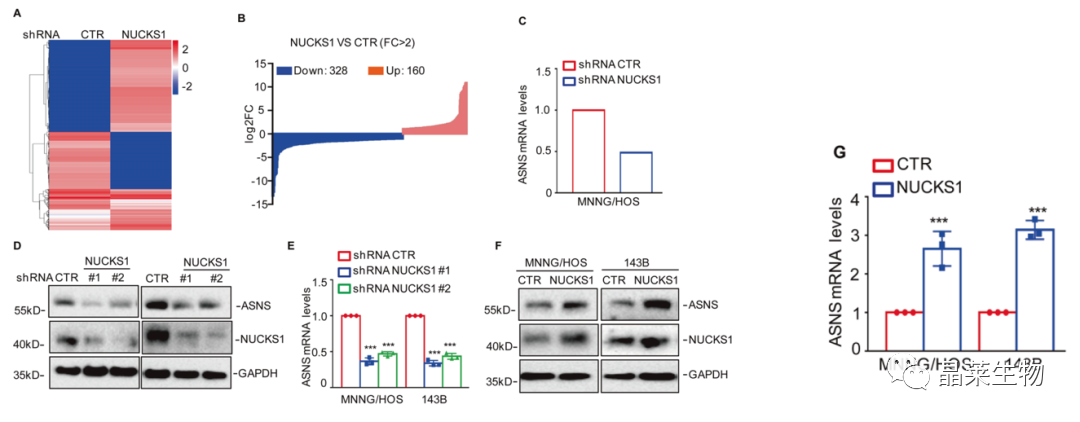
A和B. 通过RNA-seq鉴定了NUCKS1的下游基因,共获得328个下调基因和160个上调基因;
C. 在这些基因中,发现ASNS在NUCKS1缺失的细胞中被下调;
D和E.结果表明NUCKS1的缺失显著下调了ASNS的mRNA和蛋白水平;
F和G. 过表达NUCKS1促进了ASNS的表达。
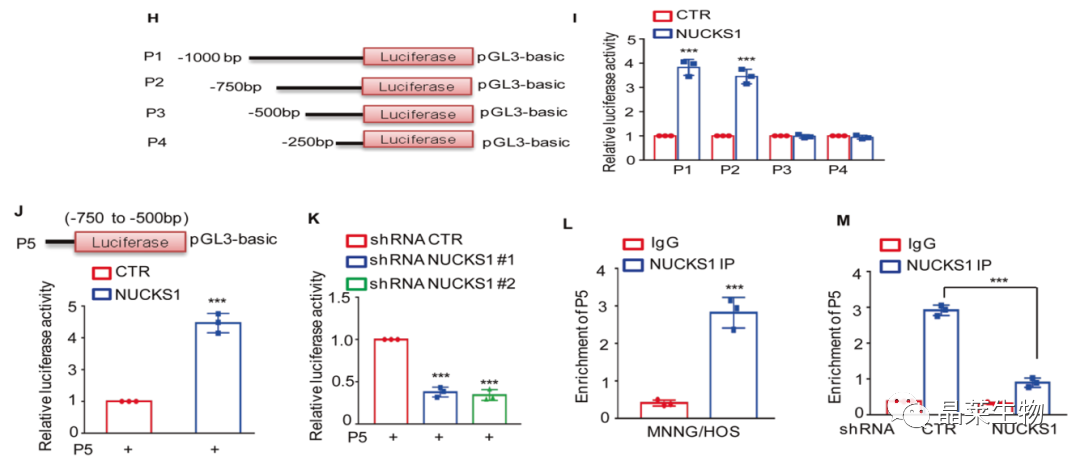
H. 在ASNS上游序列和不同截断插入基于PG13的荧光素酶报告质粒(命名 P1 P2 P3 P4);
I. 通过测定结果显示过表达NUCKS1提高了P1和P2的荧光素酶活性,表明该区域是NUCKS1上调ASNS表达的必要区域;
J.克隆该区域(-750~-500bp),并插入荧光素酶报告质粒中,再转染到过表达和正常表达NUCKS1的MNNG/HOS细胞中,结果表明过表达NUCKS1提高了P5的荧光素酶活性;
K. NUCKS1的缺失降低了P5的荧光素酶活性;
L和M.通过染色质免疫共沉淀(ChIP)检测显示,含有p5的染色质片段在抗NUCKS1免疫共沉淀中特别富集,并且在NUCKS1缺失的MNNG/HOS细胞中,NUCKS1与ASNS启动子的结合能力降低。
综上所述,这些发现表明NUCKS1可以结合ASNS的启动子并上调骨肉瘤细胞中的ASNS表达。
4. NUCKS1可以提高天冬酰胺的合成,并抑制L-ASNase诱导的骨肉瘤细胞死亡
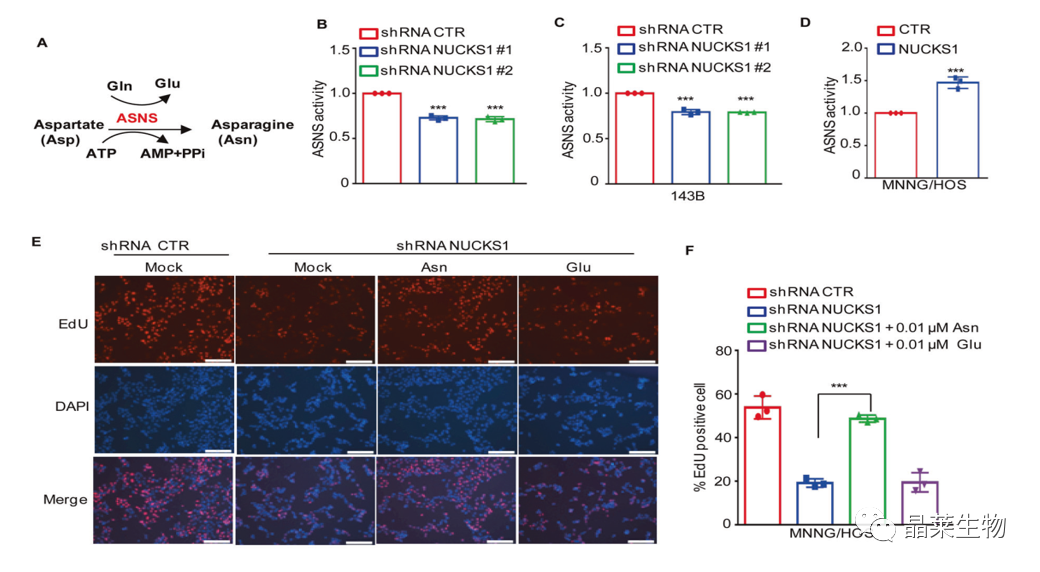
A. ASNS是一种在天冬氨p依赖反应中催化天冬氨酸(Asp)和谷氨酰胺(Gln)合成天冬酰胺(Asn)和谷氨酸(Glu)的关键酶。
B和C. 敲除NUCKS1降低了ASNS的活性
D. 过表达NUCKS1提高了ASNS的活性
E和F. 用EdU染色法检测其增殖能力,表明NUCKS1以一种依赖于天冬酰胺合成的方式促进骨肉瘤细胞的生长。
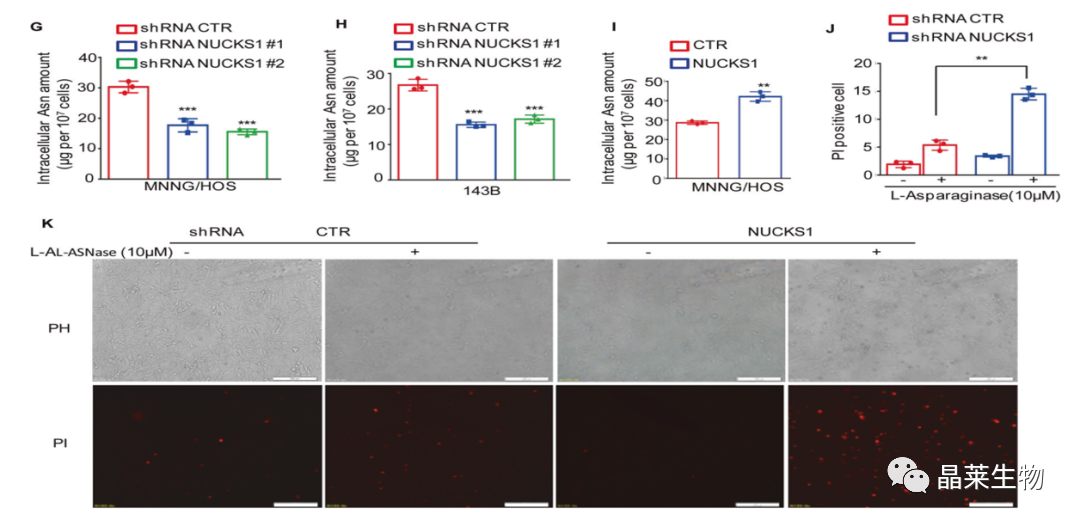
G和H. 与对照组细胞相比,NUCKS1表达降低减少了天冬酰胺的数量;
I. 高表达NUCKS1提高了天冬酰胺的水平;
J和K. L-天冬酰胺酶可促进ASNS低的肿瘤细胞凋亡,通过PI染色法进行细胞凋亡实验结果表明敲除NUCKS1促进了L-ASNas诱导的细胞死亡。
综上所述,这些发现表明NUCKS1可促进天冬酰胺的合成并抑制l-ASNase诱导的骨肉瘤细胞死亡。
5. NUCKS1 通过提高 ASNS 表达促进骨肉瘤肿瘤发生和转移

A. 与对照组相比,shRNA组ASNS的表达明显降低;
B-E. 通过细胞集落形成实验,结果显示ASNS的下调抑制了骨肉瘤细胞的生长和迁移;
F.在ASNS敲除的骨肉瘤细胞中过表达NUCKS1。
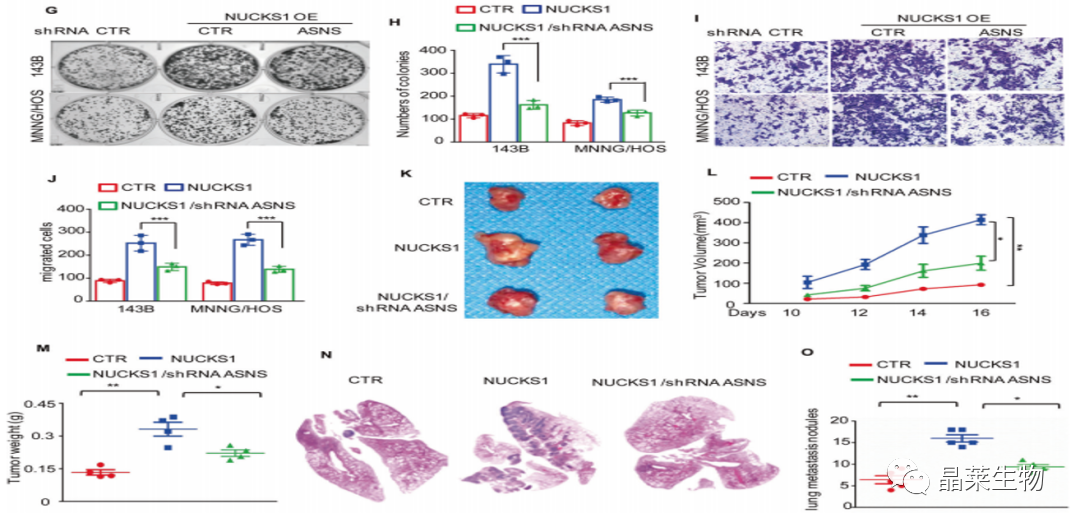
G-J. 通过单克隆实验和Transwell检测发现抑制ASNS减弱了NUCKS1对细胞的影响;
K-M. 通过动物体内实验结果表明抑制ASNS削弱了NUCKS1对肿瘤重量和体积的影响;
N和O.HE染色结果表明抑制ASNS削弱NUCKS1对肺转移的促进作用。
这些结果表明NUCKS1部分依赖于ASNS促进骨肉瘤细胞的生长和转移。
6. 骨肉瘤中ASNS升高与NUCKS1表达呈正相关
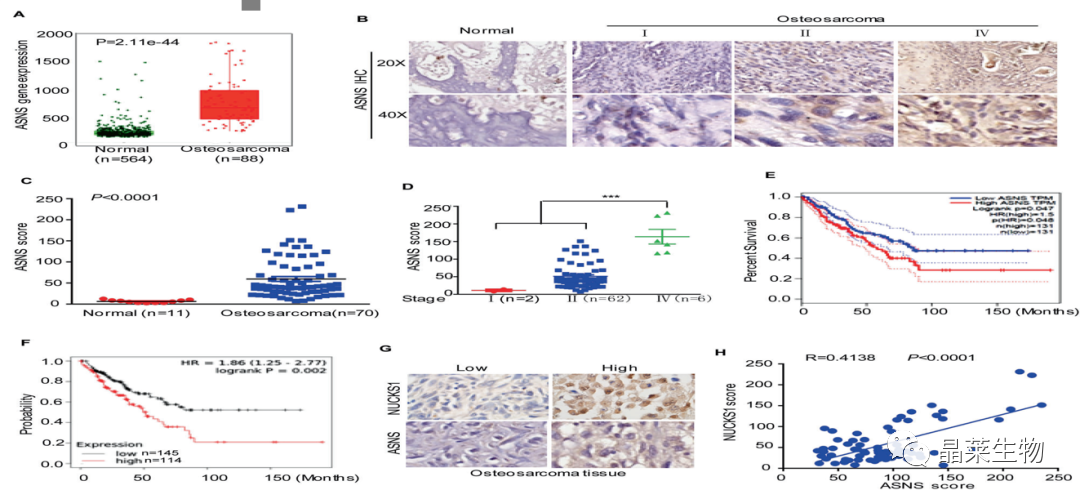
A. 通过TNMplot数据库表明骨肉瘤中ASNS表达水平冥想升高;
B和C. 免疫组化结果显示ASNS在骨肉瘤组织中的表达高于正常骨组织;
D.ASNS的表达水平与骨肉瘤的分期呈正相关;
E和F.通过数据库总结ASNS水平相对较高的患者比ASNS水平较低的患者生存率更低;
G和H.与NUCKS1低表达的骨肉瘤组织相比,ASNS在NUCKS1高表达的骨肉瘤组织中表达上调。
这些数据有力地验证了骨肉瘤组织中ASNS的增加,并且ASNS的表达与NUCKS1呈正相关。
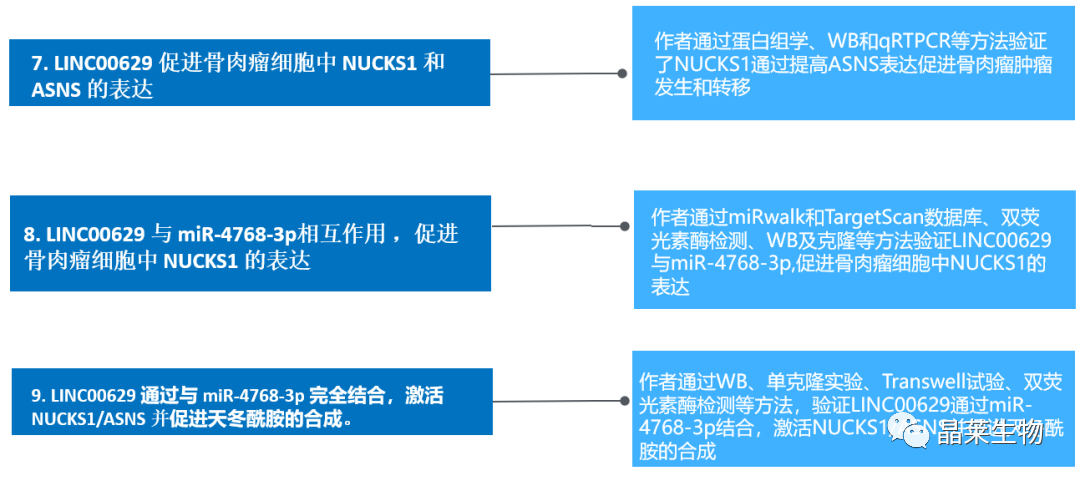
7. LINC00629 促进骨肉瘤细胞中 NUCKS1 和 ASNS 的表达
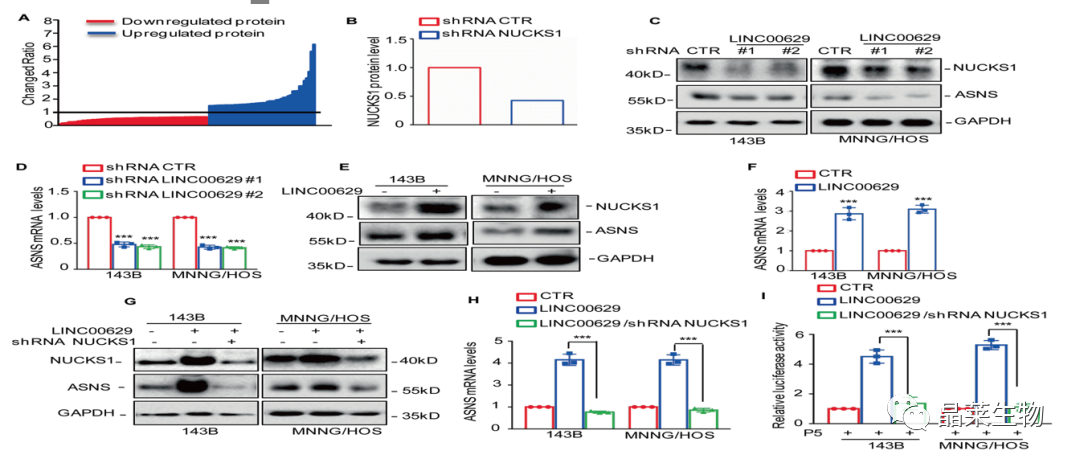
A和B. 通过蛋白组学鉴定了在MNNG/HOS细胞中LINC00629敲除与否的差异表达蛋白,结果表明在敲除LINC00629的细胞中NUCKS1被下调;
C和D. 在敲除LINC00629的骨肉瘤细胞中检测NUCKS1的表达,结果表明与对照组相比敲除LINC00629降低了NUCKS1和ASNS的表达;
E和F.过表达LINC00629促进了NUCKS1和ASNS的表达;
G和H.采用WB和qRTPCR法检测ASNS的表达,结果表明敲除NUCKS1会抑制LINC00629 对 ASNS 的上调作用;
I.通过测量双荧光素酶活性显示抑制 NUCKS1 可逆转 LINC00629 对 ASNS 启动子活性的影响。
这些结果揭示了 LINC1 促进骨肉瘤细胞中 NUCKS<> 和 ASNS 表达。
8. LINC00629 与 miR-4768-3p相互作用 ,促进骨肉瘤细胞中 NUCKS1 的表达
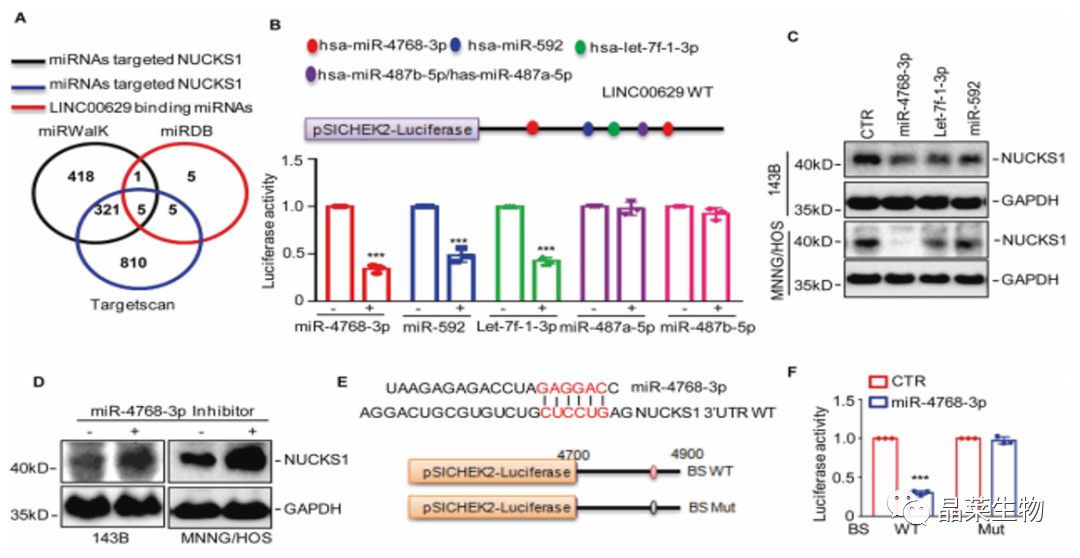
A. 通过数据库检索相关miRNAs合并在维恩图中,鉴定出重叠的miRNAs;
B. 结果表明前三个miRNAs降低LINC00629的荧光素酶活性,表明可能与LINC00629结合;
C.将这三种miRNAs转染骨肉瘤细胞,采用WB检测NUCKS1的表达,miR-4768-sp显著降低了NUCKS1的表达;
D.结果显示抑制miR-4768-3p增加了NUCKS1蛋白水平;
E.将可能含有miR-47683p结合位点的NUCKS1的野生型或突变型3ʹUTR克隆到pSICHECK2载体中;
F.将质粒转染到有或没有过表达miR-4768-3p的细胞中,过表达的细胞荧光素酶活性在野生型降低,当结合位点发生突变,酶活性的下降消失。
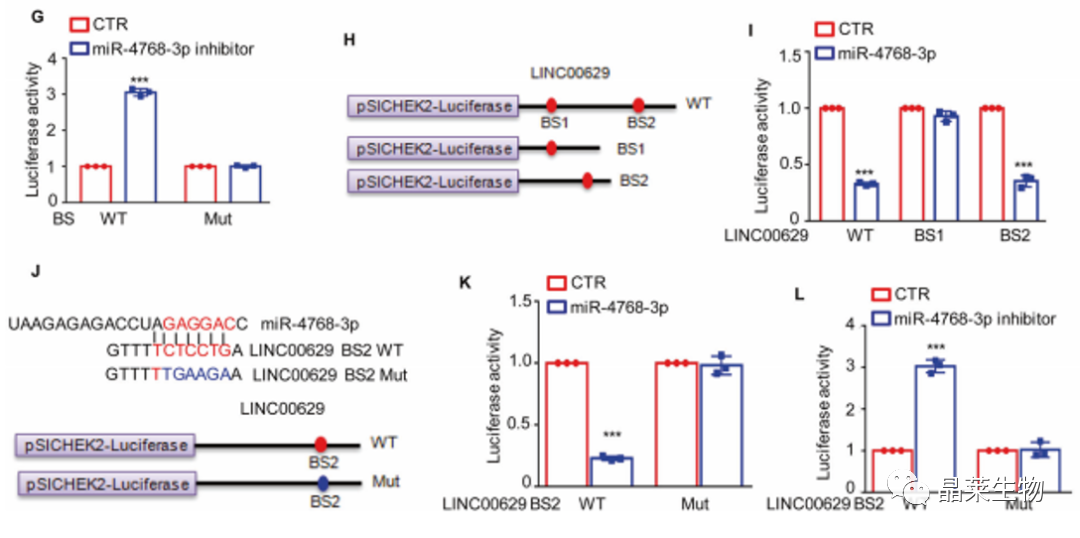
G. 结果表明抑制miR-4768-3p提高野生型NUCKS1 3’UTR的荧光素酶活性,而对突变体没有影响;
H. 为了鉴定miR-4768在LINC00629上的阳性结合位点并确认它们的关系,作者将LINC00629和两个截断插入pSICHECK2载体,分别为WT、BS1和BS2;
I.结果显示miR-4768-3p抑制了LINC00629 WT和BS2的荧光素酶活性,而对BS1的活性没有影响;
J.将野生型或突变型的LINC00629 BS2克隆到pSICHECK2载体中
K.miR-4768-3p抑制了LINC00629 BS2 WT的荧光素酶活性,而对BS2 Mut没有影响;
L.抑制miR4768-3p也同样提高了LINC00629 BS2 WT的荧光素酶活性,对BS2 Mut无影响。
数据表明LINC8作为miR-00629-4768p海绵并促进骨肉瘤细胞中的NUCKS3表达。
9. LINC00629 通过与 miR-4768-3p 完全结合,激活 NUCKS1/ASNS 并促进天冬酰胺的合成
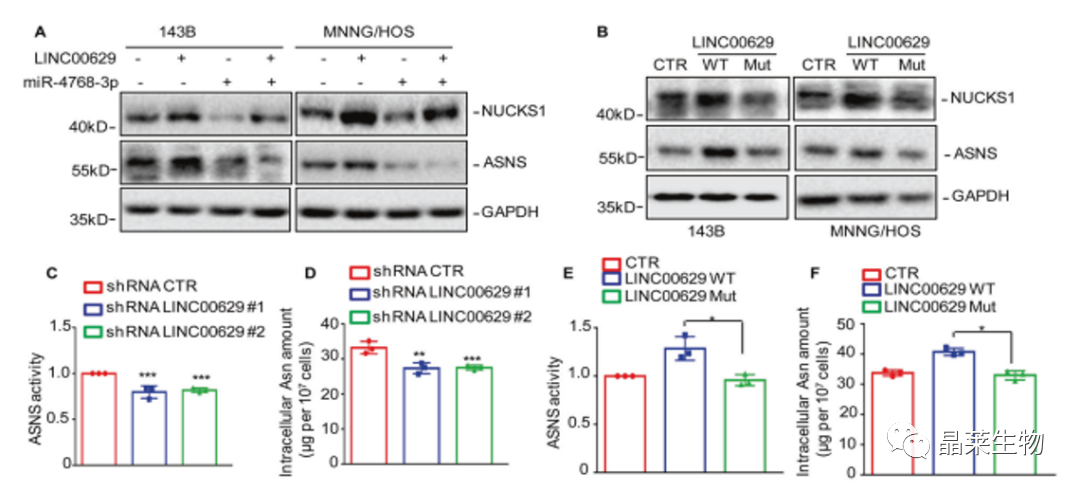
A. 将miR4768-3p转染到LINC00629的143B和MNNG/HOS细胞中,WB验证结果显示过表达miR-4768-3p抑制LINC00629诱导的NUCKS1和ASNS的表达;
B. 将含有miR-4768-3p的野生型结合位点(WT)或突变结合位点(Mut)的全长LINC00629插入到pCDH载体中,LINC00629 WT显著提高了NUCKS1和ASNS的表达,但当结合位点发生突变时,表达降低;
C和D.结果显示敲低LINC00629降低了ASNS活性和天冬酰胺(Asn)水平;
E和F.LINC00629 WT的过表达提高了ASNS的活性和Asn水平。
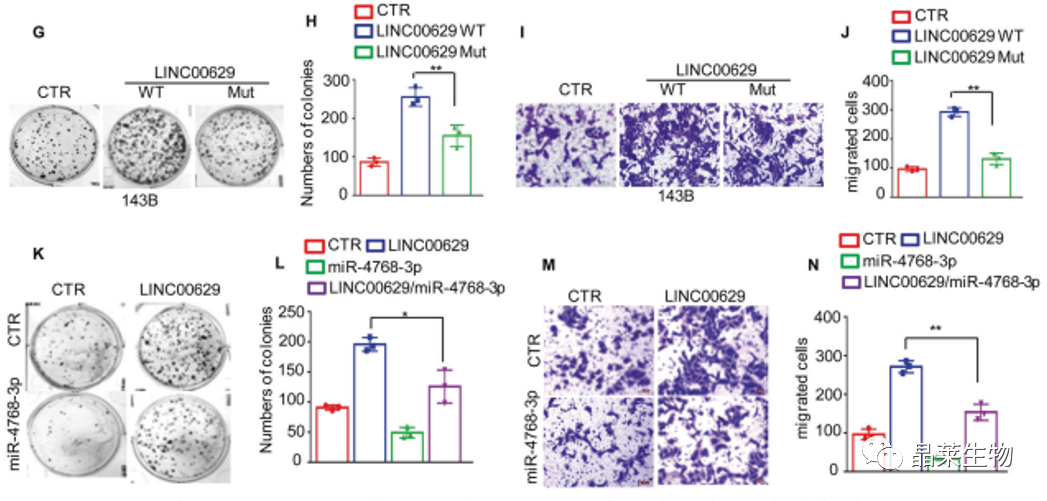
G-N. 通过细胞克隆实验和Transwell检测结果显示LINC00629促进了骨肉瘤细胞的生长和迁移。然而,LINC00629 Mut或miR-4768-3p抑制了促进作用。
这些数据表明LINC00629激活NUCKS1 / ASNS轴并通过与miR-4768-3p完全结合来促进天冬酰胺的合成。
文献结论
①在本研究中,我们发现NUCKS1在骨肉瘤中发挥致癌作用,并通过上调ASNS的表达来促进天冬酰胺的合成。
②由NUCKS1高表达提高了ASNS或天冬酰胺的产生,促进了细胞的生长和转移。
③LINC00629通过完全结合miR-4768-3p来上调NUCKS1和ASNS的表达
④该文揭示了NUCKS1在骨肉瘤中的作用,并发现NUCKS1促进了骨肉瘤细胞的生长和转移。
本文研究结果强调了NUCKS1在调节天冬酰胺代谢中的作用,并揭示了LINC00629是NUCKS1的重要调控因子。为以后治疗骨肉瘤提供新的思路
文献涉及实验技术

关注公众号,了解更多!















