国自然热点 “铜死亡” 之铜通过靶向脂酰化TCA循环蛋白诱导细胞死亡
时间:2023-02-20 阅读:1520Copper induces cell death by targeting lipoylated TCA cycle proteins
铜通过靶向脂酰化TCA循环蛋白诱导细胞死亡

期刊:Science
影响因子:63.714
发表时间:2022年
研究背景
铜是生物体内不可缺少的一种微量元素,参与体内多种生物活动,包括氧化应激、脂质代谢和神经递质合成。铜稳态的失衡可诱发细胞自噬、细胞毒性等,与许多疾病的发展密切相关,包括神经退行性疾病、糖尿病和癌症等。铜代谢稳态和铜诱导细胞死亡的机制尚不清楚。因此,进一步研究铜代谢稳态的机制及相关信号通路具有重要意义和前景。铜螯合剂的应用有望成为多种疾病辅助治疗的重要组成部分。
细胞死亡,常见的有细胞坏死、细胞凋亡、坏死性凋亡、铁死亡、焦亡,不同细胞死亡形式发生机制不同,具有不同特征,铁死亡是一种铁依赖性死亡形式,铜也是生物体内不可缺少的一种微量元素,铜诱导的细胞死亡是否区分于已知细胞死亡形式,能作为一种新的细胞死亡形式进行描述?
文献研究的科学问题
1. 如何验证铜诱导的细胞死亡,是一种与已知的细胞死亡方式截然不同的细胞死亡形式?
3. 铜诱导细胞死亡由哪些通路所参与?调控的确切机制?
4. 铜诱导的细胞死亡,有哪些特征?关联到哪些疾病?
文献主要内容
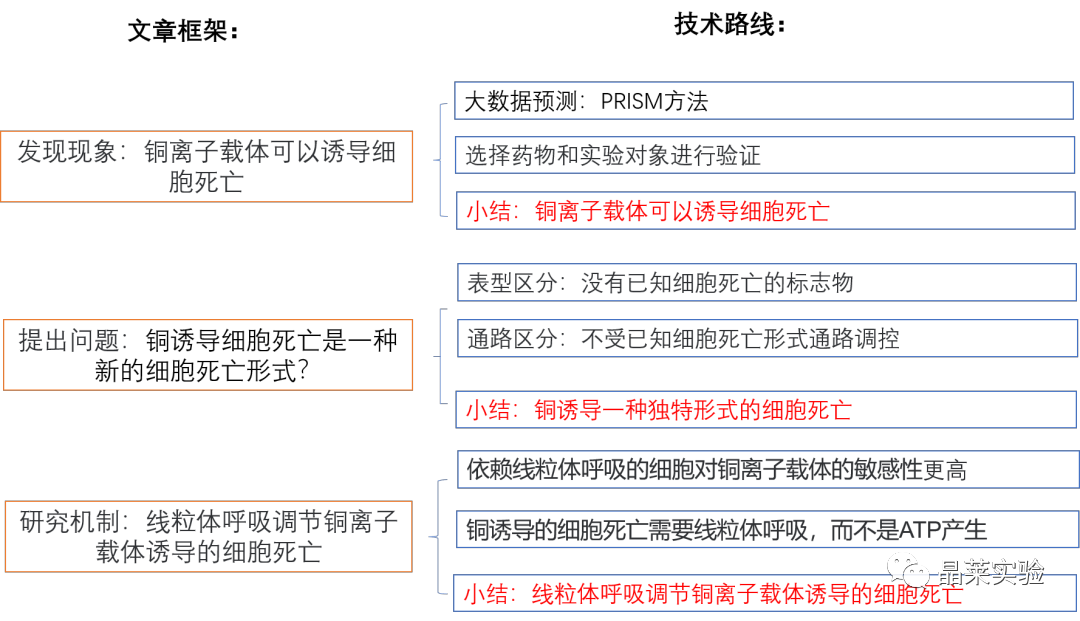
1.发现了铜离子载体可以诱导细胞死亡;
2.确定了铜诱导一种独特形式的细胞死亡,区分于凋亡、铁死亡、坏死等死亡形式;
3.发现了线粒体呼吸调节铜离子载体诱导的细胞死亡;
4.筛选出FDX1和蛋白脂酰化是铜离子载体诱导细胞死亡的关键调节因子;
5.FDX1是蛋白质脂酰化的上游调节剂;
6.验证了铜可直接结合并诱导脂酰化DLAT的齐聚化;
7.验证了铜诱导的细胞死亡机制与铜稳态失调的疾病模型相同。
文章框架&技术路线

研究结果及分析
1. 铜离子载体可以诱导细胞死亡
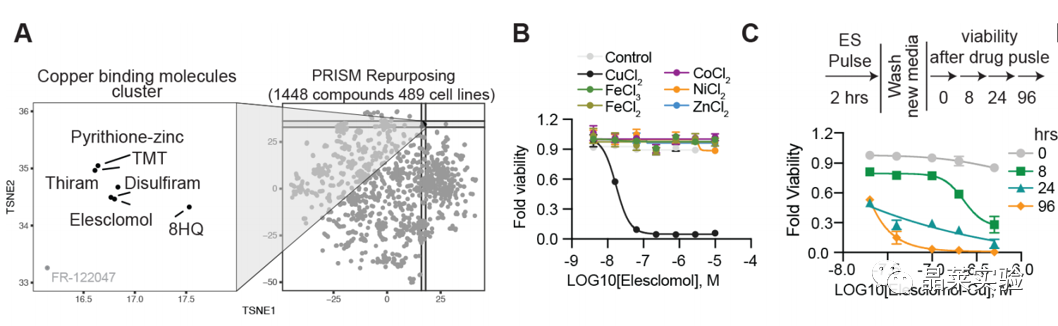
A.PRISM方法预测1448种不同药物对489个细胞株生长抑制作用,铜离子载体可以抑制细胞活力。
B.伊利司莫±10μM不同金属金属处理后的细胞活力,只有铜离子载体能抑制细胞活力,与载体无关。表明铜离子载体可以诱导细胞死亡。
2. 铜诱导一种独特形式的细胞死亡
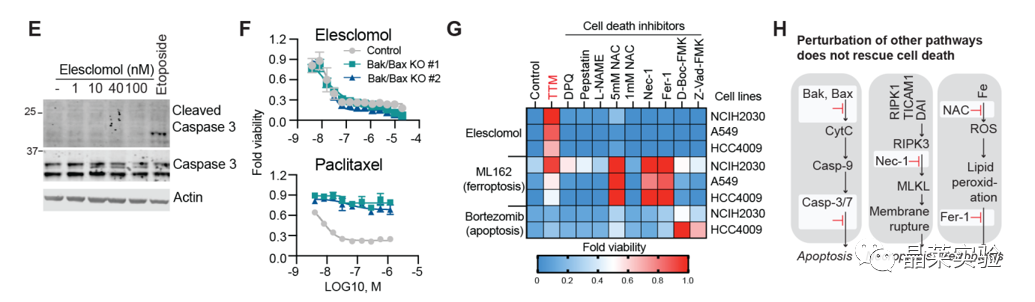
E.铜离子载体伊利司莫诱导的细胞死亡不涉及细胞凋亡标志物半胱天冬酶3的切割或激活。
F.铜离子载体处理Bax/Bak敲除HMC18细胞株,仍具有杀伤活性。
G.其他已知细胞死亡机制的抑制剂处理,铜诱导的细胞死亡未被抑制。
H.细胞凋亡、坏死性凋亡和铁下垂示意图。表明铜诱导的细胞死亡,区分已知死亡形式。
3. 线粒体呼吸调节铜离子载体诱导的细胞死亡
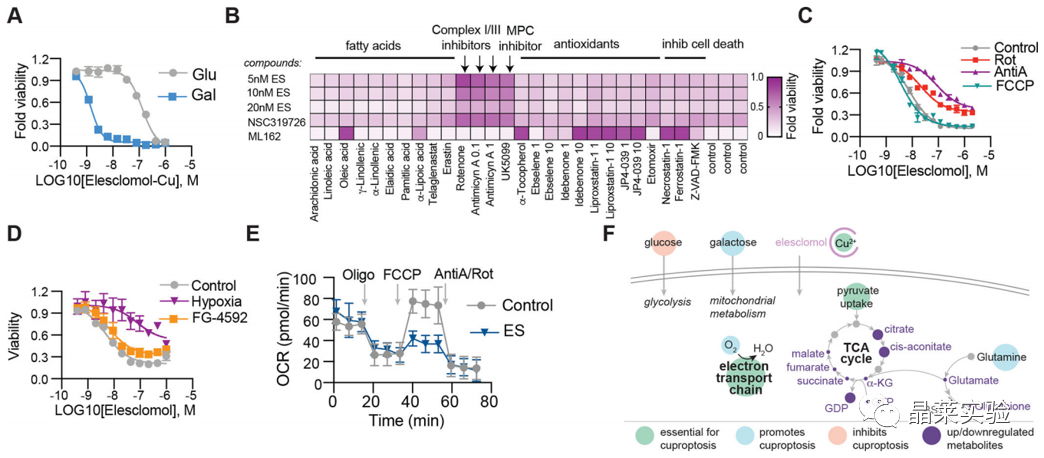
A.半乳糖替换葡萄糖培养,提高细胞对铜载体的敏感性。
B.电子传递链(ETC)的复合物I和II抑制剂以及线粒体丙酮酸摄取抑制剂会减弱铜载体诱导的细胞死亡。
C.线粒体解偶联剂FCCP对铜诱导的细胞毒性没有影响。表明铜诱导的细胞死亡依赖线粒体呼吸,而不是ATP产生,依赖线粒体呼吸的细胞对铜离子载体的更敏感。
4.1 全基因组CRISPR / Cas9功能丧失筛选确定参与铜离子载体诱导死亡的基因
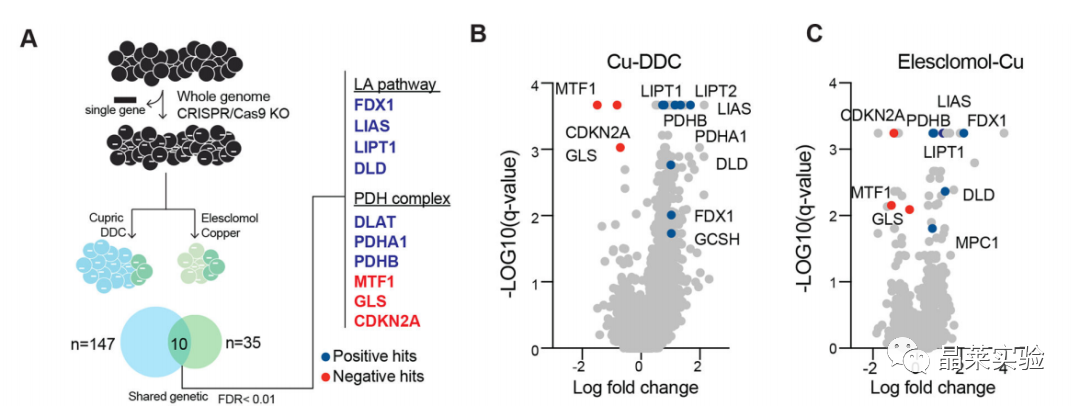
发现了七个铜死亡相关的关键基因,包括FDX1、硫辛酸途径(LIPT1、LIAS 和 DLD)、脂酰化蛋白质靶标(丙酮酸脱氢酶复合物,DLAT、PDHA1 和 PDHB)。
4.2 FDX1、蛋白质脂酰化机制与铜死亡有密切的联系
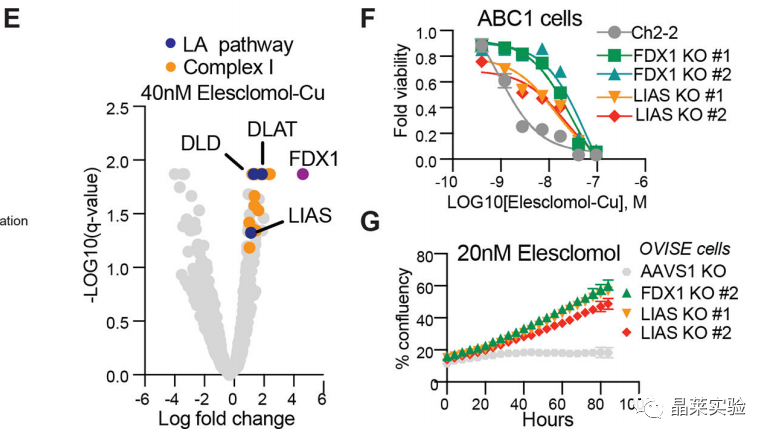
单个基因敲除研究进一步证实,FDX1和LIAS(脂酰合酶)的缺失赋予了对铜诱导的细胞死亡的抵抗力。说明FDX1、蛋白质脂酰化机制与铜死亡有密切的联系。
5.1 LA和FDX表达之间存在很高的相关性
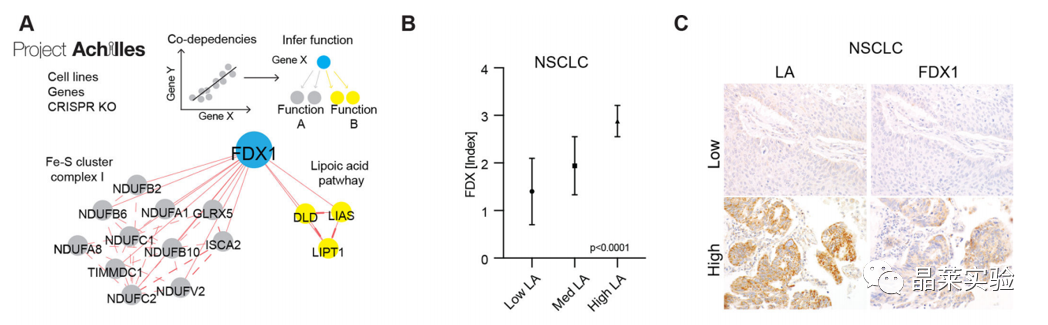
5.2 FDX1是蛋白质脂酰化的上游调节剂
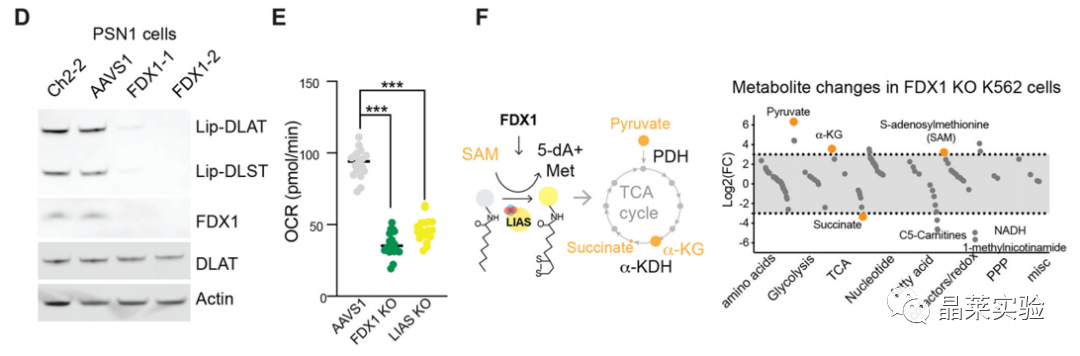
敲除FDX1基因后,耗氧率测量,脂酰化蛋白质表达量检测,硫辛酸途径相关的代谢物含量变化测量,表明FDX1是蛋白质脂酰化的上游调节剂。
5.3 FDX1是蛋白质脂酰化的上游调节剂
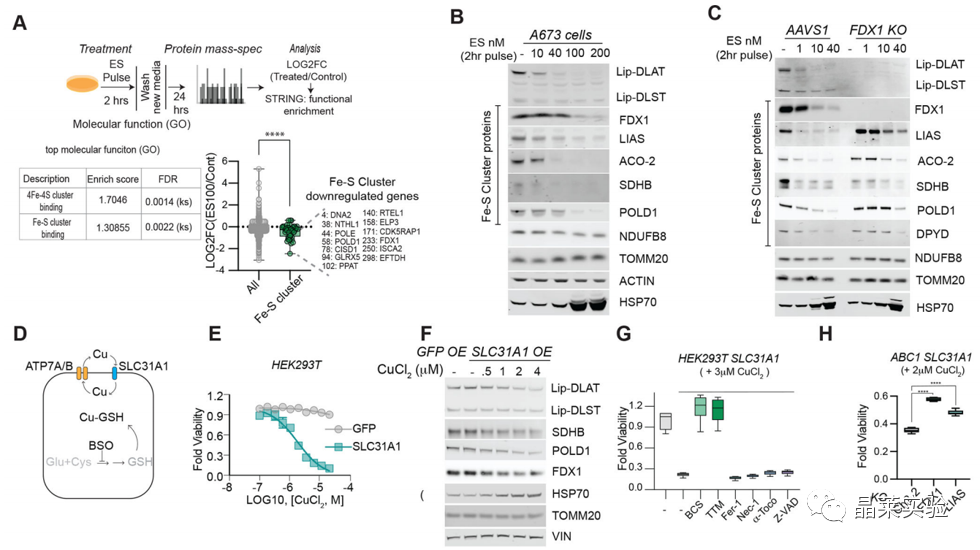
敲除FDX1基因后,耗氧率测量,脂酰化蛋白质表达量检测,硫辛酸途径相关的代谢物含量变化测量,表明FDX1是蛋白质脂酰化的上游调节剂。
6. 铜直接结合并诱导脂酰化DLAT的齐聚化
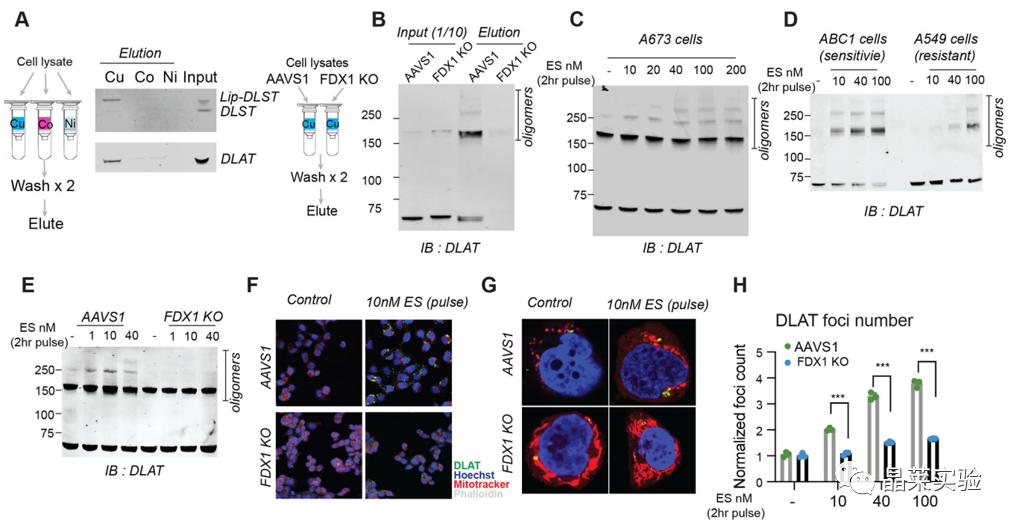
指定金属负载树脂洗脱蛋白进行免疫印迹分析,只有铜离子负载树脂下拉到ALAT蛋白;敲除FDX1基因后,铜离子负载树脂下拉到ALAT蛋白促进蛋白质蛋白质寡聚化。
7. 铜诱导的细胞死亡机制与铜稳态失调的疾病模型相同
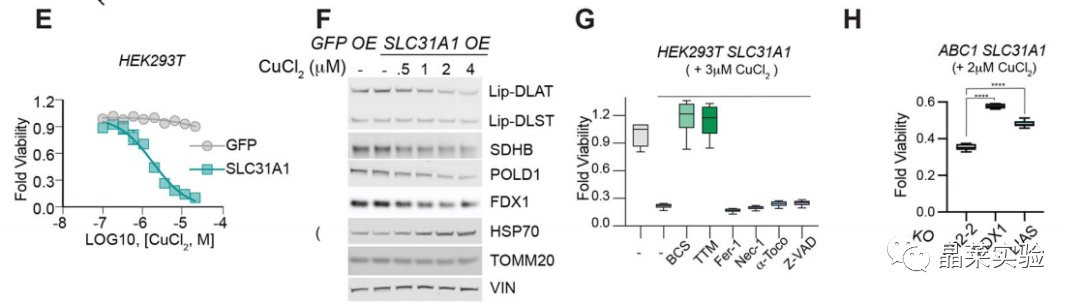
在HEK31T和ABC1细胞中过表达铜失调综合征Menke病和Wilson病编码基因SLC293A1,显著增加了细胞对铜诱导死亡的敏感性,导致参与线粒体呼吸的蛋白质表达减少,减少蛋白质脂酰化,降低Fe-S簇蛋白水平,增加HSP70水平。
铁死亡、坏死凋亡和细胞凋亡抑制剂不能阻止SLC31A1过表达细胞中铜诱导的细胞死亡。
文献结论
铜依赖性细胞死亡,依赖于线粒体呼吸,与已知的死亡机制不同,由线粒体铁氧还蛋白 1 介导的蛋白质脂酰化调节。
创新性:发现了一种新的细胞死亡形式及关键调控机制
文献涉及的实验技术

关于晶莱
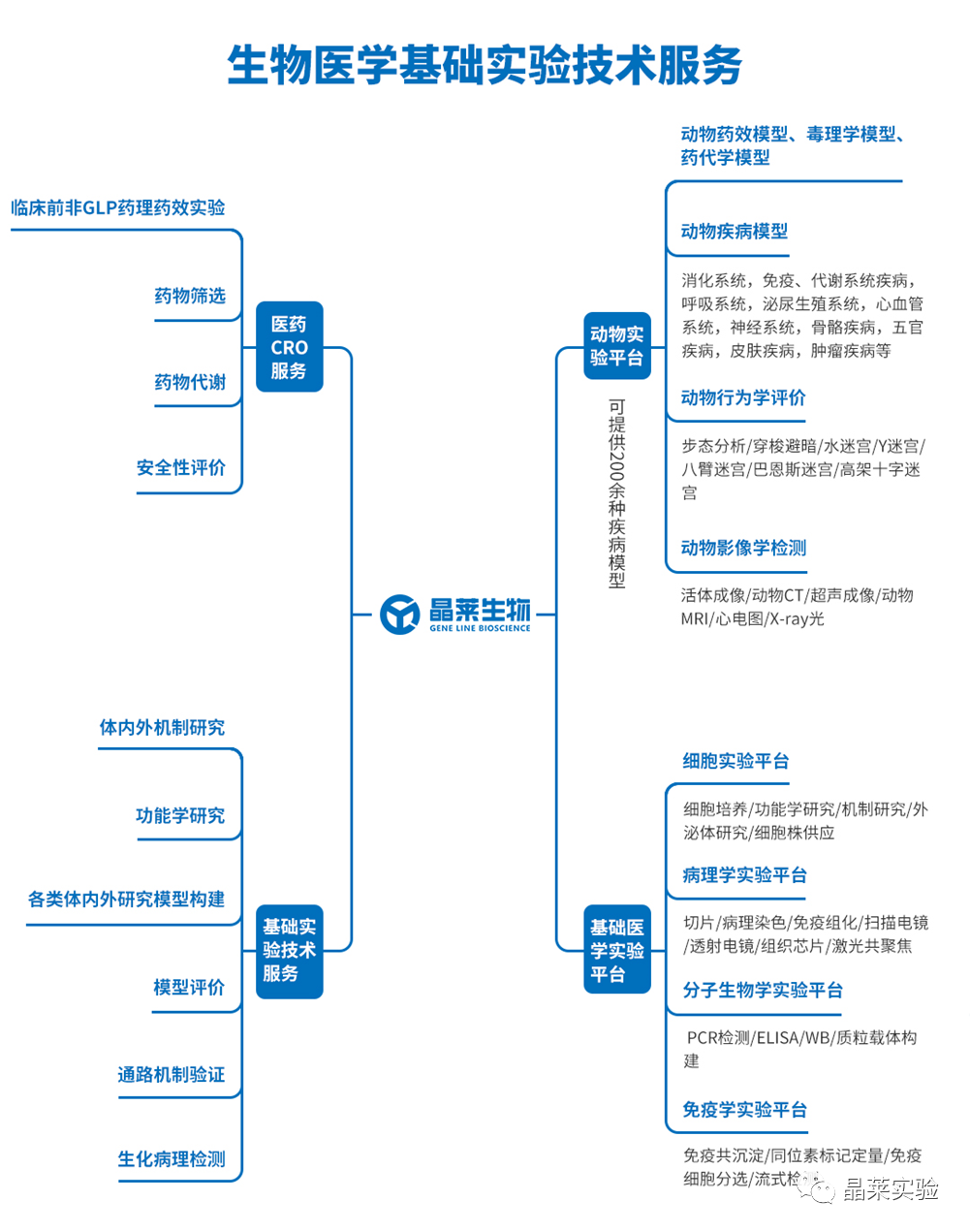
晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。
与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。

晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。