白血病动物模型构建大全
时间:2023-02-20 阅读:1287白血病是一种恶性疾病,其根本特征是白血病细胞在骨髓及其他造血组织中呈恶性、无限制地增生,浸润全身各组织和脏器,同时对骨髓中的造血细胞的造血功能具有显著的抑制作用,使患者易发生严重的感染或继发性的败血症、引起出血、肠功能衰竭、高尿酸血症等,严重威胁到患者的生命。
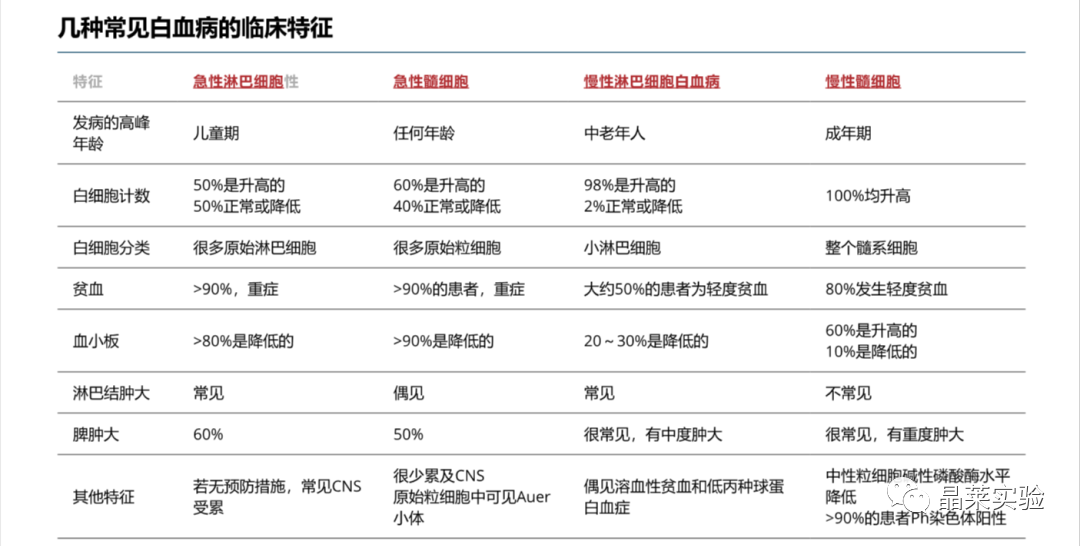
WHO分类基于临床,形态学,免疫表型和遗传特征的组合将白血病分为慢性淋巴细胞白血病、慢性髓系白血病、急性淋巴细胞白血病和急性髓系白血病4类。
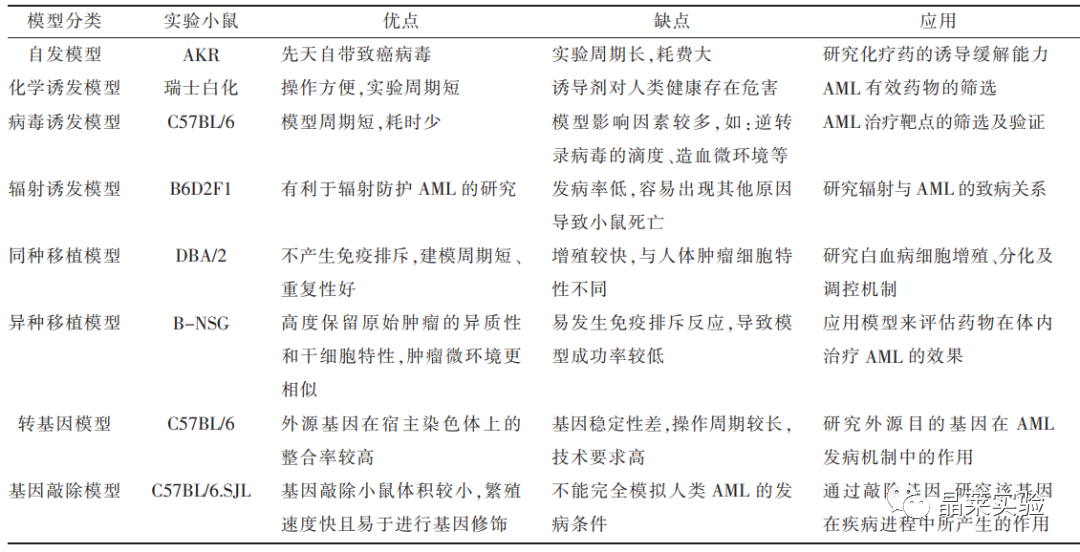
对于白血病的研究,小鼠在生物学、遗传学、造血系统等方面与人类相似,因此是较为理想的动物白血病模型。用于白血病动物模型一般分为近交系和突变系两种,简要总结见表:

常用的白血病模型有4种:诱发性白血病模型、嵌合体、转座子和病毒诱导模型、转基因(基因修饰)模型和异种移植模型。
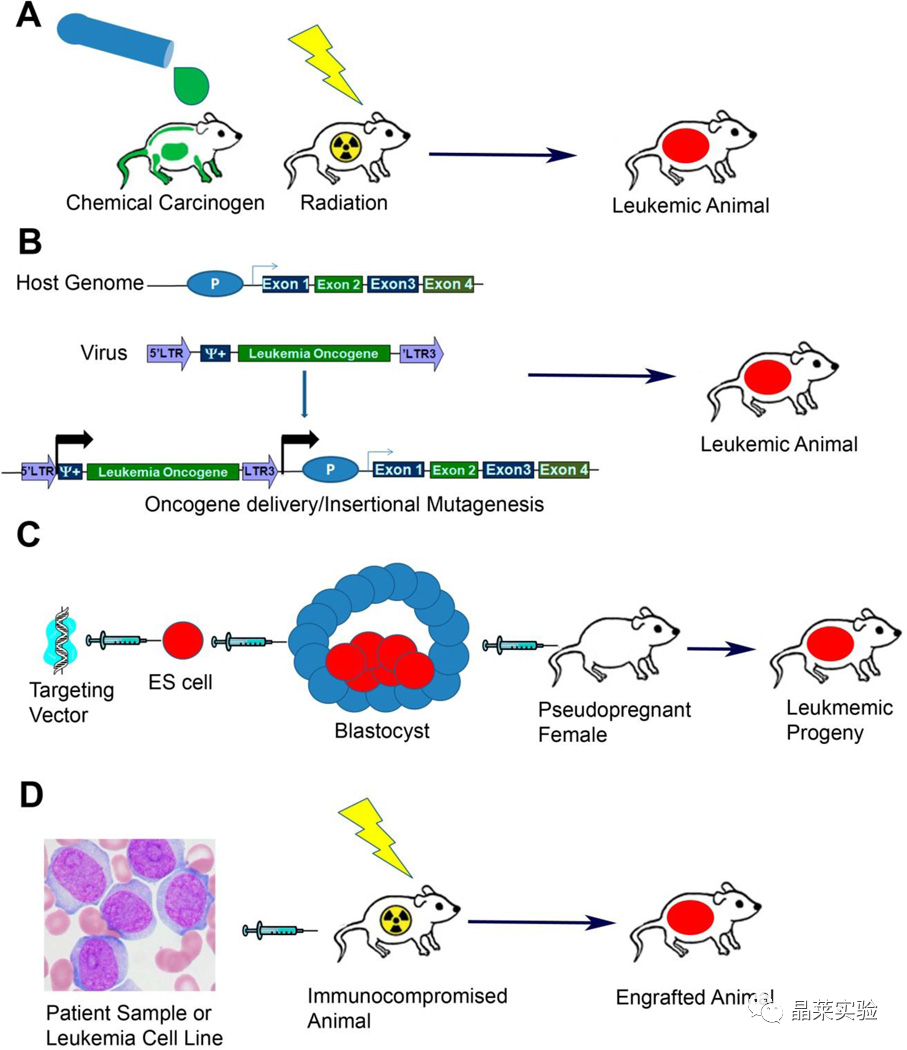
A诱导模型:将易感品系的动物暴露于致癌化学品或电离辐射中。暴露后,对动物的白血病发展进行跟踪;
B嵌合体、转座子和病毒诱导模型:在嵌合体模型中,造血干细胞从供体小鼠身上采集,并转染了编码癌基因的病毒。病毒整合到宿主的基因组中,导致癌基因的传递和表达。除了癌基因的传递,病毒的插入还可以导致细胞原癌基因的异常表达,如果嵌合发生在基因内,则导致细胞肿瘤抑制因子的破坏。
C基因工程模型:将已设计好的靶向载体导入小鼠ES细胞中。然后将整合了载体的ES细胞注射到四倍体囊胚中,再将其注射到假孕代孕母亲体内。另外,也可以将载体直接注射到受精卵中,然后将这些卵子植入代孕母亲体内。然后监测后代的白血病发展。
D异种移植模型:原发性患者样本或人类细胞系可以直接注射到免疫力低下的宿主动物体内。在注射样本之前,宿主动物常被暴露在电离辐射下,以抑制免疫功能。
自发性白血病是特发性的,或者是在病毒或化学物质暴露后出现的,可以更准确地模拟临床状况。
① AK小鼠可自发产生白血病,多为胸腺来源的淋巴细胞白血病。这些小鼠出生时携带致癌RNA病毒,8月龄白血病发生率60%-90%,其动力学类似于AML。
② C58小鼠,其在12个月后发病率在90%以上,多为淋巴细胞白血病。
自发性白血病通常只有在其病程的后期才能测量到,转移模式不一致,对治疗的反应很差。疾病的潜伏期至少为3个月,其中错误的疾病分期会导致这些模型不适合对统一的治疗反应进行定量评价。
诱发性白血病模型是指用物理或化学的方式作用于小鼠,使其产生白血病。
化学方法模型,让DBA/2小鼠接触致癌物3-甲基胆蒽(3-MC)而分离出的L1210、P388和L5178Y细胞系,这些细胞可以在体外繁殖,移植后会导致继发性白血,是最成功的用于临床实验的药物广谱筛选工具。
物理方法模型则是通过一些电离辐射诱发小鼠形成白血病模型。诱发性白血病模型优点是操作方便,缺点是成膜效率低,并且模型小鼠的个体差异过大。
造模举例:
① 在8周龄WKAH/Hkm大鼠上,每周5天口服给药6mg的N-丁基亚硝基脲(溶解在0.3 mL乙醇种,再用饮用水稀释至15 mL),连续给药15周。处理组总诱导白血病为60%±6%,在白血病大鼠中,白细胞的数量急剧增加,并伴随贫血和血小板减少症。
② 3周龄Long-Evans大鼠经尾静脉注射二羟甲基丁酸(DMBA)的脂质乳剂(含有15%的棉籽油、0.5%的DMBA、大豆卵磷脂和Pluronic F68),使用25 ~ 45mg/kg的DMBA剂量,以10~14天的间隔处理5次,采用逐次降低剂量方案(45、4 0、3 5、30 和25 mg/kg)。通过血液检查发现,外周血在晚期显示轻度或中度白细胞增多;组织学检查可观测到胚细胞侵入红髓、淋巴滤泡保存至晚期;在淋巴结、骨髓和肾上腺中层不断发现白血病浸润。
③ 2周龄WOP/H-Onc或Wistar/H-Onc大鼠通过尾静脉注射5mg DMBA,每隔8至12天一次,共四次,可以在5-9月内在10%的大鼠中诱导白血病,该症状与人AML表现出一致性。
④ 使用150mg/kg苯处理6周龄C3H/He小鼠,每天一次,每周5天,持续四周将导致小鼠红细胞、白细胞等均发生改变。Khan等用1:10稀释的氯仿/2-丙醇([50/50]v/v)静脉注射150g Wister大鼠,每次0.2ml,每两天给药一次持续3周,可以成功诱发Wister白血病。
⑤ SJL/J小鼠白血病临床表现与继发性人类AML非常相似,将三个月大的小鼠暴露于3Gy全身照射,随后1至3小时后皮下接种0.5mg地塞米松即可,成功率为90%。
⑥ C3H模型被认为是AML最有利的模型,暴露于3Gy X辐射或苯后AML发病率高,潜伏期低,在细胞学、组织病理学和分子水平上与人类AML相似。
⑦ hHF-tg小鼠经过1.2 Gy /周的X射线照射,连续4周,80%的hHF-tg小鼠发生胸腺淋巴瘤/白血病。
小鼠白血病病毒(MuLV)已被广泛用于在敏感小鼠品系(NIH/Swiss、DBA/2、AKXD、BXH-2和C57BL/6)中诱导非B细胞和非T细胞白血病,被认为是揭示白血病发病机制的最简单的逆转录病毒之一。
造模举例:
① 经采用HTLV-1 感染MT2细胞后以2.5×106的计量腹膜内接种到24至28周玲的IBMI-huNOG小鼠,接种后4至6 周,其成人T细胞白血病样症状开始表现,包括肝脾肿大、HTLV-1感染T 细胞的克隆增殖、外周血涂片有白血病细胞的出现,表明HTLV-1感染的IBMI-huNOG 小鼠产生了成人T 细胞白血病。
② 利用含MLL-AF9 的逆转录病毒感染小鼠骨髓c-Kit细胞,体外培养后经尾静脉注射小鼠体内,于6~ 12 周出现白血病样体征,肝、脾组织切片、外周和骨髓血涂片均显示有大量白细胞浸润,小鼠发生髓系白血病。
除了病毒介导的插入诱变外,还开发了基于转座子的系统,最著名的是Sleeping Beauty转座系统,作为一种非病毒载体转基因技术,可以将特定DNA序列插入小鼠基因组中,该系统已被用于识别协同突变,为NPM1c+AML提供了新的发病见解和潜在的治疗靶点。
常规转基因模型小鼠是将含有目标ORF的DNA片段直接注射到受精卵母细胞原核中,然后将其注入假孕雌鼠中。通过使用调控元件hCG和MRP8控制PML-RARA表达能够诱导小鼠产生AML或APL样表型。
但经典转基因小鼠方法效率低下、技术困难、时间成本高。因此后续发展出ES细胞同源重组的转基因小鼠模型。
由于小鼠胚胎干细胞(ES)中定向同源重组(HR)的发展,克隆DNA的整合部位可以特异性地指向所需的基因座。
研究表明,通过同源重组成功地将一个短的MLL外显子(8-AF9 cDNA-poly-A)片段整合到小鼠Mll1位点中,诱发小鼠产生AML。同时,将Mll1外显子8于细菌lacZ基因链接也可以诱导小鼠产生白血病。
造模举例:
MLL-AF9(Kmt2atm2(MLLT3)Thr/KsyJ)转基因小鼠,C57BL/6J经过 4.5 Gy(62.36 cGy/min)全身照射清髓,4h接受静脉移植MLL-AF9+MLL-AF9(Kmt2atm2(MLLT3)Thr/KsyJ)的骨髓或脾细胞(1×106/ml),14天后连续5天注射腹腔注射阿糖胞苷50mg/kg,即可在第22至25周引导白血病发作。
异种移植模型是最常用的动物模型,通过皮下注射、腹腔注射及尾静脉注射建立人源化可移植性白血病模型,成功率高,不能自发痊愈,需要借助外界因素,因此该模型在白血病实验研究和抗癌药物筛选等领域具有广泛用途。
细胞来源可分为白血病细胞系细胞、患者来源的细胞以及转染的小鼠骨髓细胞。
在接种细胞之前,需要尽可能地破坏小鼠体内残存的免疫力,方法有射线辐射法和药物处理两种。
射线辐射是指用半致死的 γ 射线辐射小鼠,药物处理是指用免疫抑制剂来破坏小鼠的残存免疫力,常用的有环磷酰胺等。
根据实验目的选择不同的小鼠和细胞后,通常的接种方式有皮下接种、眼眶后接种、骨髓接种和尾静脉接种。
1)皮下接种 是较为常见的一种接种方式,其优点是操作简便,易于观察,成瘤效果好。
BALB/c小鼠7-Gy( 60 Co,80 cGy/min) 剂量的全身照射6h后移植A20 B淋巴瘤细胞和供体BM 细胞,成功诱导小鼠淋巴瘤白血病的发展。皮下接种的验证成瘤方式为直接观察,并用游标卡尺测量肿瘤的长和宽,在肿瘤达到 100~150 mm时开始使用药物处理,当肿瘤过大或者注射细胞 30 天左右处死小鼠,取出肿瘤和需要的脏器进行切片染色,蛋白样品,单细胞悬液进行白血病验证。
2)眼眶后接种 在异种移植模型中属于应用较少的方式,目前报道有3种方式:
① 通过眼眶后接种将 C1498 细胞移植到 C57BL/6 小鼠(1 ×106个细胞/小鼠);
② 从 hCG-PML-RARα 转基因小鼠获得的白血病细胞(2 × 106个细胞/小鼠)注射到10~12 周龄的 NOD-SCID 小鼠眼丛中;
③ 将 MV-4-11 细胞(2.5 × 106个细胞/小鼠)通过眼眶后接种到 NOD-SCID 小鼠。NOD-SCID 小鼠是眼眶后接种的首选实验对象,而眼眶后接种的最大缺点可能在于实验难度过大,建模成功率不高。
3)骨髓接种 是指通过钻骨针在小鼠股骨钻孔,然后使用微量进样器将白血病细胞直接注入骨髓腔的接种方式。这种方式通常都用来观察白血病细胞对骨的破坏性以及白细胞骨转移后的治疗方式。目前报道的接种方式如下:
① 将 HEL 细胞注射到 NSG小鼠(1 × 105个细胞/小鼠)的右胫骨中;
② 将白血病患者的外周血中分离得到的CD34+细胞注射到 NSG 小鼠(0.2 × 106 ~ 1.18 ×106个细胞/小鼠)的股骨中;
③将 MV-4-11-luc 细胞(1 × 106细胞/小鼠)注射到雌性 NOD-SCID 小鼠的左胫骨骨髓,通过全身的生物发光成像监测肿瘤生长;
④ 将原始 AML 细胞(2 × 106~3 × 106个细胞/小鼠)注射到雌性 NOD-SCID 小鼠的右股骨中,一段时间后处死取左股骨,收集骨髓腔中的细胞,通过流式定量评估左股骨中的原代 AML 植入。
骨髓接种白血病细胞之后,通过基于流式细胞术的血液(纵向)和外周器官(末期疾病阶段)中肿瘤细胞数量的计数来评估肿瘤进展。
NSG 小鼠和 NOD-SCID 小鼠是骨髓接种的热门动物;骨髓接种的最大优点在于其模拟发源于骨髓的白血病在小鼠体内的发展过程,这对研究白血病在人体的发展具有重要借鉴作用。
4)尾静脉接种 是指将细胞通过尾静脉直接接种到小鼠的血液系统中,主要优点是可形成全身性扩散的白血病模型,符合白血病临床进展规律,此模型以动物生存期作为评价药效的主要指标。
尾静脉注射白血病细胞后,可通过白细胞(white bloodcell,WBC)计数、活体成像(注射细胞带有荧光素酶基因)、流式细胞仪每周监测血液学计数等方法,并利用以下标准验证白血病模型是否构建成功:外周血中存在至少 1%的原始细胞和 3 × 104细胞/L 以上的白细胞增多,血红蛋白水平低于 10 g/dL,血小板低于 5 × 105细胞/L。接种人源白血病细胞的受体小鼠多数为 NSG小鼠;接种小鼠白血病细胞 C1498 细胞则多选用C57BL/6 小鼠。